
3.2. Reaktsiooni energiadiagramm ja aktivatsioonienergia
Miks sõltub kiirus kontsentratsioonist ja temperatuurist
Reaktsioon toimub seda kiiremini, mida suurem on reageerivate ainete kontsentratsioon ja mida kõrgem on osakeste energia ehk mida rohkem on aktiivseid põrkeid.
Vaatame vesiniku reaktsiooni gaasilise joodiga (temperatuur peab olema nii kõrge, et jood oleks gaasilises olekus):
H2 + I2 → 2 HI
Selleks, et vesiniku- ja joodimolekul reageeriksid, peavad nad sattuma lähestikku ehk kokku põrkama. Mida tihedamalt osakesed paiknevad, seda rohkem on vesiniku- ja joodimolekulide vahelisi põrkeid ja seda kiirem on ka reaktsioon. Ehk ainete kontsentratsiooni kasvades kasvab.
Tegelikult ei piisa vaid sellest, kui reageerivad osakesed nagu pallid kokku põrkavad ja siis uuesti eemale lendavad. Nad peaksid nii kaua koos püsima, et vanad sidemed jõuaksid katkeda ja uued tekkida.
Temperatuur suurendab kõigi reaktsioonide kiirust.
Selleks, et ühendis vanad sidemed katkeksid, on vaja energiat. Järelikult võivad saaduse anda vaid need põrked, mille osakesed on selleks piisava energiaga. Elementaarakti toimumiseks vajaminevat energiat nimetatakse aktivatsioonienergiaks ja vastavaid põrkeid aktiivseteks põrgeteks. Kuna kõrgemal temperatuuril on piisava energiaga osakesi rohkem, on reaktsioon järelikult ka kiirem.
Kas reaktsioon saab toimuda ka vastassuunas
Lühike vastus on “nii ja naa”.
Kui ampull täita toatemperatuuril N2O4-ga, mis on värvitu gaas, siis hakkab ampulli sisu värvuma pruuniks: ampulli tekib NO2. Kui aga sulgeda ampulli puhas pruuni värvusega NO2 ja jahutada ampull 0 oC-ni, siis muutub ampulli sisu heledamaks – tekib N2O4. Nii saame reaktsiooni kirja panna järgnevalt:
N2O4  2NO2.
2NO2.
Edasi-tagasi nooleke  reaktsioonivõrrandis tähendab seda, et reaktsioon võib kulgeda mõlemas suunas ehk on pöörduv.
reaktsioonivõrrandis tähendab seda, et reaktsioon võib kulgeda mõlemas suunas ehk on pöörduv.
Praktiliselt lõpuni kulgevad need reaktsioonid, milles tekib sade, gaas, vesi või muu vähedissotsieeruv ühend.
Kui segada kokku võrdsetes moolkogustes NaOH-d ja HCl-i, siis kulgeb aga reaktsioon lõpuni: saadud pole ei happeline (nagu HCl) ega ka aluseline (nagu NaOH). Keeduklaasi on tekkinud NaCl neutraalne lahus ning OH– ja H+ ioonid on moodustanud kokku vähedissotsieeruva ühendi – vee. Selline reaktsioon on pöördumatu ehk kulgeb praktiliselt lõpuni:
NaOH + HCl → NaCl + H2O.
Ka põlemisreaktsioonid kulgevad lõpuni.
Praktiliselt lõpuni kulgevad need reaktsioonid, milles tekib
- sade (näiteks MgOH2 + H2CO3 → MgCO3↓ + 2 H2O),
- gaas (näiteks Na2S + 2 HCl → 2 NaCl + H2S↑),
- vesi või muu vähedissotsieeruv ühend (näiteks Na2O + H2SO4 → Na2SO4 + H2O).
Reaktsiooni energiadiagramm
Nüüd on paras aeg vaadata eelnevalt lubatud reaktsiooni energia selgitusi. Öeldakse, et üks pilt on parem kui tuhat sõna. Võtame näiteks eelmisest alapunktist tuttava pöörduva reaktsiooni:
N2O4  2NO2
2NO2
mille näeb välja selline:
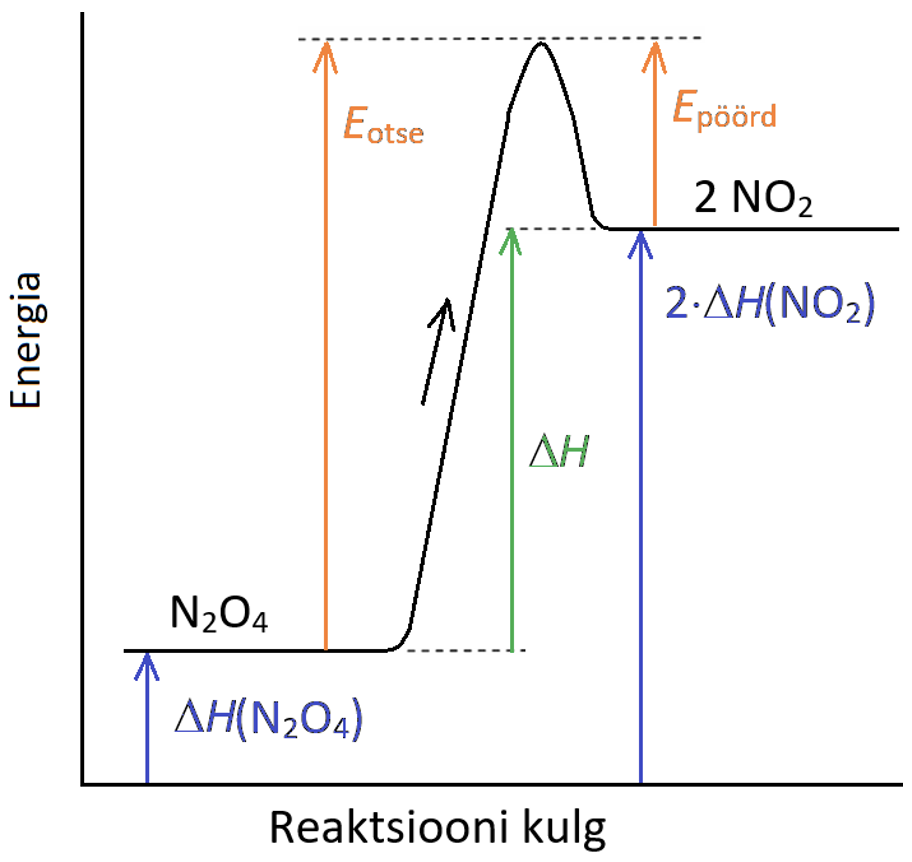
Joonis 1. Energiadiagramm
Graafikul on musta joonega märgitud energiamuutused reaktsiooni käigus puhtast lähteainest (N2O4) kuni puhta saaduseni (NO2). Must nool näitab otsereaktsiooni suunda. Värviliste nooltega on märgitud rida energiaid, mida vaatame kohe lähemalt.
Nagu eespool nägime, peab selleks, et reaktsioon (antud näites ühe N2O4 molekuli lagunemine) toimuks, olema reageerivatel osakestel piisavalt energiat. Otsereaktsioonis on vastav minimaalne vajalik energia Eotse, pöördreaktsioonis 2NO2  N2O4 aga Epöörd. Need energiad ongi otse- ja vastassuunalise reaktsiooni aktivatsioonienergiad, vastavalt Eotse ja Epöörd.
N2O4 aga Epöörd. Need energiad ongi otse- ja vastassuunalise reaktsiooni aktivatsioonienergiad, vastavalt Eotse ja Epöörd.
Skeemil toodud reaktsiooni lähteainete energia on palju väiksem kui saaduste energia (sinised nooled), st saaduste saamiseks tuleb lähteainetele energiat juurde anda. Seda energiat, mida tuleb lisada või mis reaktsioonis vabaneb, nimetatakse reaktsiooni soojusefektiks ΔH.
 Ekso- ja endotermiliste reaktsioonide kohta loe siit.
Ekso- ja endotermiliste reaktsioonide kohta loe siit.
Reaktsiooni soojusefekti ΔH saame, kui lahutame saaduste ΔH väärtusest lähteainete ΔH väärtuse:
ΔH = ΔH (saadused) – ΔH (lähteained)
Kui on positiivne, siis see reaktsioon tarbib soojust – see on . Lagunemisreaktsioonid on enamasti endotermilised reaktsioonid, sest sidemete lõhkumine nõuab energiat. Kui aga reaktsiooni soojusefekt on negatiivne, siis reaktsiooni käigus soojus vabaneb. Selline reaktsioon on eksotermiline reaktsioon.
Kas üle mäe või läbi kuru või vastumäge
Jooniselt on näha, et üle aktivatsioonienergia barjääri võib liikuda mõlemas suunas, aga loomulikult tekib küsimus, miks üle mäe, äkki saaks ka kõrvalt minna. Konkreetse reaktsioonimehhanismi jaoks on aktivatsioonienergia vähim vajalik energia, et osakeste vahel reaktsioon toimuks. See on nagu kuru mäeahelikus: kõrgemalt võib, kui on jaksu, aga madalamat teed ei ole. Iseasi, kui kaevata läbi mäe tunnel, sel juhul saab väiksema energiakuluga teisele poole ahelikku. Aeglastele reaktsioonidele otsitakse kiirendajaid – katalüsaatoreid, mille abil toimuksid reaktsioonid madalama aktivatsioonienergiaga teed mööda. Lisaks katalüsaatoritele võivad reaktsiooni kiirust mõjutada veel ka inhibiitorid – need aeglustavad reaktsiooni, aga nad ei tõsta aktivatsioonienergia barjääri (siis toimuks ju reaktsioon ikka tavateed mööda edasi), vaid seovad reaktsioonivõimelisi osakesi või blokeerivad reaktsioonitsentreid – kindlaid struktuuriosi, kus reaktsiooni elementaarakt toimub. Inhibiitorite kasutamine on levinud biokeemilistesprotsessides nt mitmesguse vähiravi korral.


