
1.4. Soolad
on igapäevaelus väga laialdaselt kasutuses. Näiteks toitu saad maitsetada soolaga, siin mõeldakse peamiselt naatriumkloriidi ehk NaCl. Kooki saad kergitada vesiniksoola naatriumvesinikkarbonaadiga (NaHCO3). NaCl ja kaaliumkloriidi (KCl) lisatakse mineraliseeritud veele Värska.
Soolad on ained, mis koosnevad metalli katioonist ja happejääkioonist ehk happeanioonist. Kuidas soolasid nimetatakse ja milliste reaktsioonide tulemusena soolad saadakse, vaata järgmisest videost.
Allikas: https://youtu.be/TQ-110H2mL8
Nimetamine
Soolade nimetamise üldkuju:
katiooni nimi + (o.a) + happejääkiooni nimi
Soolade nimetamisel vaata, millist katiooni (metalliiooni) sool sisaldab ja milline on katioonile järgnev .
Soolade nimetamise üldkuju: katiooni nimi + (o.a) + happejääkiooni nimi.
Happejääkioonide nimed on toodud hapete teema tabelis.
Soolade nimetamisel vaata eelnevalt, kas metalliiooni on püsiv või muutuv. Sellest tulenevalt on kaks nimetamise reeglit.
1. Kui soola koostises oleval metallilisel elemendil on püsiv oksüdatsiooniaste, antakse nimetus: metalli nimi + happejääkiooni nimi
nt NaCl – naatriumkloriid, AlBr3 – alumiiniumbromiid.
2. Kui soola koostises oleval metallilisel elemendil on muutuv oksüdatsiooniaste, antakse nimetus: metalli nimi + (o.a) + happejääkiooni nimi
nt CuCO3 – vask(II)karbonaat, Fe2(SO4)3 – raud(III)sulfaat.
Valemite koostamine
Soola valemi koostamist vaatame kahe näite põhjal.
1. näide. Kirjuta kaltsiumkloriidi valem.
- Kirjuta kõigepealt teineteise kõrvale metalli ning seejärel happejääkioon, nt Ca2+ Cl–.
- Võrdsusta positiivsed ja negatiivsed laengud, et ühend oleks tervikuna neutraalne. Antud näites tuleb anioone võtta 2 tükki.
- Eelnevat arvesse võttes on kaltsiumkloriidi valem CaCl2.
2. näide. Kirjuta raud(III)sulfaadi valem.
- Kirjuta kõigepealt teineteise kõrvale metalli katioon ning seejärel happejääkioon, nt Fe3+ SO42-.
- Võrdsusta positiivsed ja negatiivsed laengud, et ühend oleks tervikuna neutraalne. Antud näites tuleb katioone võtta 2 ja anioone 3 tükki.
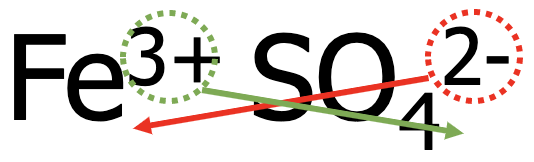
- Eelnevat arvesse võttes on raud(III)sulfaadi valem Fe2(SO4)3.
Soolade liigitamine
koosnevad metalliioonist ja „tavalisest“ happejääkioonist (vt hapete teema tabelit).
koosnevad metalliioonist ja happejääkioonist ning vesinikust. Vesinikku sisaldavaid happejääkioone annavad lahusesse mitmeprotoonsed . Tuntuim vesiniksool on naatriumvesinikkarbonaat (NaHCO3) ehk söögisooda. Vesiniksoolad tekivad aluse ja happe vahelisel reaktsioonil, kui alust ei ole piisavalt happe täielikuks neutraliseerimiseks. Nt süsihappe ja kaaliumhüdroksiidi vahelise reaktsiooni tulemusena võib moodustuda nii kaaliumkarbonaat kui ka kaaliumvesinikkarbonaat.
H2CO3 + KOH → KHCO3 + H2O
kaalimvesinikkarbonaat – vesiniksool
H2CO3 + 2 KOH → K2CO3 + 2 H2O
kaaliumkarbonaat – lihtsool
Nagu näha, kulub ühe osa kaaliumkarbonaadi tekkimiseks 2 osa kaaliumhüdroksiidi, kuid kaaliumvesinikkarbonaadi tekkimiseks kulub vaid üks osa kaaliumhüdroksiidi.
Happed, mis tekitavad vesiniksoolasid ning hapetele vastavad happejääkioonid
|
|
-1 H+ |
-2 H+ |
-3 H+ |
|
H2CO3 |
HCO3– vesinikkarbonaatioon |
CO32- karbonaatioon |
– |
|
H3PO4 |
H2PO4– divesinikfostaatioon |
HPO42- vesinikfostaatioon |
PO43- fosfaatioon |
|
H2SO3 |
HSO3– vesiniksulfitioon |
SO32- sulfitioon |
– |
Soolade saamine
Keemilisi reaktsioone, mille käigus soolad moodustuvad, oleme juba oksiidide, hapete ja aluste osas käsitlenud, aga olgu need siin kokkuvõtlikult uuesti kirjas.
1. HAPE + ALUS → SOOL + H2O
HCl + NaOH → NaCl + H2O
2. HAPE + → SOOL + H2↑
3 H2SO4 + 2 Al → Al2(SO4)3 + 3 H2↑
See reaktsioon ei toimu alati. Lahjendatud hapetega reageerivad vaid need metallid, mis on vesinikust aktiivsemad ehk asuvad metallide elektrokeemilise aktiivsuse reas vesinikust eespool ehk vesinikust vasakul (vt hapete osa).
3. HAPE + ALUSELINE OKSIID → SOOL + H2O
2 HNO3 + CaO → Ca(NO3)2 + H2O
See reaktsioon toimub alati.
4. ALUS + → SOOL + H2O
2 LiOH + CO2 → Li2CO3 + H2O
5. ALUSELINE OKSIID + HAPPELINE OKSIID  SOOL
SOOL
CaO + CO2  CaCO3
CaCO3
Tekib happelisele oksiidile vastava happe sool.
6. Ühest soolast võib saada ka teise soola.
HAPE (või ALUS) + SOOL → UUS SOOL + VÄHE DISSOTSIEERUV, MITTELAHUSTUV või LENDUV ÜHEND
HCl + NaHCO3 → NaCl + H2O + CO2↑
2NH4Cl(t) + Ca(OH)2(t)  CaCl2 + 2NH3↑ + 2H2O ↑
CaCl2 + 2NH3↑ + 2H2O ↑
Nii valmistatakse laboratooriumis vajadusel ammoniaaki.
FeCl3 + 3 NaOH → Fe(OH)3 $\downarrow $+ 3 NaCl
Selliselt saab valmistada vees mittelahustuvaid hüdroksiide.


