
1.2. Happed
Selles peatükis käsitleme ühte väga olulist ühendite klassi, happeid. mängivad meie igapäevaelus väga suurt rolli – nad on puhastusvahendite koostisosad ja kasutuses toitude konserveerimisel. Inimkehas on keerulised süsteemid, mis kontrollivad hoolikalt vere happelisust ja aluselisust (vere pH tasakaalu), sest isegi väikesed kõrvalekalded võivad põhjustada tõsiseid haigusi ja surma. Sama tundlikkus on olemas ka teistes eluvormides. Need, kellel on troopilised kalad või kuldkalad, teavad, kui oluline on jälgida akvaariumi vee happesust.
Ka tööstuslikult on happed väga olulised. Näiteks toodetakse igal aastal väga suures koguses väävelhapet, et toota väetisi, polümeere, terast ja paljusid muid materjale.
Allolevast videost saad teada, kuidas happeid nimetada, kuidas happeid saada ning millised on hapete keemilised omadused.
Allikas: https://youtu.be/aYWA4Od8nhU
Kõige lihtsama käsitluse järgi on happed ained, mis annavad vesilahusesse vesinikioone (H+). Üks tuntuim on vesinikkloriidhape, keemilise valemiga HCl. HCl triviaalnimetusteks on ka maohape ja soolhape. Maohappe roll ongi toidu ja joogi keemiline lagundamine. HCl kasutatakse ka basseinivee puhastamisel ja muudes puhastustoodetes.
Hapetega kokkupuutel peab meeles pidama, et nad on väga söövitava toimega. Juba väike tilk väävelhapet söövitab riidesse suure augu.

Joonis 1. Juba väike tilk väävelhapet söövitab riidesse suure augu.
 Loe lisaks: Arrheniuse hapete-aluste teooria.
Loe lisaks: Arrheniuse hapete-aluste teooria.
Nimetamine ja valemite koostamine
Happed koosnevad vesinikust ja happejääkioonist. Selleks, et hapete valemite kirjutamine läheks ladusamalt, õpi selgeks tabelis 1 toodud happejääkioonid ja nende nimetused.
Tabel 1. Mõningate anorgaaniliste hapete ning vastavate happejääkioonide (happeanioonide) valemid ja nimetused. Jäta meelde nii happe nimetus kui ka sellele vasta .
|
Hape |
Happejääkioon |
||
|
Valem |
Nimetus |
Valem |
Nimetus |
|
HCl |
vesinikkloriidhape (kasutatakse ka nimetust soolhape) |
Cl– |
kloriid |
|
HBr |
vesinikbromiidhape |
Br– |
bromiid |
|
HI |
vesinikjodiidhape |
I– |
jodiid |
|
HF |
vesinikfluoriidhape |
F– |
fluoriid |
|
H2S |
divesiniksulfiidhape |
S2- |
sulfiid |
|
H2SO3 |
väävlishape |
SO32- |
sulfit |
|
H2SO4 |
väävelhape |
SO42- |
sulfaat |
|
HNO3 |
lämmastikhape |
NO3– |
nitraat |
|
HNO2 |
lämmastikushape |
NO2– |
nitrit |
|
H2CO3 |
süsihape |
CO32- |
karbonaat |
|
H3PO4 |
fosforhape |
PO43- |
fosfaat |
|
H2SiO3 |
ränihape |
SiO32- |
silikaat |
Hapete liigitamine
1. Tugevuse järgi
1) Tugevad happed on vesilahuses täielikult ioonideks jagunenud, nt HCl, HBr, HI, HNO3, H2SO4.
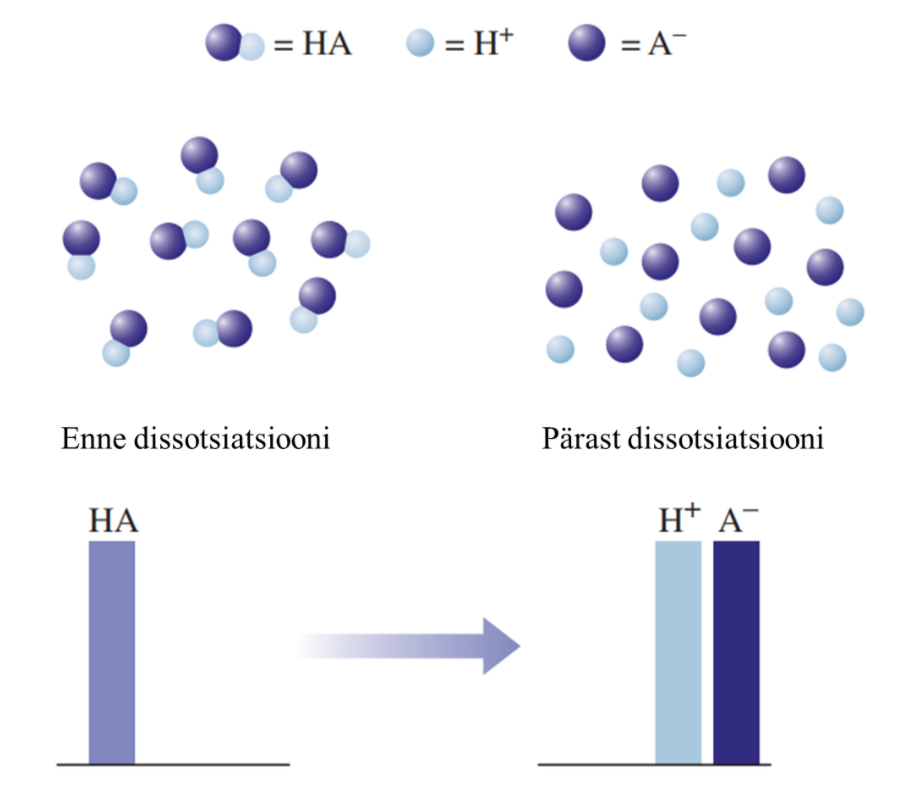
Joonis 2. Graafiline esitus tugeva happe käitumise kohta vees. Kus HA tähistab hapet, H+ vesinikioone, ja A– happejääkioone. Tugeva happe korral on näha, et hape on täielikult jagunenud ioonideks.
2) on vesilahuses vaid osaliselt ioonideks jagunenud (kõik happed, välja arvatud tugevad happed), nt H3PO4, H2SO3, H2S, H2CO3, H2SiO3, HF.
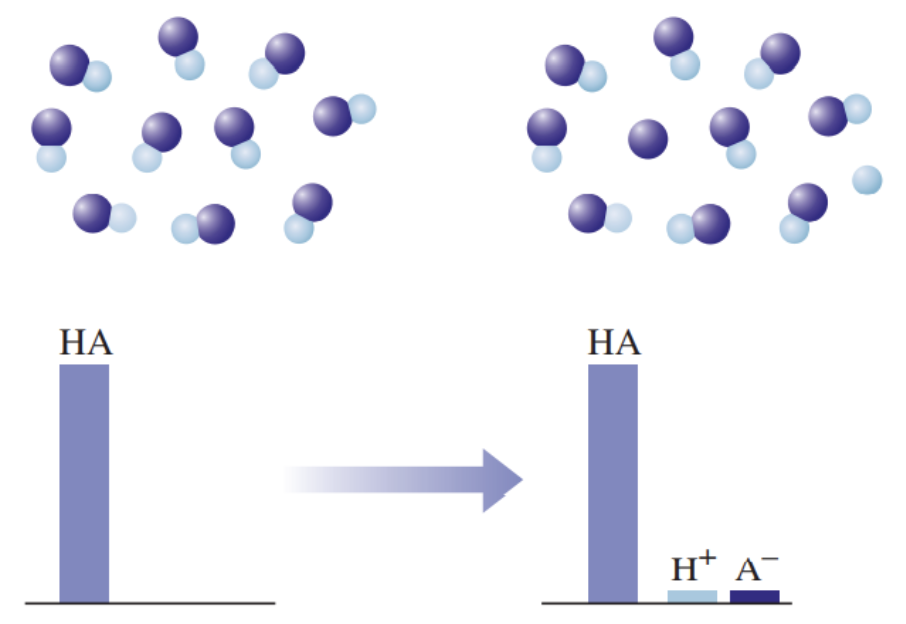
Joonis 3. Graafiline esitus nõrga happe käitumise kohta vees, kus HA tähistab hapet, H+ vesinikioone, ja A– happejääkioone. Ainult väga väike osa happest on jagunenud ioonideks.
Nõrga happe vesilahuses on olemas nii negatiivse laenguga happeanioonid, positiivse laenguga vesinikioonid kui ka happe molekulid, st happe molekulid on vaid osaliselt ioonideks jagunenud. Seevastu tugeva happe vesilahuses happemolekule ei ole, on vaid negatiivse laenguga happeanioonid ja positiivse laenguga vesinikioonid.
2. Prootonite arvu järgi
1) Üheprootonilised happed, mille keemilises valemis on üks vesinikioon, nt HCl, HBr.
2) Mitmeprootonilised happed, mille keemilises valemis on mitu vesinikiooni, nt H2SO4, H3PO4.
3. Hapnikusisalduse järgi
1) Hapnikhapped sisaldavad hapniku aatomeid, nt H2SO4, H2SiO3.
2) Hapnikuta happed ei sisalda hapniku aatomeid, nt H2S, HCl.
Hapete keemilised omadused
HAPE + ALUS → SOOL + H2O
1. Aluse ja happe vaheline reaktsioon on , mille tulemusena tekib sool ja vesi.
HCl + NaOH → NaCl + H2O
H2SO4 + 2LiOH → Li2SO4 + 2H2O
Seda tüüpi reaktsioon kulgeb siis, kui
- mõlemad lähteained lahustuvad vees ja tekib nõrk vesi;
- tahkele või vees mittelahustuvale alusele lisada happelahust;
- tahkele või vees mittelahustuvale happele lisada aluselahust. Nt ränihape + tugev alus NaOH.
Väga nõrga happe ja aluse vaheline reaktsioon ei toimu (nt Cu(OH)2 + H2S).
HAPE + → SOOL + H2↑
2. Happed reageerivad metallidega, tekivad sool ja vesinik.
2 Na + 2 HCl → 2 NaCl + H2↑
2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2↑
Zn + 2 HCl (lahj.) → ZnCl2 + H2 ↑
Mg + 2 HCl (lahj.) → MgCl2 + H2 ↑
Fe + 2 HCl (lahj.) → FeCl2 + H2 ↑
2 Al + 6 HCl (lahj.) → 2 AlCl3 + 3 H2 ↑

Joonis 4. Tsingi, magneesiumi, raua ja alumiiniumi reaktsioon 18%-lise HCl-lahusega
Kõik metallid ei reageeri hapetega ühtmoodi. Metallide võimet hapete lahustest vesinikku välja tõrjuda iseloomustab :

Metallid, mis asuvad vesinikust paremal, ei reageeri lahjendatudhappelahustega.
Cu + lahj HCl → ei toimu
Metallid, mis asuvad metallide pingereas vesinikust vasakul (jooniselmärgitud sinise kastiga), reageerivad lahjendatud hapete vesilahustega.
Erandiks on lämmastikhappe lahused, mis antud skeemi järgi ei reageeri, sest on väga tugevad oksüdeerijad. Konts. HNO3 on tugevam kui H2SO4. Lahjendatud HNO3-s (erinevalt H2SO4-st) on oksüdeerijaks anioonid (NO3– -ioonid), mitte H+-ioonid. Seetõttu ka lahja HNO3-lahuse reageerimisel metallidega ei eraldu vesinikku. Sõltuvalt happe kontsentratsioonist, metalli aktiivsusest ning temperatuurist võivad saadused olla erinevad.
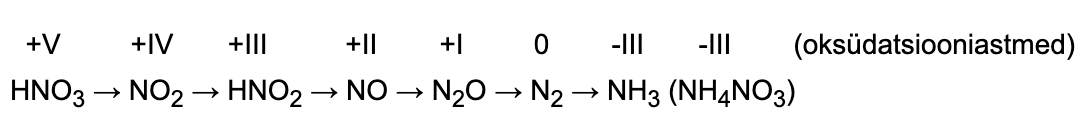
METALL + LÄMMASTIKHAPE → SOOL + VESI + LÄMMASTIKUÜHEND
Vaatleme näitena Zn reageerimist erineva kontsentratsiooniga lämmastikhappe lahusega. Katseandmete põhjal on välja pakutud järgmine jaotus ning võrrandid.
 Loe lisaks:metallide reageerimine lämmastikhappega.
Loe lisaks:metallide reageerimine lämmastikhappega.
Zn + 4 konts HNO3 → Zn(NO3)2 + 2 NO2↑ + 2 H2O
3 Zn + 8 lahj HNO3 → 3 Zn(NO3)2 + 2 NO↑ + 4 H2O
Lämmastikhappe vesilahusega reageerivad ka vähemaktiivsed metallid Cu, Hg, Ag.
HAPE + ALUSELINE OKSIID → SOOL + H2O
3. Happed reageerivad aluseliste oksiididega, tekivad sool ja vesi.
See reaktsioon toimub alati.
2 HCl + BaO → BaCl2 + H2O
2 HNO3 + CaO → Ca(NO3)2 + H2O
CuO + H2SO4 → CuSO4 + H2O


