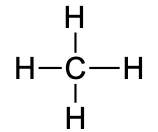
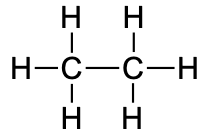
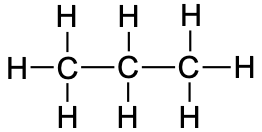
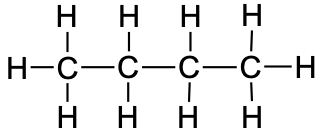
6.4. Alkaanid
on , mille struktuuris esinevad ainult üksiksidemed.
Alkaanid on , mille struktuuris esinevad ainult üksiksidemed (st puuduvad kordsed sidemed). Alkaanid võivad olla nii sirge kui ka hargneva ahelaga. Lisaks võivad alkaanide molekulide ahelad moodustada tsükleid (tsükloalkaane). Alkaane kutsutakse “küllastunud süsivesinikeks” seetõttu, et need ei ole võimelised osalema liitumisreaktsioonides. Alkaanide, nende omaduste, nimetamise ja isomeeridega saad tutvuda järgnevas videos.
Allikas: https://youtu.be/F27sXv0K2Oo
Alkaanide nimetamine
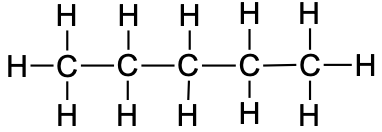
Alkaanide nimetamisel kasutatakse järelliidet -aan. On väga oluline õppida pähe esimese kümne sirge ahelaga alkaani nimetused, sest nendel põhineb suurel määral ka teistesse aineklassidesse kuuluvate orgaaniliste ühendite nimetamine. Sirge ahelaga alkaanide nimetuste õppimise muudab lihtsamaks see, et alates viiesüsinikulistest ahelatest lähtub alkaani nimetus lihtsalt süsinike arvu märkivast tüvest (analoogiliselt eesliidetele oksiidide nimetamisel), mille lõppu on lisatud -aan.
Tabel 1. Sirge ahelaga alkaanide nimetused
|
C arv |
Nimetus |
Tasapinnaline |
Lihtsustatud |
Summaarne valem |
|
1 |
metaan |
|
CH4 |
CH4 |
|
2 |
etaan |
|
CH3CH3 |
C2H6 |
|
3 |
propaan |
|
CH3CH2CH3 |
C3H8 |
|
4 |
butaan |
|
CH3CH2CH2CH3 |
C4H10 |
|
5 |
pentaan |
|
CH3CH2CH2CH2CH3 |
C5H12 |
|
6 |
heksaan |
|
CH3CH2CH2CH2CH2CH3 |
C6H14 |
|
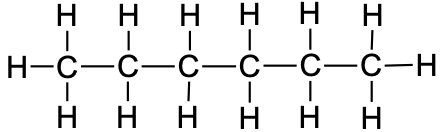
7 |
heptaan |
|
CH3CH2CH2CH2CH2CH2CH3 |
C7H16 |
|
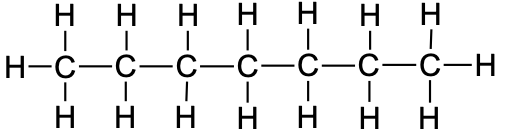
8 |
oktaan |
|
CH3CH2CH2CH2CH2CH2CH2CH3 |
C8H18 |
|
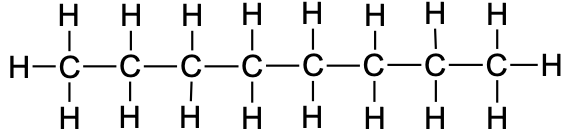
9 |
nonaan |
|
CH3CH2CH2CH2CH2CH2CH2CH2CH3 |
C9H20 |
|
10 |
dekaan |
|
CH3CH2CH2CH2CH2CH2CH2CH2CH2CH3 |
C10H22 |
Hargnenud ahelaga alkaanide nimetamisel tuleb molekuli kõige pikemale süsinikahelale vastava alkaani nimetus võtta tüviühendi nimetuseks, mille ette kirjutatakse asendusrühmade (põhiahelast hargnevate külgahelate) asukohta põhiahela suhtes märkivad numbrid ja rühmade nimetused. Põhiahela süsinikuaatomid peab nummerdama nii, et rühmade asendeid kirjeldavad numbrid tuleksid võimalikult väikesed.
Rühma nimetus on sarnane vastava alkaani nimetusele, ainult -aan liite asemel on -üül: metüül, etüül, propüül jne.
Asukoha nr + (vajadusel eesliide) + rühma nimetus + tüviühendi nimetus.
Kui ühesuguseid rühmi on mitu, siis kasutatakse nende arvu märkimiseks kreeka keelest pärit eesliidet.
- Mono – üks
- Di – kaks
- Tri – kolm
- Tetra – neli
- Penta – viis
- Heksa – kuus
- Hepta – seitse
- Okta – kaheksa
- Nona – üheksa
- Deka – kümme
Praktikas jäetakse eesliide “mono” enamasti ära.
Kui erinevat tüüpi asendusrühmi on mitu, siis märgitakse need tähestiku järjekorras (koos vastavate asukohanumbrite ja eesliidetega) tüviühendi ette. Seetõttu märgitakse alkaani nimetuses näiteks etüülrühm enne metüülrühma.
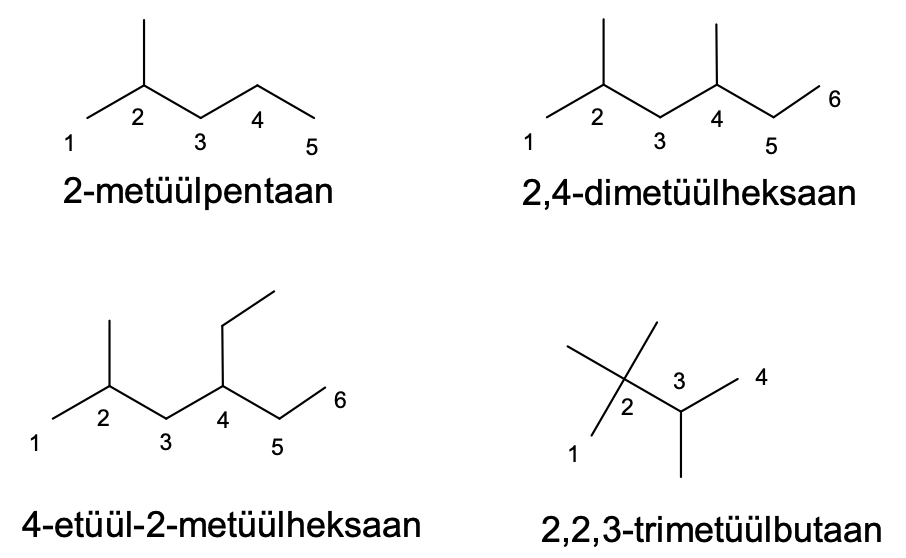
Joonis 1. Näiteid hargnenud alkaanide nimetamisest
Alkaanide füüsikalised omadused
Alkaanide füüsikalised omadused sõltuvad molekulide suurusest.
Kõigi ainete, ka alkaanide puhul kasvavad molekuli suuruse kasvuga ka molekulidevahelised jõud, mistõttu tõuseb ainete keemistemperatuur. Ühe- kuni neljasüsinikulised alkaanid on toatemperatuuril gaasid. Kui süsinikuaatomite arv alkaanis on 5–18, on nad enamasti vedelikud, suurema molekuliga alkaanid on tahked ained. Alkaanide sulamis- ja keemistemperatuurid sõltuvad ka nende ahelate kujust. Sirge ahelaga alkaanide sulamis- ja keemistemperatuurid on üldreeglina kõrgemad kui sama C- ja H-aatomite arvuga hargnenud alkaanidel. Mida hargnenum on alkaani struktuur, seda madalam on üldiselt tema sulamis- ja keemistemperatuur. Sirge ahelaga alkaanid paigutuvad paremini üksteise kõrvale ja omavad suuremat efektiivset kokkupuutepinda kui hargnenud ahelaga alkaanid. Seetõttu mõjuvad sirge ahelaga alkaanimolekulide vahel ka tugevamad molekulidevahelised jõud.
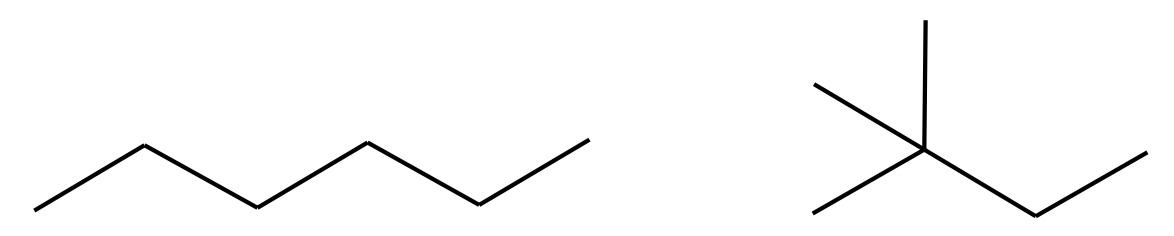
Joonis 2. Heksaani (vasakul) keemistemperatuur on 69 °C, 2,2-dimetüülbutaani (paremal) keemistemperatuur on aga 50 °C. Kuigi nende ühendite molekulivalem on sama, on 2,2-dimetüülbutaani molekulid kerakujulisemad ja neid ei saa nii efektiivselt üksteise kõrvale paigutada kui sirge ahelaga molekule, mistõttu on molekulidevahelised jõud nõrgemad
Alkaanid on mittepolaarsed ja hüdrofoobsed ühendid, mis ei anna vesiniksidemeid.
Alkaanid on mittepolaarsed ühendid, sest sisaldavad ainult praktiliselt mittepolaarseid C–H sidemeid ega saa moodustada vesiniksidemeid. Seetõttu lahustuvad alkaanid polaarsetes lahustites halvasti ja on vees praktiliselt mittelahustuvad. Alkaanid on hüdrofoobsed ehk vett-tõrjuvad ained. Vedelad ja tahked alkaanid on veest kergemad (väiksema tihedusega) ained.
Alkaanide keemilised omadused
Alkaanid on väga inertsed ning tavatingimustes ei reageeri praktiliselt millegagi. Kõrgemal temperatuuril alkaanid süttivad ning reageerivad hapnikuga ehk põlevad. Alkaanide on üks tähtsamaid reaktsioone, mille saadusteks on vesi ja süsihappegaas (täieliku põlemise korral ehk piisaval hapniku ligipääsul). Alkaanide põlemise käigus vabaneb palju ka energiat ning seetõttu kasutatakse alkaane kütusena. Näiteks propaan põleb järgneva võrrandi kohaselt:
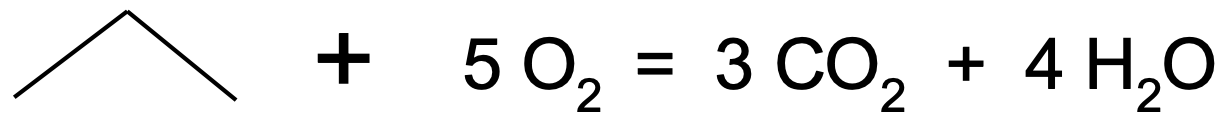
Joonis 3. Propaani põlemine
Mugavam on sama reaktsiooni väljendada propaani molekulivalemit kasutades:
C3H8 + 5O2 → 3CO2 + 4H2O
Alkaanidele on iseloomulikud halogeenidega. Asendusreaktsioon on reaktsioon, mille käigus molekulis asendatakse mingi (või aatomite rühm) teise aatomi (või aatomite rühmaga). Need reaktsioonid on tööstuses väga olulised, sest võimaldavad saada alkaanidest reaktsioonivõimelisemaid ühendeid.
Alkaanidele on iseloomulikud asendusreaktsioonid.
Asendusreaktsioon halogeeniga vajab esmalt halogeenimolekulide lagundamist aatomiteks, mis on radikaalid – paardumata elektroniga osakesed. Reaktsiooni saadusteks on halogenoalkaan, kus üks või mitu vesinikku alkaanis on asendunud halogeeniaatomiga, ning vesinikhalogeniid. Mida hargnenum on süsinikahel C–H sideme juures, seda kiiremini sideme H-aatom halogeenimisreaktsioonis asendub. Samas pole need reaktsioonid väga selektiivsed ja seetõttu tekib sageli erinevate halogeeniühendite segu.
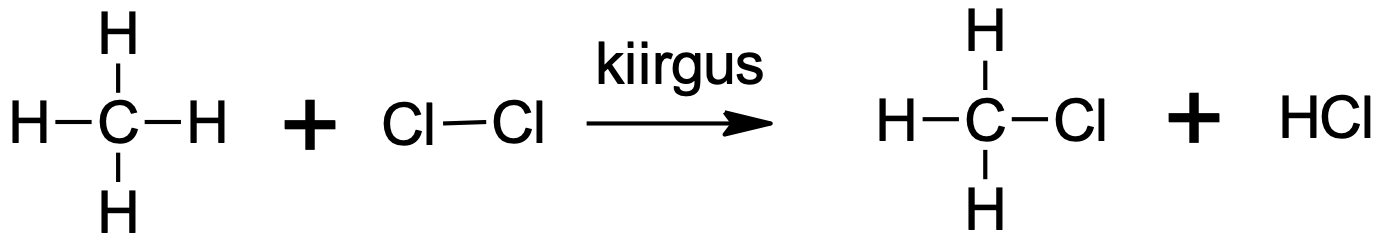
Joonis 4. Metaani kloorimine on lihtne näide alkaani halogeenimisest. Esimeses etapis tekib klorometaan
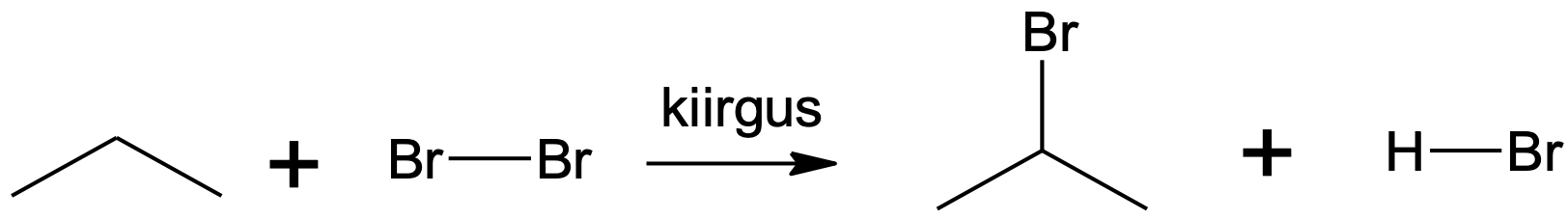
Joonis 5. Propaani broomimine
 Loe lisaks: Radikaalreaktsioonid.
Loe lisaks: Radikaalreaktsioonid.
Alkaanide kasutamine
Kergemad (lühema ahelaga) gaasilised alkaanid leiavad kasutust kütusena kodudes, liikluses ning tööstuses. Metaani (CH4) tuntakse ka maagaasi nime all. Tavaline balloonigaas on propaani ja butaani segu (kolme- ja neljasüsinikulised alkaanid), mis rõhu all on vedelik, kuid rõhu alanedes aurustub kergesti. Erinevatest vedelatest alkaanidest koosnevad naftast saadud vedelkütused nagu bensiin ja diislikütus, aga ka mõned lahustid. Siiski on oluline meeles pidada, et bensiini ja diislikütuse koostises võib olla lisaks alkaanidele ka teiste aineklasside esindajaid. Pikkade ahelatega alkaane, mis on tahked, kohtame näiteks parafiini koostises. Parafiini levinuim kasutusala on olnud küünalde valmistamine. Veelgi pikemate süsinikuahelatega alkaane leidub polümeerides, kus ahelates võib olla isegi enam kui sada tuhat süsinikuaatomit. Alkaanide hulka kuuluvatest polümeeridest kõige levinumad on polüetüleen (polüeteen) ja polüpropüleen (polüpropeen), millest valmib suur osa igapäevases kasutuses olevatest kiledest ja plastikust