4.1. Aatomi ehitus ja elementide omadused
Milleks peaksime teadma aatomi ehitust?
Ained koosnevad erinevatest aatomitest, molekulidest või ioonidest. Aatomiehitus ja aatomitevahelised sidemed määravad aine omadused. Järgnevast videost saadki tuletada meelde aatomiehituse põhiteadmised ja aatomiehituse seosed perioodilisustabeliga.
Allikas: https://youtu.be/DTwdlVdi1pM
Tänapäevase aatomimudeli ehk kvantmehaanilise mudeli lõid austria teadlane E. Schrödinger ja saksa teadlane W. Heisenberg. Selle teooria kohaselt liiguvad elektronid kindlas ruumiosas, moodustades tuuma ümber elektronpilve. Jooniselt 1 näed heeliumi aatomit: kõige tumedamad alad tähistavad piirkonda, kus elektroni leidumise tõenäolisus on kõige suurem.
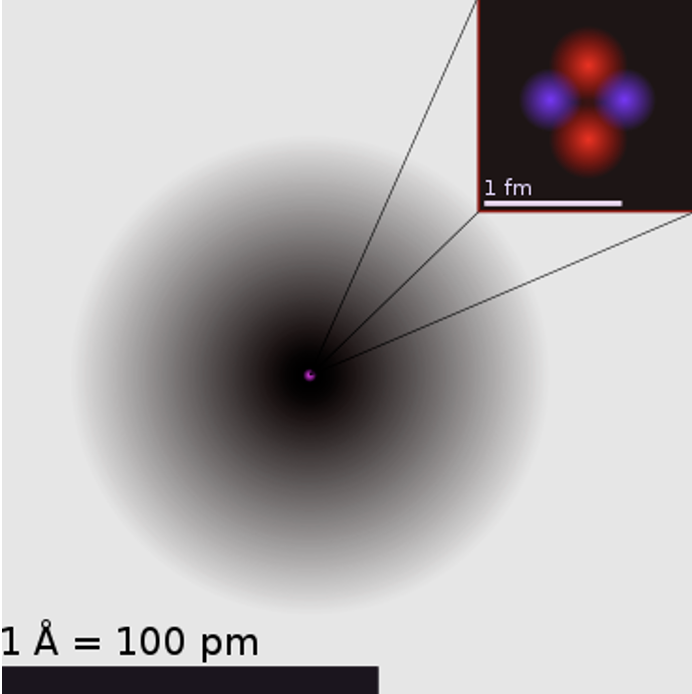
Joonis 1. Heeliumi aatomi kvantmehaaniline kujutus, välja on suurendatud heeliumi tuum, kus on näha kahte neutronit ja kahte prootonit. Allikas: https://upload.wikimedia.org/wikipedia/commons/9/97/Helium_atom.png
Ruumiosa aatomis, kus elektroni leidumise tõenäosus on suur, on orbitaal. Joonisel 2 on toodud orbitaalide erinevad kujud ja nimed.
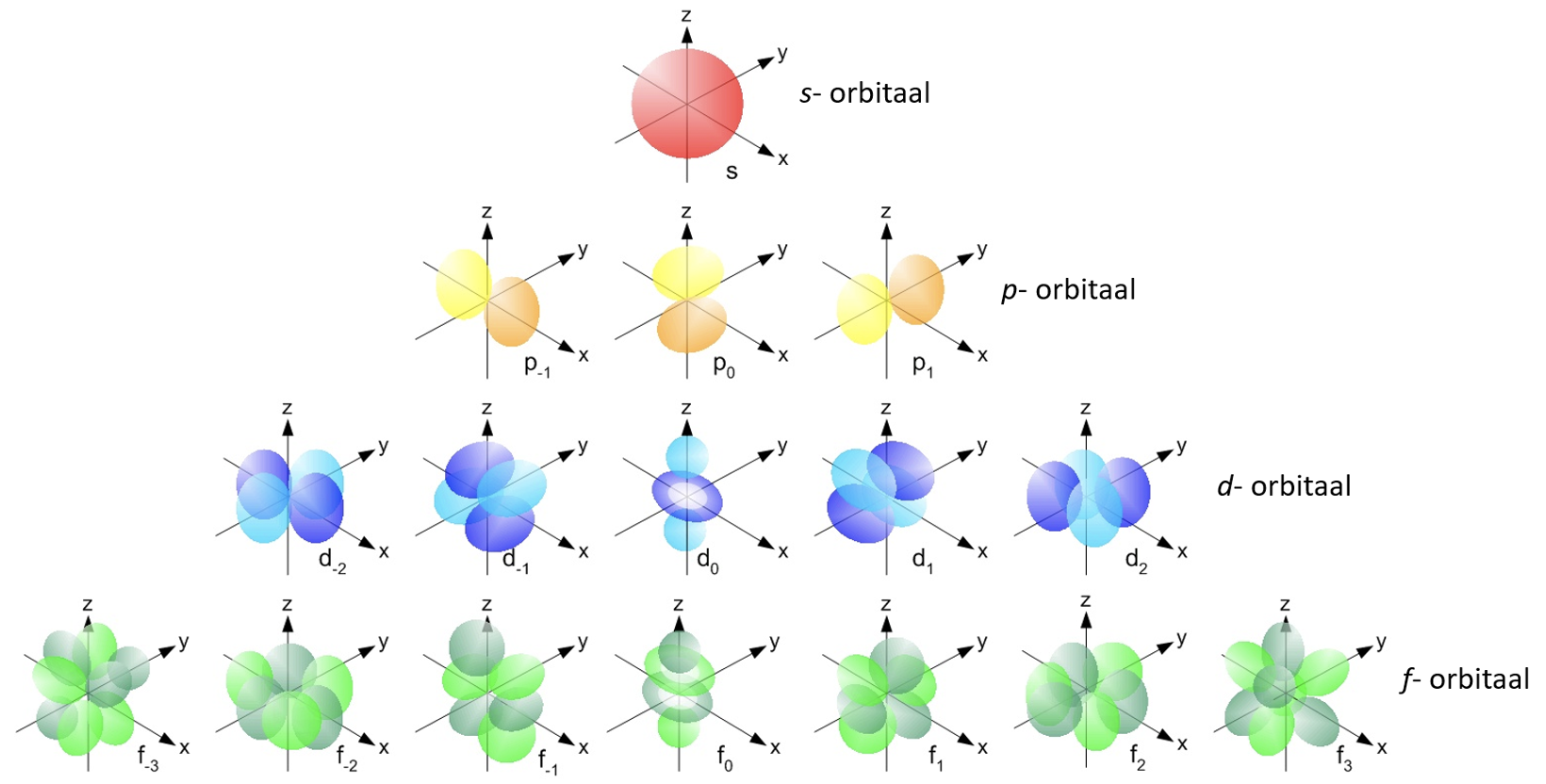
Joonis 2. Erinevate orbitaalide nimed ja kujud. Allikas: https://energywavetheory.com/atoms/orbital-shapes/
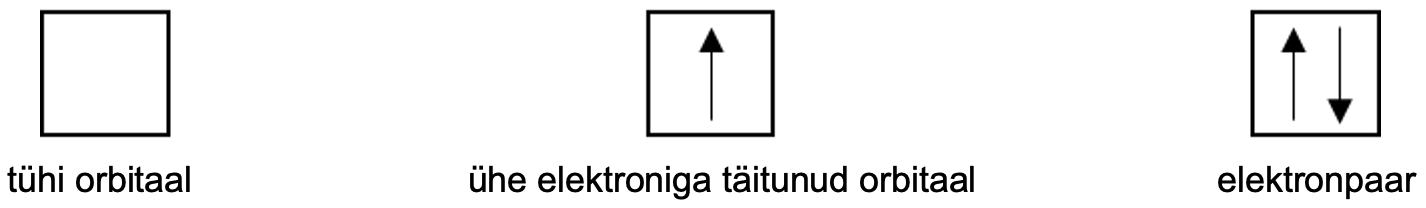
Orbitaalid paiknevad kindlatel energiatasemetel. Aatomi energiatasemete arvu näitab perioodi number. Ühele orbitaalile saab paigutada maksimaalselt kaks elektroni, mis peavad olema vastasspinnidega. Spinn iseloomustab elektroni pöörlemist oma telje ümber ning tal võivad olla vastavalt pöörlemissuunale ainult kaks väärtust. Kui orbitaal on täitunud kahe elektroniga, siis moodustab see elektronpaari. Orbitaale ja nende täitumist märgitakse ruutskeemi abil, kus kastike tähistab orbitaali ja nool üles ning nool alla tähistab vastassuunalise spinniga elektrone.
Esimesel energiatasemel on sfääriline 1s-orbitaal (1 tähistabki esimest energiataset). Teises kihis on juba kaks alakihti: 2s ja 2p (orbitaalide kujusid esimesel kahel energiatasemel saad vaadata videost 1). p–orbitaale on kokku kolm, mis asetsevad ruumis eri suundades (vaata joonist 2) ning p-orbitaalid saavad täituda kokku maksimaalselt 6 elektroniga.
Video 1. Erinevate orbitaalide kujud kahel esimesel energiatasemel. Allikas: https://www.youtube.com/watch?v=VfBcfYR1VQo
Vaatame, kuidas orbitaalid täituvad elektronidega. Teises perioodis on süsiniku järjenumbriga 6, mis näitab tuumalaengut ja ka elektronide koguarvu aatomis. 1s-orbitaalil on 2 elektroni, seejärel 2s-orbitaalil 2 elektroni ja kolmel 2p-orbitaalil ka 2 elektroni. Iga kast skeemil tähistab ühte orbitaali ning täitub maksimaalselt kahe elektroniga. 2p orbitaalid täituvad ühtlaselt samapidi spinnidega elektronidega. Süsiniku aatomi korral jääb üks p– orbitaal tühjaks. Viimase kihi elektronid (süsiniku korral 2s ja 2p orbitaalil asetsevad elektronid) saavad osaleda keemiliste sidemete moodustamises. Näed, et süsiniku aatom saab liita maksimaalselt neli elektroni. Samas võib süsinik keemilise sideme moodustamisel ka kõik viimase kihi elektronid loovutada. Joonisel 3 on toodud elektronide täitumise järjekord süsiniku aatomis. Pane tähele, et joonisel on orbitaalid kindlal energiatasemel, esimese kihi orbitaal on madalama energiaga ning teise kihi orbitaal on juba mõnevõrra suurema energiaga.

Joonis 3. Süsiniku aatomi ruutskeem ja orbitaalide täitumine elektronidega
Kolmandas elektronkihis on juba kolm alakihti ja kolme erinevat tüüpi orbitaale: s, p ja d. d–alakihis on viis orbitaali, järelikult mahutab d-alakiht kokku 10 elektroni.
Niisiis, esimese kolme elektronkihi vahel jaotuvad elektronid järgnevalt:
- elektronkihis saab olla kuni 2 elektroni, mis asetsevad 1s-orbitaalil;
- elektronkihis saab olla kuni 8 elektroni, 2 elektroni 2s- ja 6 elektroni 2p-orbitaalidel;
- elektronkihis saab olla kuni 18 elektroni, 2 elektroni 3s-orbitaalil, 6 elektroni 3p- ja 10 elektroni 3d-orbitaalidel.
Elektronide paiknemist aatomi elektronkihtidel saab lihtsustatult väljendada elektronskeemi, täpsemalt aga elektronvalemi abil. Näiteks süsiniku korral on ja järgmised:
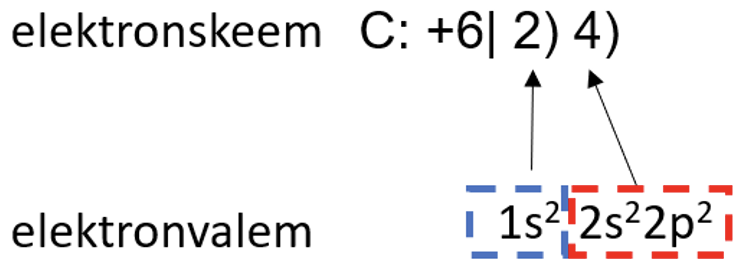
Elektronskeem näitab kõigepealt summaarset elektronide arvu ja seejärel elektronide jaotust elektronkihtides. Elektronvalemis näitavad suured numbrid elektronkihi numbrit, tähed tähistavad alamkihtide liike ning numbrid astendajates näitavad elektronide arvu alamkihtidel.
Elektronvalemi koostamisel on abiks joonisel 4 toodud skeem, mis näitab orbitaalide täitumise järjekorda.
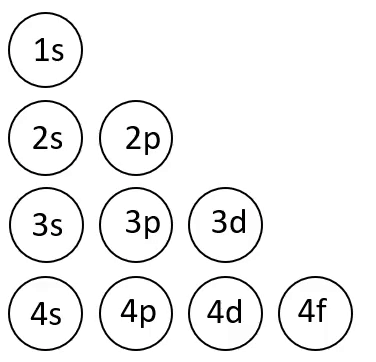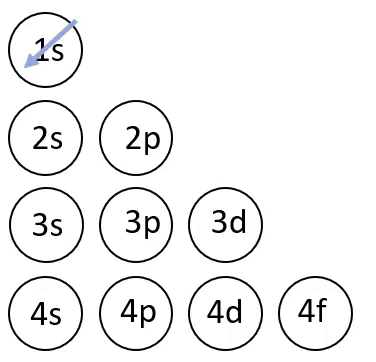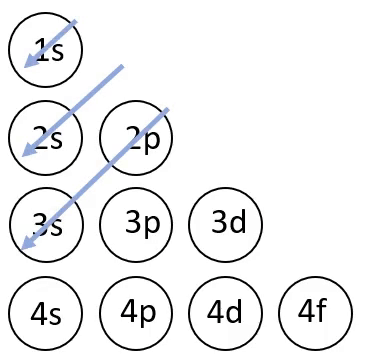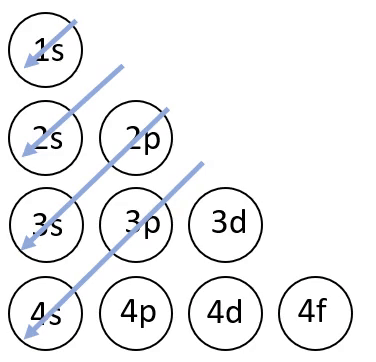
Joonis 4. Orbitaalide täitumise järjekord
Keemiliste elementide omadused
Perioodilisustabelis on elemendid reastatud tuumalaengu kasvu järjekorras. Elemendid asetsevad nii, et need peegeldavad ka aatomiehituse ning omaduste muutust perioodis ja rühmas. Teades elemendi asukohta perioodilisuse süsteemis, saame teha järeldusi tema omaduste kohta.
 Liht- ja liitainete, metalliliste ja mittemetalliliste elementide kohta vaata siit.
Liht- ja liitainete, metalliliste ja mittemetalliliste elementide kohta vaata siit.
Aatomraadius
Elektronkihtide arv suureneb rühmades ülalt alla ja seetõttu ka aatomraadius suureneb. Perioodis vasakult paremale aatomraadius väheneb, sest suureneb ja tuuma mõju elektronkihitidele on suurem. Perioodilisuse süsteemis aatomraadius kasvab diagonaalselt ülevalt paremalt alla vasakule (joonis 5).
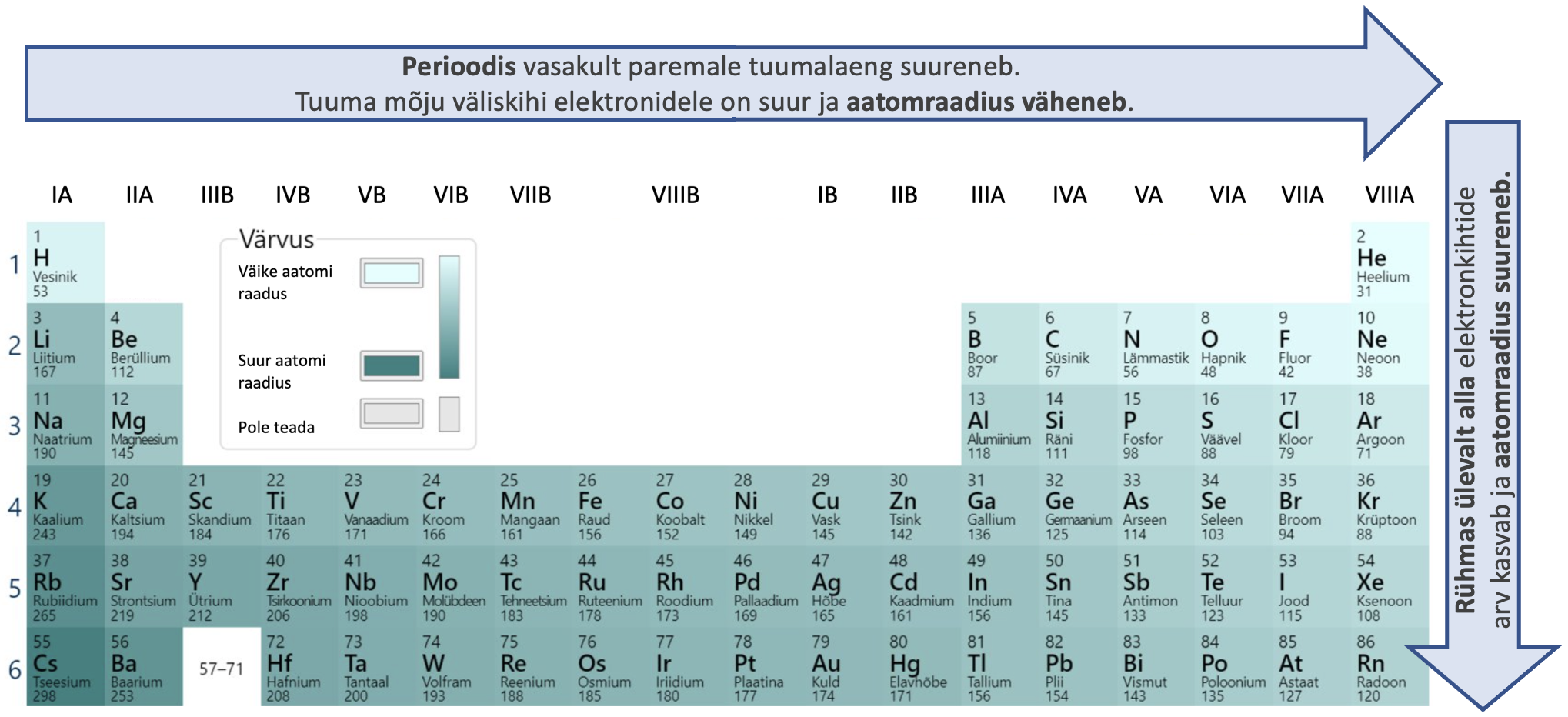 Joonis 5. Aatomraadiuse muutus perioodilisuse süsteemis
Joonis 5. Aatomraadiuse muutus perioodilisuse süsteemis
Metalliliste elementide omadused
Rühmas ülevalt alla metallilised omadused tugevnevad.
Metallilistel elementidel on väliskihtidel suhteliselt vähe elektrone. Aatomi tuum ei hoia elektrone eriti tugevalt kinni ja seetõttu loovutavad kergesti elektrone. Rühmas ülevalt alla elektronkihtide arv suureneb ja seetõttu tuuma mõju viimasele elektronkihile väheneb ning loovutab kergemini elektrone. Element on seda metallilisem, mida lihtsamalt see loovutab elektrone. Seetõttu rühmas ülevalt alla metallilised omadused tugevnevad. Tüüpilisteks näideteks on I A ja II A rühma metallid. I A rühma metallidel on viimasel s-orbitaalil ainult üks elektron, see loovutatakse kergesti ja tekib palju stabiilsem metallikatioon võrreldes metalliaatomiga.
Na – e– → Na+
A-rühma elementide maksimaalne oküdatsiooniaste ühendis on võrdne rühma numbriga.
Elektronide loovutamisel käitub metalli aatom redutseerijana ja metalli kasvab. Kui on loovutatud kõik väliskihi elektronid, siis on elemendil maksimaalne oksüdatsiooniaste. I A ja II A rühma metallid loovutavad kõik oma väliskihi elektronid. Seetõttu näitab I A ja II A rühma metallide rühmanumber nende maksimaalset oksüdatsiooniastet.
I A rühma metallidel on ühendites oksüdatsiooniaste alati I, näiteks NaOH, LiCl, KBr ühendites:
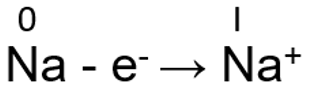
II A rühma elementide maksimaalne oksüdatsiooniaste on alati II, Mg(OH)2, BaCl2, CaO:
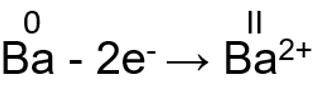 .
.
Teades elemendi oksüdatsiooniastet ühendis, saad kirjutada vastavaid oksiidide, hüdroksiidide ja soolade valemeid.
Mittemetalliliste elementide omadused
 Erinevaid trende perioodilisuse tabelis, elementide omadusi ning tüüpilisi valemeid saad vaadata väga põnevas animeeritud perioodilisuse tabelis.
Erinevaid trende perioodilisuse tabelis, elementide omadusi ning tüüpilisi valemeid saad vaadata väga põnevas animeeritud perioodilisuse tabelis.
Mittemetallilised elemendid paiknevad perioodilisuse tabelis paremal. Nende elementide aatomituuma mõju väliskihi elektronidele on tugev, mis tingib suhteliselt väikse aatomraadiuse. Kõige mittemetallilisem element on VII A rühma element fluor (F). Mittemetalli aatomid pigem liidavad elektrone, et täita osaliselt täitunud väline elektronkiht. Elektronide liitmisel käitub oksüdeerijana ja sellest tekib mittemetalli . Elektronide liitmisel oksüdatsiooniaste kahaneb:
Cl + e– → Cl–
S + 2e– → S2-.
Enamik mittemetallide aatomeid saavad ka elektrone loovutada, st käituvad ka redutseerijana.
Mittemetallide minimaalne oksüdatsiooniaste on
– (8 – rühma number).
Mittemetallide minimaalne oksüdatsiooniaste on võrdne väliskihi orbitaalide tühjade kohtade arvuga. Kokku mahub väliskihile 8 elektroni. Elemendi rühmanumber näitab elektronide arvu väliskihil, seega puuduolevate elektronide arvu saame leida 8 – elemendi rühmanumber. Seega on mittemetallide minimaalne oksüdatsiooniaste – (8 – rühma number). Minimaalne oksüdatsiooniaste on näiteks ühendites metallidega.