
6.6. Küllastumata ühendid: alkeenid ja alküünid
ja on . Küllastumata ühendid sisaldavad kordseid sidemeid: alkeenide aineklassi korral leidub ühendis süsinikuaatomite vahel ning alküünide aineklassi korral .
Alkeenid ja alküünid on , mis sisaldavad kordseid sidemeid.
Mõiste “küllastumata ühendid” viitab sellele, et need ühendid saavad anda liitumisreaktsioone, samas kui saavad anda ainult asendusreaktsioone. Küllastumata ühenditega saad lähemalt tutvuda järgmises videos.
Allikas: https://youtu.be/4x0B9y-Eux4
Küllastumata süsivesinike nimetamine
Küllastumata süsivesinike nimetamine on sarnane alkaanide nimetamisega. Alkaani järelliite –aan asemel tuleb alkeenide korral kasutada järelliidet –een ning alküünide korral järelliidet –üün. Lisaks tuleb numbriliselt ka ära näidata, mitmenda süsiniku aatomi juures peaahelas vastav kordne side asetseb.
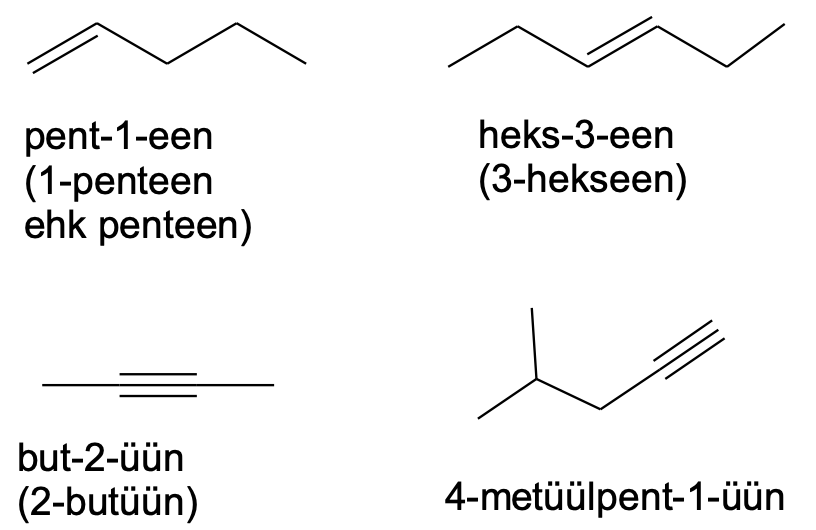
Kui samasuguseid kordseid sidemeid on ühendis mitu, siis tuleb kasutada vastavat eesliidet (di-, tri-, tetra-) jne. Sama pikkade ahelate korral tuleks peaahelaks valida see, mille sisse jäävad ka kordsed sidemed. Muul juhul tuleks valida pikim süsinikahel.
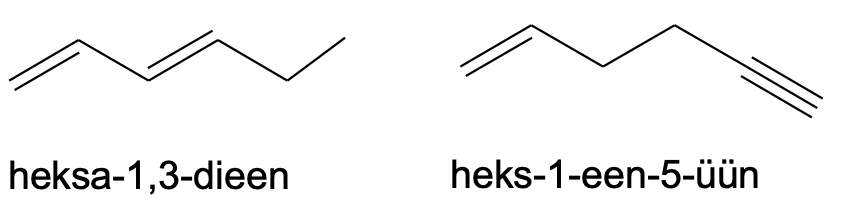
Pane tähele, et kuna näiteks „heksdieeni“ oleks ebamugav välja hääldada, nimetatakse selle asemel ühendit „heksadieeniks“.
Cis-trans isomeeria
C–C üksiksidemega seotud aatomite rühmi saab hõlpsasti teineteise suhtes pöörata (selles on lihtne veenduda näiteks molekulimudelite komplekti abil). Toatemperatuuril piisab soojusenergiast, et aatomite rühmad üksiksidemete ümber pöörleksid, seetõttu kujutavad nt järgnevad butaani kirjutuskujud sama molekuli eri võimalikke “asendeid”:
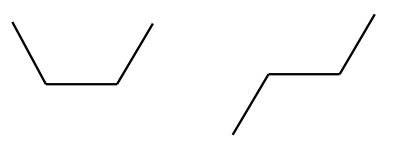
Reaalses butaanis leidub molekule, mis on igasugustes võimalikes asendites. Kuna pöörlemine ümber üksiksideme toimub väga kiiresti, siis tavatingimustes neid eri asendites molekule eraldada ei saa.
Kaksiksidemega seotud aatomite rühmi pöörata ei saa.
Kaksiksidemega seotud aatomite rühmi pöörata ei saa, sest selleks oleks vaja kaksikside ära lõhkuda (ka selles saab veenduda molekulimudelite komplekti abil). Seetõttu on kaksiksideme ümber paiknevad rühmad fikseeritud ja alkeenide korral esineb isomeeria liik, mida kutsutakse cis–trans isomeeriaks. Kui süsinikku sisaldavad rühmad on samal pool kaksiksidet, siis kutsutakse isomeeri cis-vormiks, ja kui vastavad rühmad on kaksiksideme eri pooltel, siis kutsutakse isomeeri trans-vormiks. Näteks but-2-eeni cis– ja trans- on järgmised:

Alkeenide ja alküünide keemilised omadused
Alkeenidele ja alküünidele on iseloomulikud .
Alkeenid ja alküünid on reaktsioonivõimelisemad kui . Alkeenidele ja alküünidele on iseloomulikud liitumisreaktsioonid halogeeni (Hal2), vesinikhalogeniidi (H–Hal), vee (H2O) ja vesinikuga (H2). Kõigis nendes reaktsioonides liitub vastav aine alkeeni või alküüni kordsele süsinik-süsiniksidemele ning selle tulemusel sideme kordsus väheneb (kaksiksidemest saab ja kolmiksidemest kaksikside).
Alkeeni halogeenimisel tekib ainult dihalogenoühend. Vesinikhalogeniidi ei eraldu.
Alkeeni toimub oluliselt kergemini kui alkaani halogeenimine (alkaani halogeenimiseks on reeglina vajalik kõrge temperatuur või UV-kiirgus). Näiteks liitub broom alkeeniga kergesti juba toatemperatuuril ja pimedas, mistõttu broomivesi kaotab alkeenile lisades oma iseloomuliku punakaspruuni värvuse. Alkaaniga broom aga toatemperatuuril ja valgustamata ei reageeri, mistõttu saab broomivee abil eristada alkaani ja alkeeni. Pane tähele, et kuna alkeeni halogeenimine on liitumisreaktsioon, siis alkeeni halogeenimisel ei eraldu vesinikhalogeniidi (erinevalt alkaani halogeenimisest, mis on asendusreaktsioon). Alkeeni halogeenimisel lisandub mõlema C=C süsiniku aatomi juurde halogeeni ja C=C (kaksik)side asendub selle käigus C–C (üksik)sidemega.
CH3–CH=CH–CH3 + Cl–Cl → CH3–CHCl–CHCl–CH3
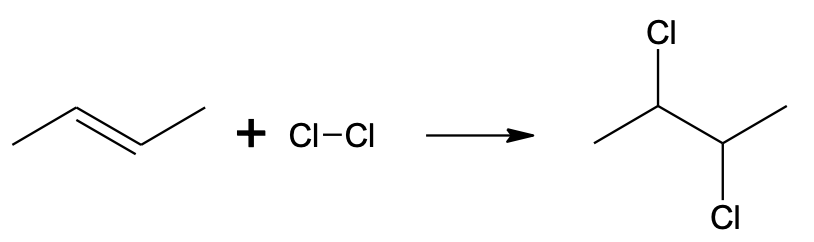
Kloori liitumine but-2-eenile
Kui viia kokku alkeen ja vesinikhalogeniidi , liitub vesinikhalogeniid kergesti alkeeniga. Selle reaktsiooni käigus lisandub halogeeni aatom ühe C=C aatomi juurde, vesiniku aatom teise C=C aatomi juurde ja süsinikevaheline kaksikside asendub üksiksidemega.
CH3–CH=CH–CH3 + H–Br → CH3–CHBr–CH2–CH3
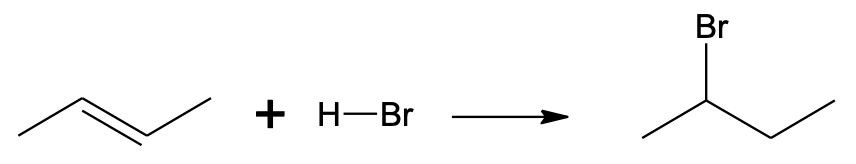
Vesinikhalogeniidi liitumine but-2-eenile
Alkeeni hüdraatimisel (vee liitumisel alkeenile) tekib alkohol.
Alkeeni toimub katalüsaatori abil, milleks sobib (nt H2SO4). Selles reaktsioonis liitub ühe C=C aatomi juurde veest pärinev –OH, teise juurde veest pärinev –H aatom.
CH3–CH=CH–CH3 + H2O $\xrightarrow[]{hape}$ CH3–CHOH–CH2–CH3
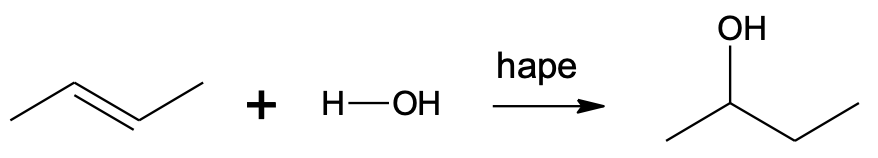
Vee liitumine but-2-eenile
Alkeeni hüdrogeenimisel tekib alkaan.
Alkeeni vajab samuti katalüsaatorit (teatud , nt Ni, Pd või Pt). Reaktsiooni toimumiseks võib olla vajalik ka kõrgendatud rõhk või temperatuur. Hüdrogeenimisel kaovad süsinikevahelised kordsed sidemed ja moodustub vastav küllastunud süsivesinik (alkaan).
CH3–CH=CH–CH3 + H2 $\xrightarrow[]{Pt}$ CH3–CH2–CH2–CH3

Vesiniku liitumine but-2-eenile
Liitumisreaktsioon kolmiksidemele toimub mitmes etapis. Esimeses etapis tekib kaksikside. Teises etapis toimub liitumine kaksiksidemele ning tulemuseks on C–C üksiksidemega saadus.
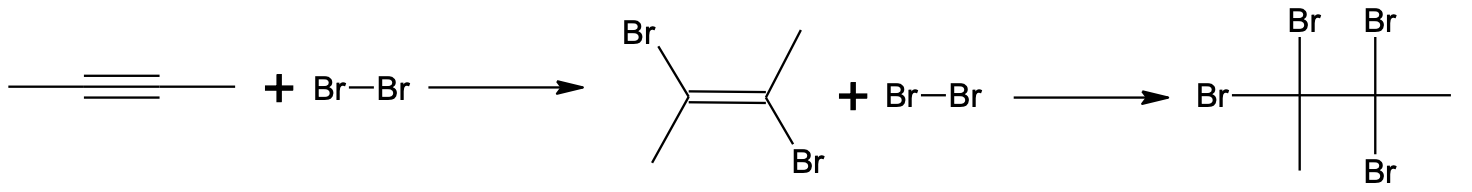
Broomi liitumine but-2-üünile
Vee või vesinikhalogeniidi liitumisel kaksiksidemele kehtib Markovnikovi reegel, mis väidab, et vesinikuaatom liitub süsinikuaatomiga, millega on seotud rohkem vesinikuaatomeid, ja –OH või halogeeni aatom liitub süsinikuaatomiga, millega on seotud vähem vesinikuaatomeid.
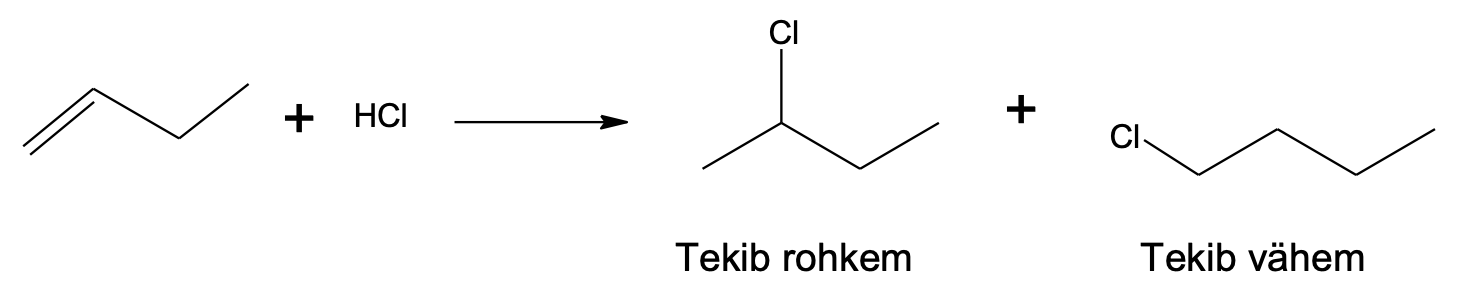
 Loe lisaks: Miks kehtib Markovnikovi reegel?
Loe lisaks: Miks kehtib Markovnikovi reegel?


