
6.1. Sissejuhatus orgaanilisse keemiasse
Orgaanilise aine omadused määrab molekuli struktuur: millised aatomid molekulis paiknevad ja kuidas on need aatomid omavahel ühendatud. Orgaanilise keemiaga tegelemisel tuleb osata struktuurivalemeid kirjutada ja lugeda. Selleks tuleb tunda sidemete arve, mis on elementidele iseloomulikud.
Järgnev video võtab kokku orgaanilise keemia põhialused (valemite kirjutamise ja oksüdatsiooniastmete määramise).
Allikas: https://youtu.be/i5jxnz9sL-U
 Loe lisaks: Anorgaanilised ja orgaanilised süsinikuühendid.
Loe lisaks: Anorgaanilised ja orgaanilised süsinikuühendid.
Sidemete arvud süsinikuühendites
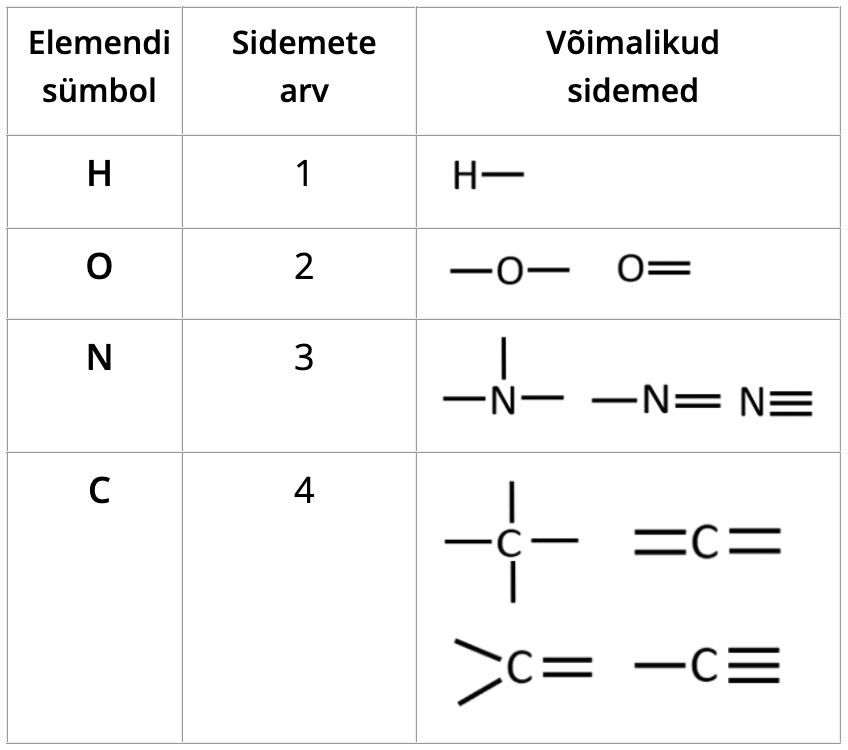
Süsinik moodustab orgaanilistes ühendites 4 sidet.
Orgaanilistes ainetes ühendavad aatomeid kovalentsed sidemed (jagatud elektronipaarid).
Ühekordset kovalentset sidet märgitakse enamasti kriipsuna, kaksiksidet kujutatakse kahe paralleelse kriipsuna ja kolmiksidet kolme paralleelse kriipsuna.
Orgaaniliste ainete koostises võib olla erinevaid elemente, kuid kõige olulisemad on süsinik, vesinik, hapnik, lämmastik ja halogeenid.
Süsinik moodustab orgaanilistes ühendites 4 sidet. Seda keskset teadmist tuleb valemite lugemisel või kirjutamisel kogu aeg meeles pidada.
Süsiniku neli sidet võivad jaotuda erinevalt:
- neli üksiksidet,
- üks ja kaks üksiksidet,
- ja ,
- kaks kaksiksidet.
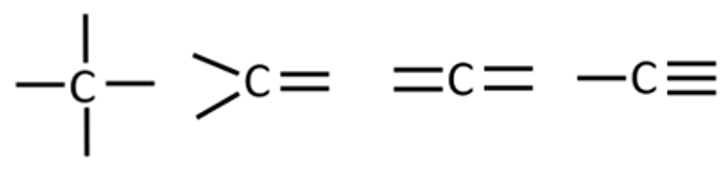
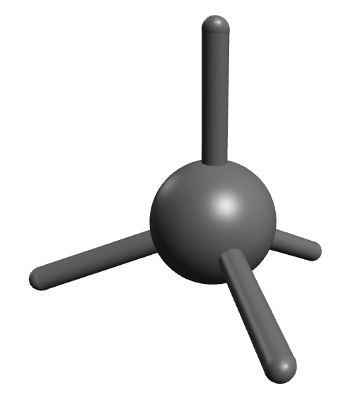 Kuigi pildilt võib jääda mulje, et kõik süsinikuaatomi sidemed paiknevad ühel tasapinnal, paiknevad C aatomiga seotud neli üksiksidet tegelikult ruumiliselt ja on suunatud tetraeedri tippudesse. Seetõttu ei ole ka enamik orgaanilisi aineid tasapinnalised, vaid ruumilise kujuga.
Kuigi pildilt võib jääda mulje, et kõik süsinikuaatomi sidemed paiknevad ühel tasapinnal, paiknevad C aatomiga seotud neli üksiksidet tegelikult ruumiliselt ja on suunatud tetraeedri tippudesse. Seetõttu ei ole ka enamik orgaanilisi aineid tasapinnalised, vaid ruumilise kujuga.
Vesinik ja halogeenid (fluor, kloor, broom, jood) annavad ühe sideme.
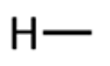
Hapnik annab kaks sidet. Need võivad esineda kas kahe üksiksideme või ühe kaksiksidemena.
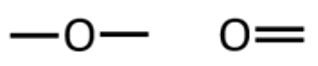
Lämmastik annab kolm sidet. Need sidemed võivad esineda erinevatel viisidel:
- kolm üksiksidet,
- kaksikside ja üksikside,
- kolmikside.
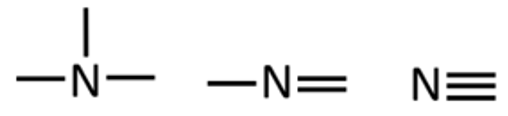
Laenguga aatomite kohta eeltoodud sidemete arvud ei kehti. Kui hapniku omab orgaanilises ühendis negatiivset laengut, on tal vaid üks side, positiivse laenguga lämmastikuaatomil on aga neli sidet. Need sidemete arvud kehtivad näiteks ka anorgaanilisest keemiast tuntud ioonides OH– ja NH4+.
Tabel 1. Sidemete arvud orgaanilistes ühendites
 Loe lisaks: Millest tuleneb elemendi keemiliste sidemete arv?
Loe lisaks: Millest tuleneb elemendi keemiliste sidemete arv?
Funktsionaalrühmad
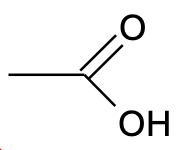 Süsinikuühendi keemilised (ja osalt ka füüsikalised) omadused ja aineklassi määrab see, millised funktsionaalrühmad molekulis lisaks süsinikahelale leiduvad. Näiteks käituvad karboksüülrühma sisaldavad ühendid vesilahuses nõrkade hapetena. Kui asendada hapnikuga seotud vesinikuaatom karboksüülrühmas süsiniku aatomiga (näiteks –CH3 koostises), saame esterrühma, mida sisaldavad ühendid enam vesilahuses happelised ei ole. Oluliselt muutuvad ka aine , keemis- ja sulamistemperatuur jt füüsikalised omadused. Seetõttu on orgaanilises keemias väga oluline jälgida, kuidas on aatomid ühendi molekulis omavahel seotud, sest väike muutus struktuuris võib muuta palju aine omadusi.
Süsinikuühendi keemilised (ja osalt ka füüsikalised) omadused ja aineklassi määrab see, millised funktsionaalrühmad molekulis lisaks süsinikahelale leiduvad. Näiteks käituvad karboksüülrühma sisaldavad ühendid vesilahuses nõrkade hapetena. Kui asendada hapnikuga seotud vesinikuaatom karboksüülrühmas süsiniku aatomiga (näiteks –CH3 koostises), saame esterrühma, mida sisaldavad ühendid enam vesilahuses happelised ei ole. Oluliselt muutuvad ka aine , keemis- ja sulamistemperatuur jt füüsikalised omadused. Seetõttu on orgaanilises keemias väga oluline jälgida, kuidas on aatomid ühendi molekulis omavahel seotud, sest väike muutus struktuuris võib muuta palju aine omadusi.
on aatomite rühm molekulis, mis määrab selle keemilised omadused.
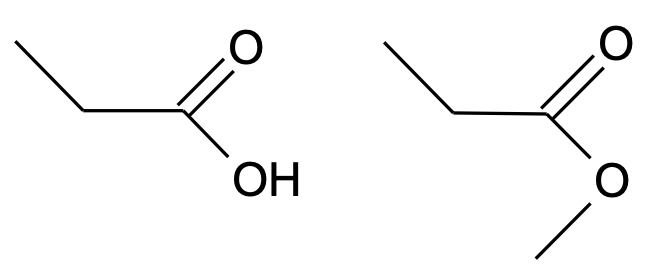
Joonis 1. Vasakpoolne ühend käitub vesilahuses happena, parempoolne mitte


