
4.10. Keemilised vooluallikad
Kütuste kohte kohta saad ülevaate järgmisest videost.
Allikas: https://youtu.be/zE8UiwMe1o8
Kindlasti oled kuulnud erinevatest energiaallikatest. Tuulest saadakse tuulegeneraatorite abil tuuleenergiat, päikesest päikesepaneelide abil päikeseenergiat. Keemiline energia vabaneb keemiliste reaktsioonide käigus. Keemiliste vooluallikate abil saame elektrienergiat. Ühed tuntumad keemilised vooluallikad on akud. Igapäevaelus ei kujuta me enam elu ette ilma hea telefoniakuta. Akud on mõeldud pikaajaliseks kasutamiseks ning tühjenemisel saab neid uuesti laadida. Keemilist energiat saame ka patareidest. Patareid on tavaliselt mõeldud ühekordseks kasutamiseks.
Keemilise vooluallika tööpõhimõte
Üks lihtsamaid keemilisi vooluallikaid on vask-tsinkelement. Elemendi all mõeldakse siin tervet keemilist vooluallikat, mitte keemilist elementi. Element koosneb kahest erineva aktiivsusega metallist, katoodist ja anoodist. ja on juhtmete abil ühendatud elektritarbijaga. Metallid on sukeldatud elektrolüüdi lahusesse. Lahused on omavahel ühendatud elektrolüüdilahusega täidetud toruga (elektrolüütsilla ehk soolasillaga), võimaldamaks ioonidel lahuste vahel liikuda. Anoodiruumis on tsinksulfaadi ja katoodiruumis vask(II)sulfaadi lahus. Redoksreaktsioonis tõrjub aktiivsem tsink vase soolalahusest välja. Protsess on eksotermiline ja toimub isevooluliselt (joonis 1).
Anoodireaktsioon
Anood on metalliline tsink, tsink on ja oksüdeerub:
 Zn – 2e– → Zn2+
Zn – 2e– → Zn2+
Selle tulemusena anood lahustub ja reaktsioon saab toimuda seni, kuni tsink on täielikult lahustunud. Metalliline tsink laadub negatiivselt, sest tsink loovutab elektronid.
Katoodireaktsioon
Katoodiks on metalliline vask. Vask on mitteaktiivne metall ning metalliline vask on üsna stabiilne. Seetõttu lahuses olevad vaseioonid liidavad elektrone ehk redutseeruvad ning vask sadeneb.
 Cu2+ + 2e– → Cu↓
Cu2+ + 2e– → Cu↓
Katood laadub positiivselt. Katoodil toimub vase redutseerimine.
Liidame poolreaktsioonid kokku ja saame summaarse reaktsioonivõrrandi ioonsel kujul:
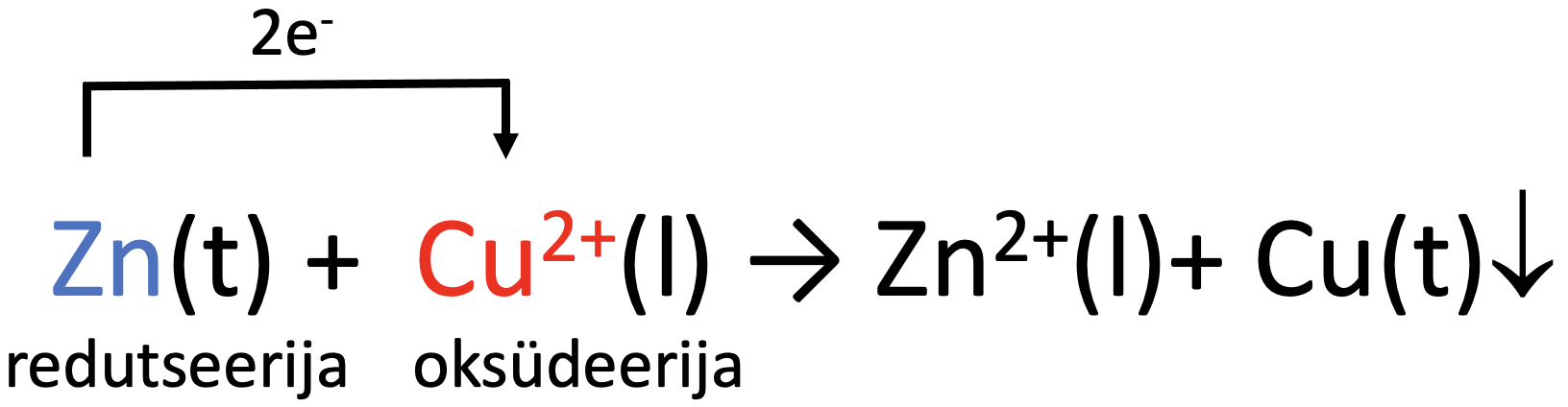
Molekulaarse reaktsioonivõrrandi saame siis, kui lisame juurde ka sulfaatioonid:
Zn + CuSO4 → ZnSO4 + Cu↓.
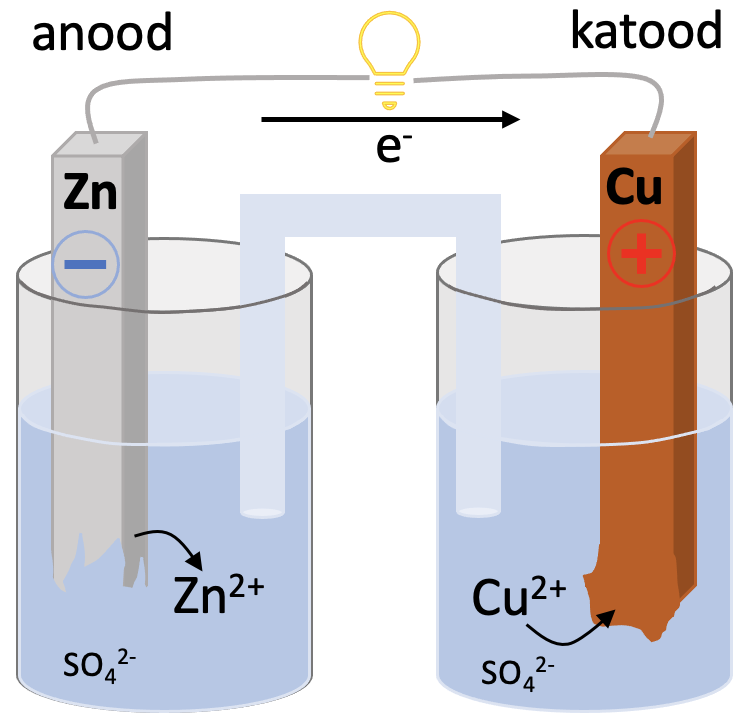
Joonis 1. Vask-tsinkelement
1.10. Tsink-vask keemilises toimub keemiline reaktsioon Zn + CuSO4→ ZnSO4 + Cu↓.
Kui lahustub 1 g tsinki, mitu grammi vaske tekib? Anna vastus täpsusega kaks kohta pärast koma.
Vastus: 0,98 g
Lahendus: antud on tsingi mass 1 g. Saame selle moolide arvu leida, teades, et M(Zn) = 65 g/mol:
$n(Zn) = {m \over M}= {1g \over 65g/mol}=0.015mol$
Reaktsioonivõrrandist näeme, et tsingi ja vase moolsuhe on 1:1. Seega tekib 0,015 mol vaske. Teades, et M(Cu) = 63,5 g/mol, leiame selle massi:
m(Cu) = n × M = 0,015 mol × 63,5 g/mol = 0,9769 ≈ 0,98 g
1.11. Tsink-vask keemilises vooluallikas toimub keemiline reaktsioon Zn + CuSO4→ ZnSO4 + Cu↓.
Kui lahustub 1 g tsinki, mitu grammi vaske tekib, protsessi kadu on 10 %? Anna vastus täpsusega kaks kohta peale koma.
Vastus: 0,88 g
Lahendus: antud on tsingi mass 1 g. Saame selle moolide arvu leida, teades, et M(Zn) = 65 g/mol:
$n(Zn) = {m \over M}= {1g \over 65g/mol}=0.0154 mol$
Reaktsioonivõrrandist näeme, et tsingi ja vase moolsuhe on 1:1. Seega tekib 0,015 mol vaske. Teades, et M(Cu) = 63,5 g/mol, leiame selle massi:
m(Cu) = n × M = 0,0154 mol × 63,5 g/mol = 0,9769 ≈ 0,98 g
Kuna aga kadu on 10%, tekib arvutatud massist 10% vähem ehk 90%. Seega on mass 0,98×0,9 = 0,88 g.


