
3.6. Mis on elektrolüüdid ja mitteelektrolüüdid
Lahustunud ained on lahustes kas molekulide või ioonidena.
on aine, mis jaguneb lahustumisel ioonideks. Ainete jagunemine ioonideks on . Ioonid on kas positiivselt laetud ehk katioonid või negatiivselt laetud ehk anioonid. Kuna ioonid on lahuses vabalt ringi liikuvad laenguga osakesed, siis elektrolüütide lahused juhivad elektrit. , ja on elektrolüüdid.
on aine, mis lahustumise käigus ioonideks ei jagune ja esineb seega lahuses molekulidena. Kuna mitteelektrolüütide lahustes ei ole ioone, ei juhi need elektrit. Mitteelektrolüüdid on näiteks (väävel, lämmastik, hapnik jpt) ja paljud orgaanilised ühendid (etanool, valge suhkur e sahharoos jne).
Allikas: https://youtu.be/xFc5uOP_tqU
Elektrolüüte saab liigitada elektrolüüdi tugevuse alusel.
- Tugevad elektrolüüdid esinevad lahuses ainult ioonidena (soolad, tugevad happed ja alused). Tugevate elektrolüütide lahused juhivad hästi elektrit.
- Nõrgad elektrolüüdid jagunevad lahuses ainult osaliselt ioonideks. Mida nõrgem on elektrolüüt ehk mida vähem on molekulid dissotsieerunud ioonideks, seda väiksem on ka lahuse elektrijuhtivus.
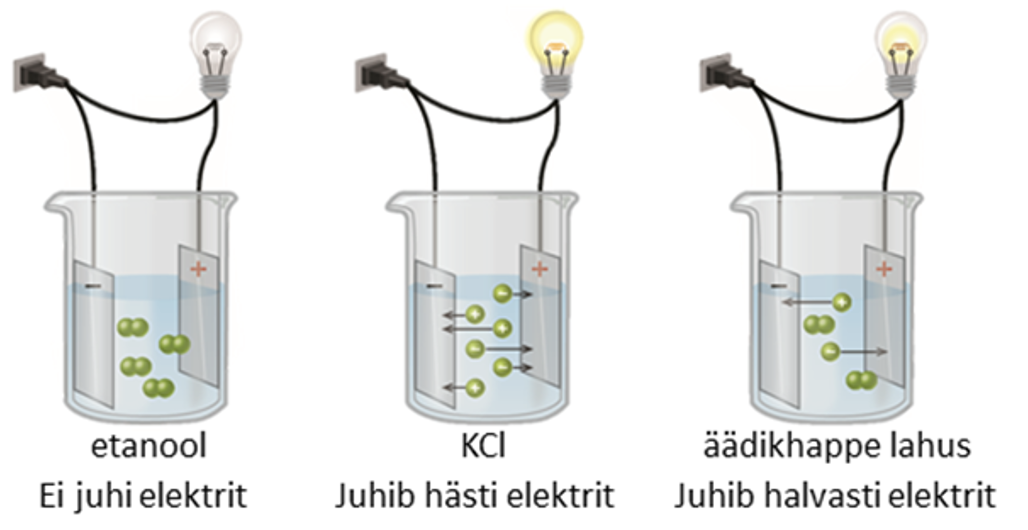
Joonis 1. Lahuste elektrijuhtivus: mitteelektrolüüdi etanooli ei juhi elektrit, tugeva elektrolüüdi KCl vesilahus juhib elektrit hästi ja nõrga elektrolüüdi äädikhappe vesilahus juhib elektrit halvasti. Allikas: https://opentextbc.ca/chemistry/wp-content/uploads/sites/150/2016/05/CNX_Chem_11_02_electrolyt.jpg
Soolad on tugevad elektrolüüdid.
Soolad on tugevad elektrolüüdid: nad jagunevad lahustumisel täielikult ioonideks. Mõned näited erinevate soolade dissotsatsioonist:
Ca(NO3)2 $\xrightarrow[]{H_{2}O}$ Ca2+ + 2 NO3–
FeSO4 $\xrightarrow[]{H_{2}O}$ Fe2+ + SO42-
K2SO4 $\xrightarrow[]{H_{2}O}$ 2 K+ + SO42-
Dissotsiatsioonivõrrandite koostamisel tuleb tähele panna, et ioonide arv ja laengud oleksid õigesti määratud ning võrrand tasakaalustatud. Kuna soolade elektrolüütiline dissotsiatsioon kulgeb täielikult lõpuni (ei ole pöörduv protsess), siis kirjutatakse võrrandisse ühesuunaline nool.
Tugevad happed ning alused on tugevad elektrolüüdid. Nende elektrolüütiline dissotsiatsioon kulgeb lõpuni.
Tugevad happed ning alused on ka tugevad elektrolüüdid ja jagunevad lahustumisel täielikult ioonideks. Näiteks vee toimel HCl laguneb ning eraldunud prootonist tekib hüdrooniumioon (H3O+):
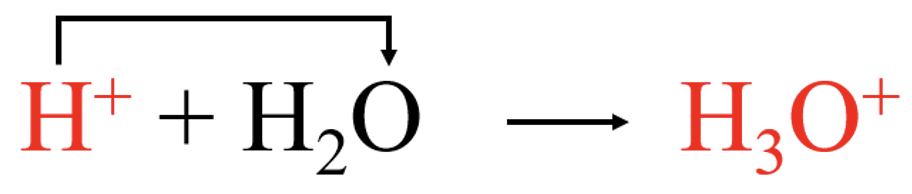
HCl molekulis katkeb ja ühine elektronpaar läheb elektronegatiivsemale aatomile ehk kloori aatomile ning moodustub kloriidioon ![]() . Summaarselt
. Summaarselt
HCl + H2O → Cl– + H3O+.
Ka teiste hapete lahustumise käigus jääb vesinik elektronpaarist n-ö ilma, seondub vee molekuliga ja tekib hüdrooniumioon. Samas tavaliselt kirjutame dissotsiatsiooni võrrandi ikka lihtsamal kujul:
HCl → Cl– + H+
Tugev alus naatriumhüdroksiid jaguneb lahustudes täielikult naatriumi katiooniks ja hüdroksiidaniooniks:
NaOH $\xrightarrow[]{H_{2}O}$ Na+ + OH − .
Tugevate hapete ja aluste elektrolüütiline dissotsiatsioon kulgeb lõpuni ja lahuses esinevad ainult ioonid, happe või aluse molekule lahuses ei ole.
ning alused on nõrgad elektrolüüdid.
Nõrgad happed ja alused, mis ei dissotsieeru täielikult (ehk esinevad lahuses ka molekulaarsel kuju), on nõrgad elektrolüüdid. Nõrkade elektrolüütide dissotsiatsioon on pöörduv protsess. Pöörduvaid reaktsioone tähistatakse kahesuunalise noolega. Nõrga elektrolüüdi lahuses esineb nii aine molekule kui ka selle aine molekulidest tekkinud ioone.
Etaanhappe ehk äädikhappe dissotsiatsioon: CH3COOH + H2O ⇆ CH3COO− + H3O+.
Lämmastikushappe dissotsiatsioon: HNO2 + H2O ⇆ NO2− + H3O+ .
Ammoniaakhüdraadi dissotsiatsioon: NH3×H2O ⇆ NH4+ + OH−.
(Kuid tavaliselt kirjutame dissotsiatsiooni võrrandi ikka lihtsamal kujul ja me vee molekule ei kujuta.)
Tabel 1. Näited tugevatest ja nõrkadest elektrolüütidest
|
Tugevad elektrolüüdid Lahuses ainult ioonidena |
Nõrgad elektrolüüdid Lahuses osaliselt ioonidena |
|||
|
soolad |
tugevad happed |
|
nõrgad happed |
|
|
NaCl, KNO3, CuSO4, K2CO3, jpt |
H2SO4, HNO3, HClO4, HI, HBr, HCl |
NaOH, KOH, LiOH, Ca(OH)2, Ba(OH)2 |
H2SO3, HNO2, H2CO3, H2S, H3PO4, CH3COOH |
Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, NH3∙H2O |
Astmeline dissotsiatsioon, mitmeprootoonsed happed
Mitmeprootoonsed happed sisaldavat mitut prootonit näiteks (H2SO3, H2CO3, H3PO4). Nende dissotsiatsioon kulgeb astmeliselt, kõigepealt loovutatakse esimene prooton, siis teine jne. Vaatame astmelist dissotsiatiooni süsihappe näitel:
H2CO3 + H2O ⇆ HCO3− + H3O+ (1. aste)
HCO3– + H2O ⇆ CO32− + H3O+ (2. aste)
(Kuid tavaliselt kirjutame dissotsiatsiooni võrrandi ikka lihtsamal kujul ja me vee molekule ei kujuta.)
Teises astmes dissotsieerub väga vähe ainet ja tasakaal on suunatud lähteainete poole. Mitmeprootoonsed happed moodustavad vesiniksoolasid.
Tabel 2. Happed, mis tekitavad vesiniksoolasid ning hapetele vastavad happejääkioonid
|
|
-1 H+ |
-2 H+ |
-3 H+ |
|
H2CO3 |
HCO3– vesinikkarbonaatioon |
CO32- karbonaatioon |
– |
|
H3PO4 |
H2PO4– divesinikfostaatioon |
HPO42- vesinikfostaatioon |
PO43- fosfaatioon |
|
H2SO3 |
HSO3– vesiniksulfitioon |
SO32- sulfitioon |
– |
1.8.
Lahendus: Kirjutame välja magneesiumsulfaadi ja väävelhappe dissotsiatsioonivõrrandid:
MgSO4 → Mg2+ + SO42-
H2SO4 → 2H+ + SO42-
Molaarsete kontsentratsioonide arvutamiseks on vaja teada ainete moolide arvu. Väävelhappe kohta on see teada, aga magneesiumsulfaadi kohta teame vaid massi. Sellest saame leida MgSO4 moolide arvu:
M(MgSO4) = 120 g/mol
$n(MgSO_4)= {m \over M}={10 g \over 120 g/mol}=0,083 mol$
Leiame nüüd, kui palju erinevaid ioone lahusesse dissotsiatsioonil tekib, ja nende molaarkontsentratsioonid.
Mg2+: 0,083 mol MgSO4 dissotsiatsioonil tekib 0,083 mol Mg2+ ioone. Nende c:
$c(Mg^{2+})= {n \over V}={0,083\hspace{0.1cm}mol \over 1,5\hspace{0.1cm}l}=0,0055\hspace{0.1cm}M≈0,06\hspace{0.1cm}M$
SO42-: 0,083 mol MgSO4 dissotsiatsioonil tekib 0,083 mol SO42- ioone. Lahusesse lisati ka 2 mol väävelhapet, mille dissotsiatsioonil tekib 2 mol SO42- ioone. Seega on SO42- ioone kokku 0,083+2=2,083 mol. Nende molaarne kontsentratsioon c:
$c(SO_4^{2-})= {n \over V}={2,083\hspace{0.1cm}mol \over 1,5\hspace{0.1cm}l}=1,388\hspace{0.1cm}M≈1,39\hspace{0.1cm}M$
H+: 2 mol H2SO4 dissotsiatsioonil tekib 2×2=4 mol H+ ioone. Nende molaarne kontsentratsioon c:
$c(H^{+})= {n \over V}={4\hspace{0.1cm}mol \over 1,5\hspace{0.1cm}l}=2,666… M≈2,67\hspace{0.1cm}M$


