6.2. Süsinikuühendite valemid
Summaarses valemis ehk molekulivalemis märgitakse koostiselementide aatomite arvud molekulis.
Orgaanilise molekuli koostist saab üles märkida erinevatel viisidel. Kõige lihtsam on koostist näidata summaarse valemi ehk molekulivalemi abil, milles märgitakse koostiselementide aatomite arvud molekulis. Kokkuleppeliselt kirjutatakse esimesena süsiniku aatomite arv ja teisena vesiniku aatomite arv. Ülejäänud elemendid järgnevad neile tähestiku järjekorras. Näiteks etanooli molekulivalem on C2H6O, glükoosi oma C6H12O6, 4-aminobutaanhappe ehk gamma-aminovõihappe (oluline aine närvisignaali ülekandes) molekulivalem aga C4H9NO2. Paraku annab selline aine koostise esitamise viis kõige vähem kasulikku informatsiooni, sest aine omadused määrab peamiselt molekuli struktuur. Kõige informatiivsemad on need molekuli kujutamise viisid, mis annavad edasi ka info selle kohta, kuidas erinevad aatomid on omavahel seotud. Seda võib teha molekulimudelitega.
Molekulimudel kujutab aatomite paiknemist molekulis.
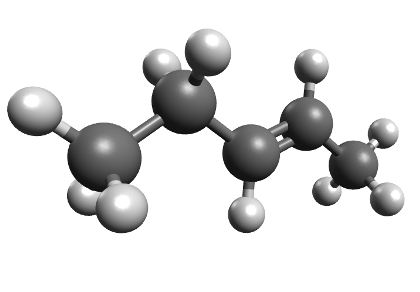
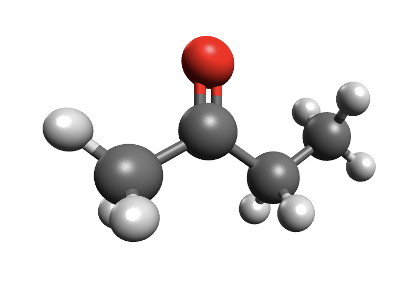
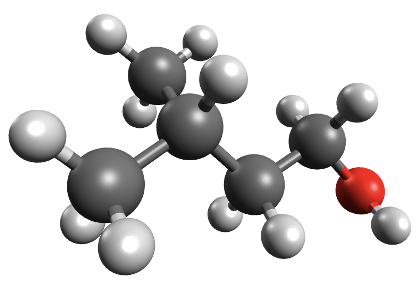
Koolides levinud molekulimudelites kujutatakse sageli aatomeid eri suurusega kuulidena ning keemilisi sidemeid vardakestena, mis sobituvad kuulides olevatesse aukudesse. Selliste mudelite abil saab näidata, millised aatomid on molekulis omavahel ühendatud ja milline on molekuli kuju. Tegelikult muidugi vardake ei ole ning kõige täpsemalt näitavad molekuli kuju täisruumilised molekulimudelid. Näiteks 4-aminobutaanhappe molekuli saab kujutada järgmiste molekulimudelitega:
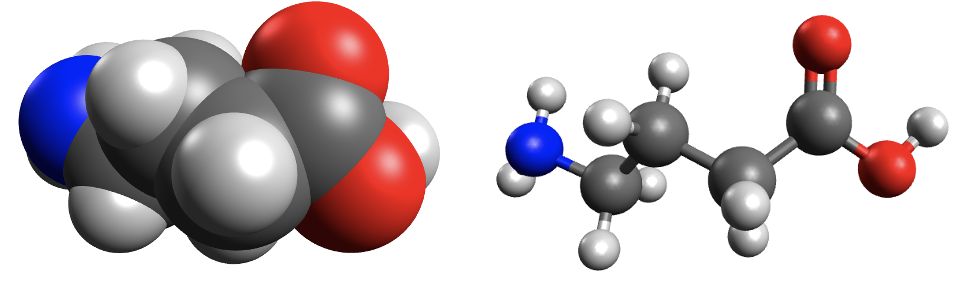
Joonis 1. 4-aminobutaanhappe täisruumiline ja kuul-varrasmudel
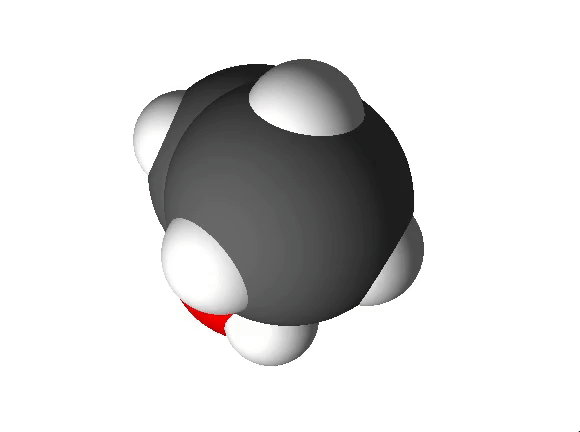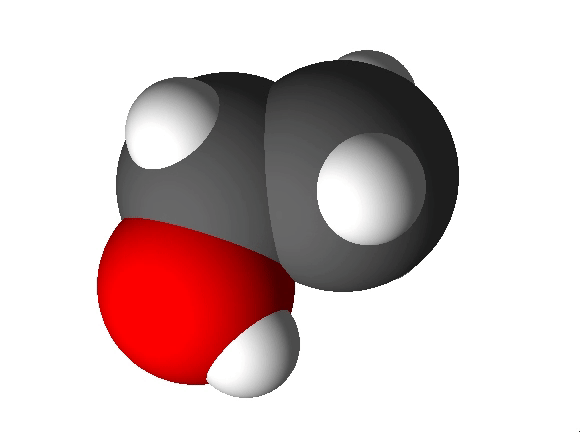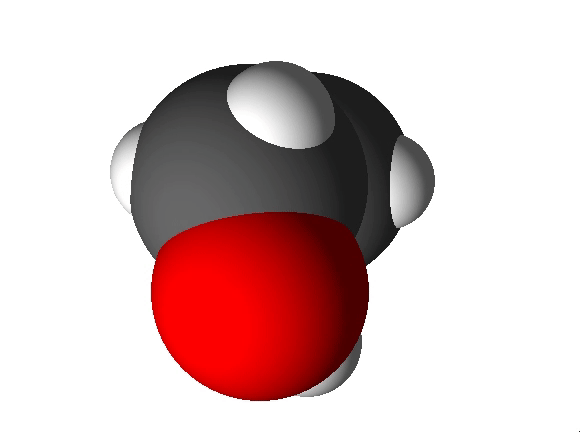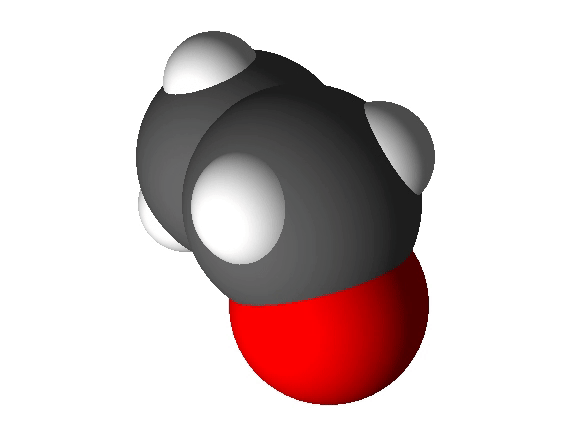
Joonis 2. Etanooli molekulimudel
Kuigi molekulimudelid kujutavad molekuli struktuuri kõige täpsemalt, vajab nende koostamine erilisi vahendeid (spetsiaalne arvutiprogramm või molekulimudelite komplekt) ja need on suuremate molekulide puhul raskesti jälgitavad. Praktikas kasutatakse seetõttu molekulide struktuuri üles märkimiseks tavaliselt struktuurivalemeid. Tasapinnalises ehk klassikalises struktuurivalemis märgitakse ühel tasapinnal kõik keemilised sidemed molekulis.
näitab, millised aatomid on omavahel seotud ja millised sidemed nende vahel esinevad.
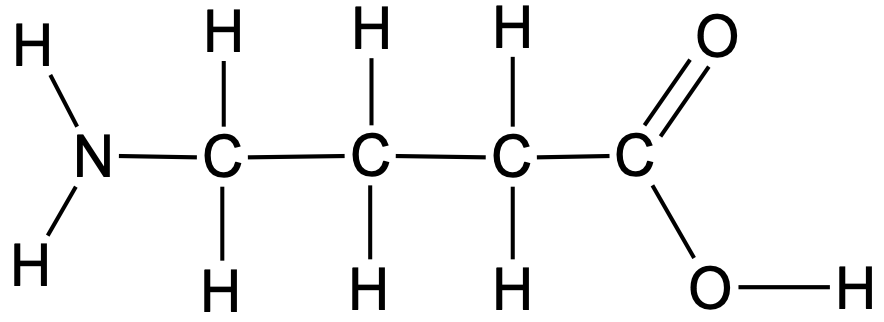
Joonis 3. 4-aminobutaanhappe tasapinnaline struktuurivalem
Tasapinnaline valem ei kujuta õigesti molekuli kuju, kuid näitab detailselt, kuidas on aatomid keemiliste sidemetega ühendatud. Paraku on suuremate molekulide tasapinnalised struktuurivalemid raskesti jälgitavad ja nende kirjutamine aeganõudev.
on selline valem, kus esitatakse sidemetega seotud aatomite rühmad. Lihtsustatud struktuurivalemis jäetakse keemilised sidemed kas osaliselt või täielikult märkimata. 4-aminobutaanhapet võib lihtsustatud struktuurivalemiga üles märkida nagu joonisel 4, aga näiteks ka lihtsalt kui H2N–CH2–CH2–CH2–COOH (või H2NCH2CH2CH2COOH).
Lihtsustatud struktuurivalemis märgitakse sidemetega seotud aatomite rühmad.
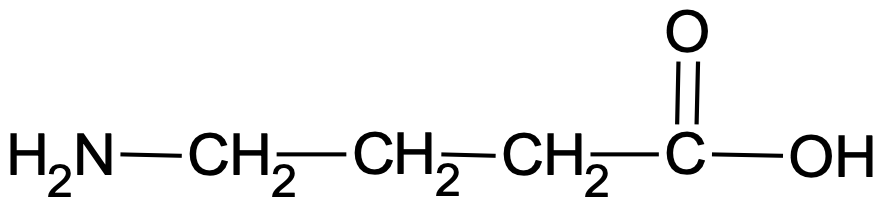
Joonis 4. 4-aminobutaanhappe lihtsustatud struktuurivalem
Suuremate molekulide kujutamiseks on kõige mugavam molekuli ehk graafiline kujutis, milles näidatakse aatomitevahelisi sidemeid ja süsinikahela tasapinnalist kuju, ent üldiselt ei märgita C–H sidemeid ja süsinikuaatomiga seotud vesinikuaatomeid. Kriipsukesed kujutavad C–C sidemeid ja kriipsu murdekohas või otspunktis on süsinikuaatom. Süsinikuaatomiga seotud vesinikud tuleb ise juurde mõelda, kasutades teadaolevat süsinikuaatomi sidemete arvu ja muude sidemete arvu ühendis. 4-aminobutaanhappe graafiline kujutis on järgmine:
Graafiline struktuurivalem näitab ära süsinikahela paiknemise tasandil.
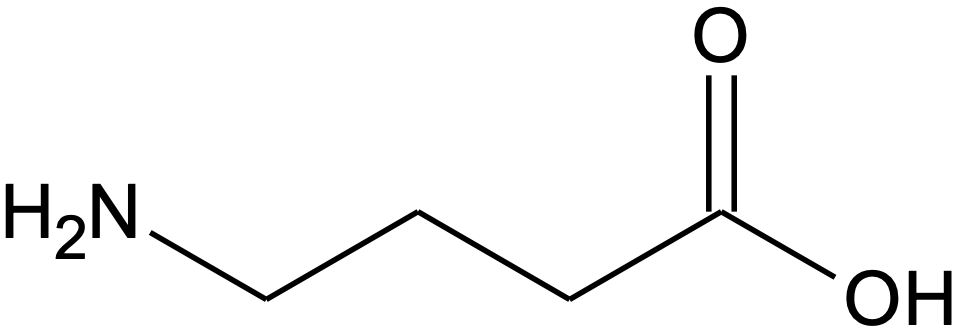
Joonis 5. 4-aminobutaanhappe graafiline kujutis
Selles valemis kujutavad kolm murdekohta, mille juurde pole muid aatomeid märgitud, süsinikuaatomeid süsinikahelas. Kuna süsiniku aatomil on neli sidet, peab murdekoha süsiniku aatomiga olema seotud kaks vesinikuaatomit ning iga murdekoht kujutab –CH2–. Hapnikuaatomitega seotud süsinikuaatomil ahela lõpus on juba neli sidet olemas, seega selle süsinikuaatomiga täiendavaid vesinikuaatomeid seotud ei ole. Graafiliste struktuurivalemite kasutamine on tänapäeval orgaanilises keemias kõige levinum viis molekule kujutada ning seega on väga oluline selgeks saada nende valemite kirjutamine ja lugemine. Vajadusel võta aega selle harjutamiseks.
Tabel 1. Näited molekuli struktuuri erinevatest esitusviisidest
|
Molekulimudel |
|
|
|
|
Klassikaline struktuurivalem |
|
|
|
|
Lihtsustatud struktuurivalem |
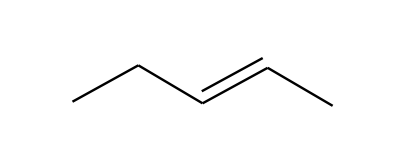
CH3CH2CH=CHCH3 |
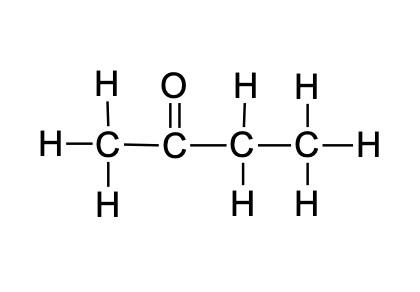
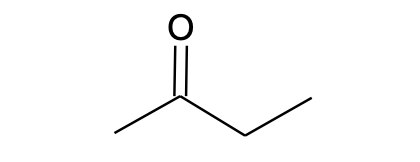
CH3COCH2CH3 |
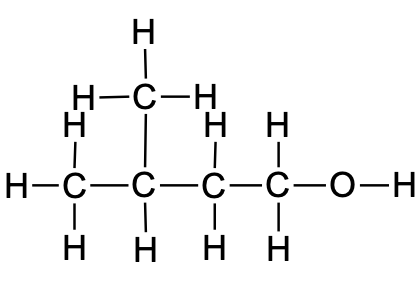
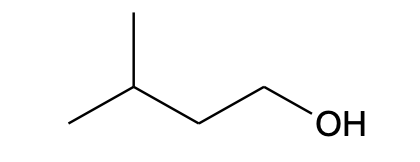
CH3CH(CH3)CH2CH2OH |
|
Graafiline kujutis |
|
|
|
|
Molekulivalem (summaarne valem) |
C5H10 |
C4H8O |
C5H12O |
Süsinikahelad
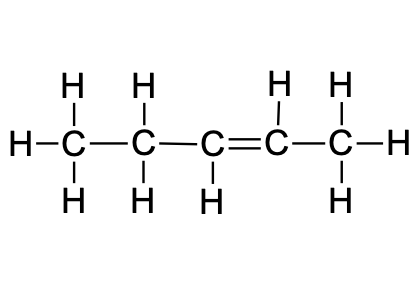
Süsinikahelad võivad olla sirged ehk lineaarsed, hargnenud või tsüklilised.
Orgaanilise molekuli n-ö skelett on peamiselt süsinikahel, aga võib sisaldada ka teisi aatomeid. Süsinikahelad võivad olla sirged ehk lineaarsed. Sellistes süsinikahelates paiknevad süsinikuaatomid järjestikku (ükski C- ei ole seotud enam kui kahe teise C-aatomiga). Ruumilise kuju poolest on “sirge” ahel tegelikult küll pigem siksakiline, sest C–C sidemete vahel on umbes 109° nurgad. Hargnenud ahela korral on üks süsinikuaatom seotud kolme või nelja teise süsinikuaatomiga. Võimalikud on ka tsüklilised süsinikahelad.
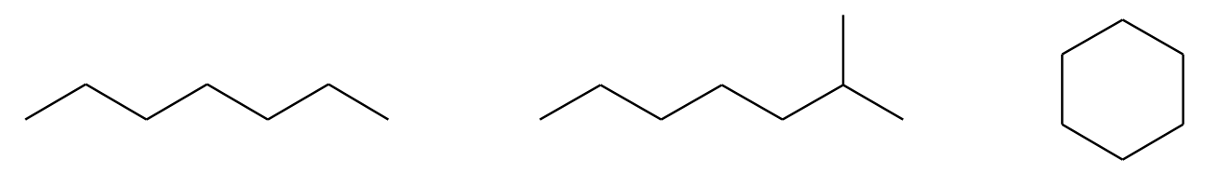
Joonis 6. Sirge (vasakul), hargnenud (keskel) ja tsüklilise (paremal) süsinikuahela näide
Isomeeria
on ained, millel on sama molekulivalem, kuid erinev molekuli struktuur.
Kuna molekuli struktuur määrab aine omadused, on isomeeridel erinevad omadused. Tuntakse erinevaid isomeeriatüüpe. Isomeerid võivad erineda näiteks funktsionaalrühma (funktsionaalrühma isomeeria), süsinikahela paigutuse (ahelaisomeeria) või funktsionaalrühma asendi poolest (asendiisomeeria).
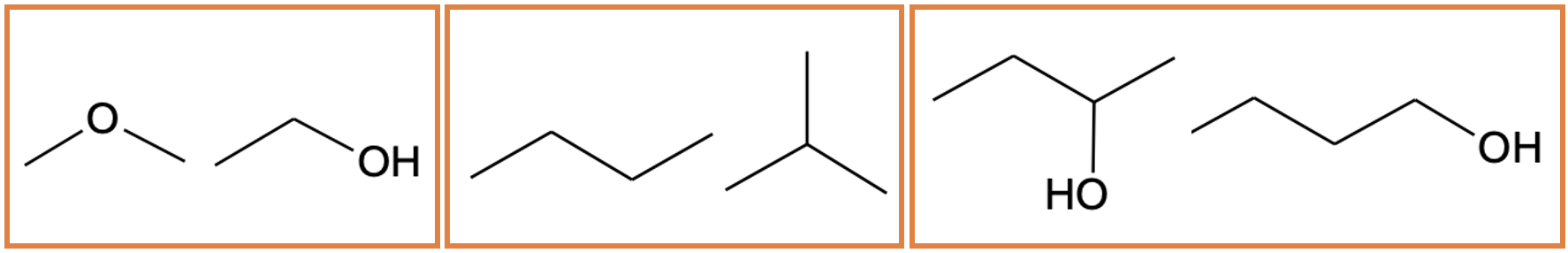
Joonis 7. C2H6O funktsionaalrühma isomeeride paar (vasakul), C4H10 ahelaisomeeride paar (keskel) ja C4H10O asendiisomeeride paar (paremal)