
5.5. Vesinik ja vesinikuühendid
Vesinik, mis asub IA rühmas, kuulub mittemetallide hulka. Looduses esineb vesinik kolme isotoobina: prootium, deuteerium ja triitium, mis erinevad üksteisest neutronite arvu poolest (joonis 1).
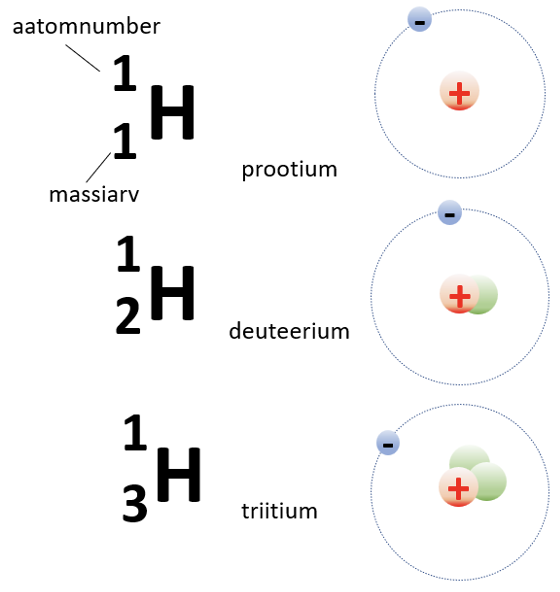
Joonis 1. Vesiniku isotoobid
Vesiniku on 1s1, st väliskihis on üks elektron, mille ta reaktsioonides üldjuhul loovutab. Vesinik on väga tugev ning vesiniku tüüpiline oküdatsiooniaste ühendites on +I. Ainult metallidega reageerimisel käitub kui .
Vesinik on väga tugev redutseerija ning vesiniku tüüpiline ühendites on +I.
Ainena on vesinik värvuseta, lõhnata, maitseta ning õhust 14,32 korda kergem gaas. Vesiniku kui ülikerge gaasiga täidetud õhupallid tõusevad väga kõrgele. Vesinik lahustub halvasti vees ning orgaanilistes lahustites. Vesinik lihtainena on kaheaatomiline – H2. Molekulid on väga väikesed, kerged, liiguvad kiiresti ning on väga püsivad, lagunevad aatomiteks märgatavalt alles üle 2000 oC juures. Vesinik on kosmoses levinuim element ning moodustab põhiosa Päikese massist, ka Jupiter ja Saturn koosnevad peamiselt vesinikust. Võrreldes teiste mittemetallidega on vesinik keskmise aktiivsusega mittemetalliline element.
Vesinikumolekul on toatemperatuuril suhteliselt püsiv ning reaktsioonid kulgevad teiste ainetega üksnes kuumutamisel. Vesiniku keemilisi omadusi iseloomustab järgmine skeem.
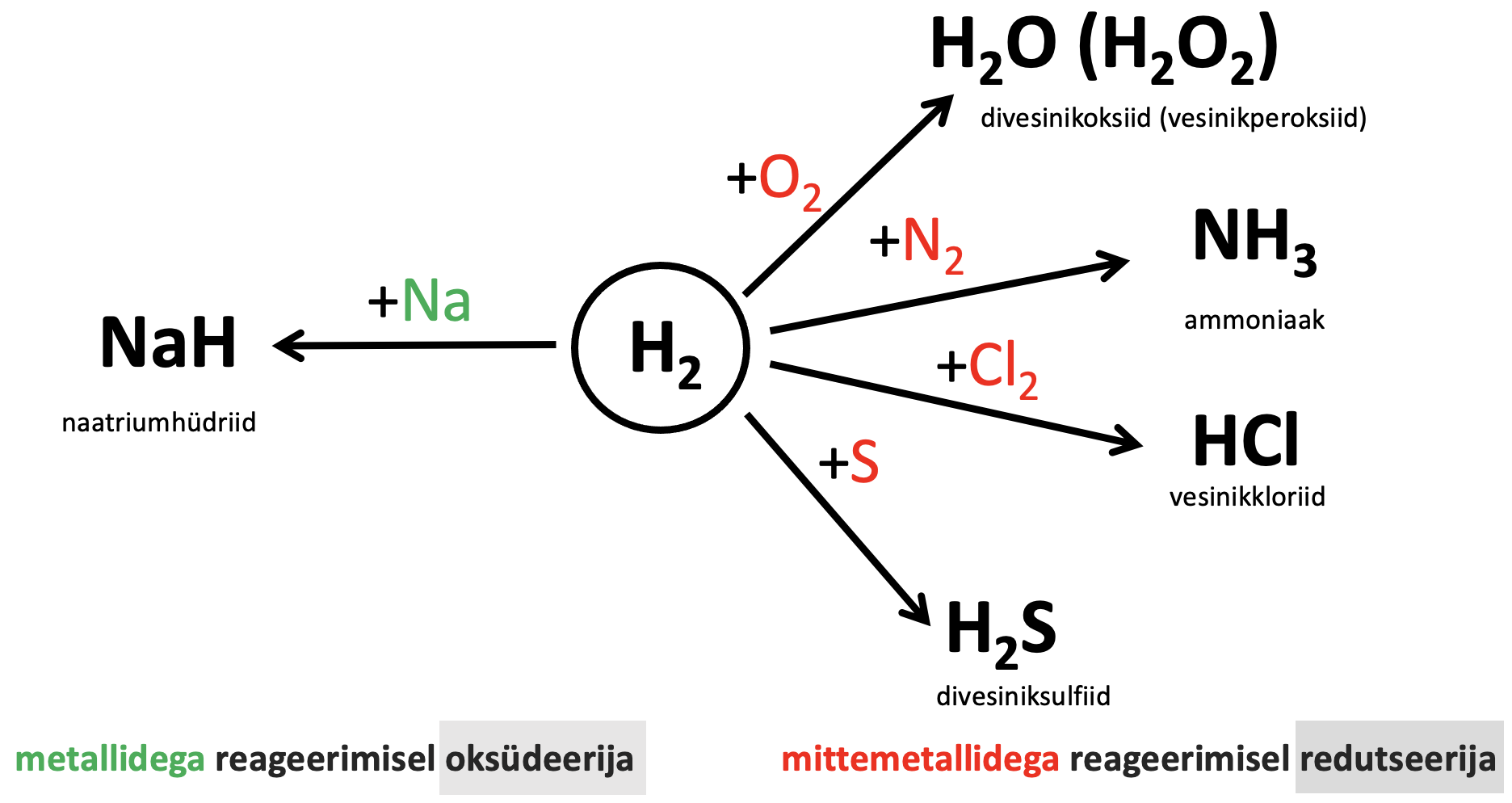
Joonis 2. Lihtaine H2 keemilised omadused
 Loe lisaks: Vesiniku segu õhu või hapnikuga on ohtlik.
Loe lisaks: Vesiniku segu õhu või hapnikuga on ohtlik.
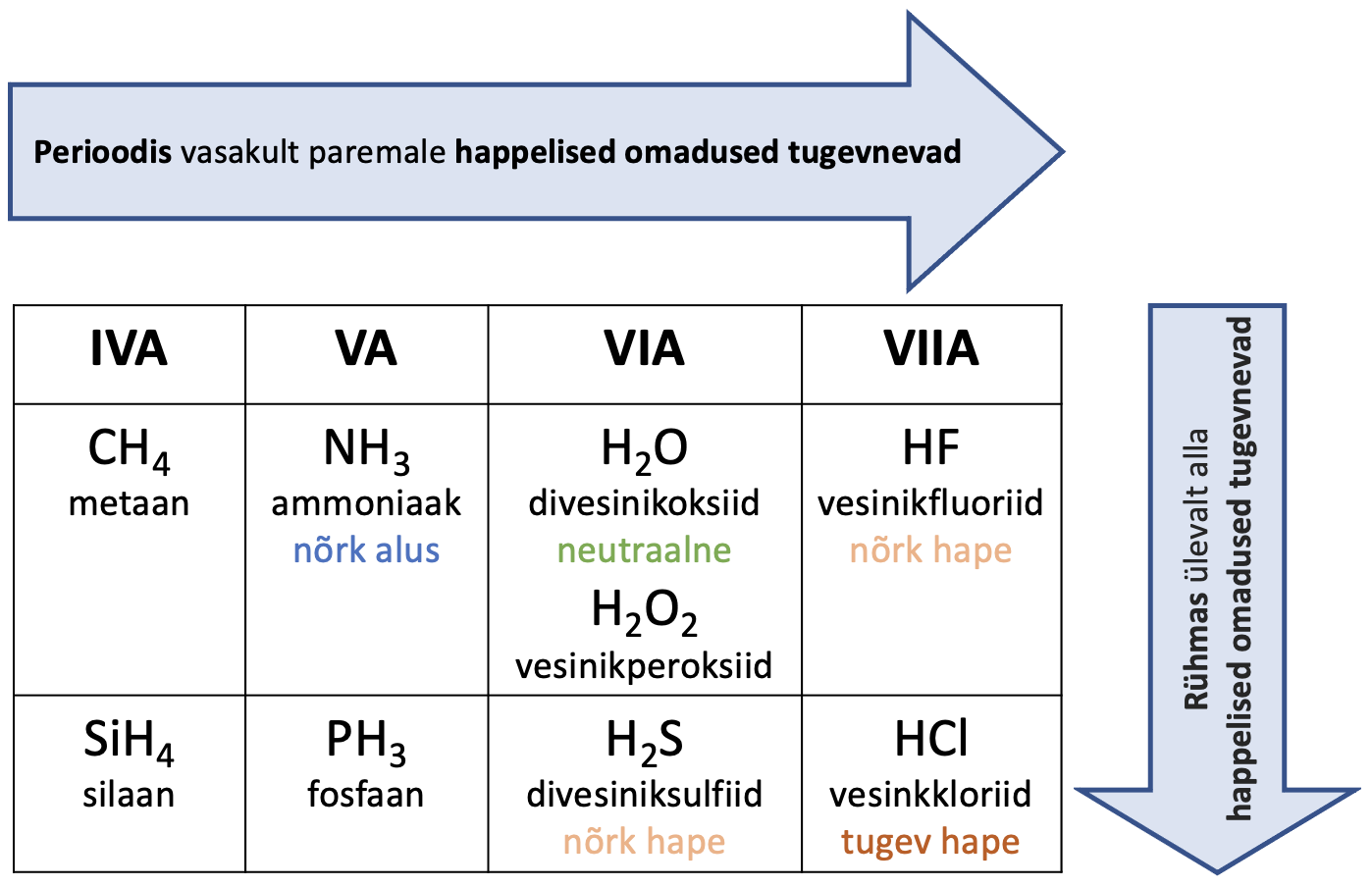
Tuntuimad vesinikühendid ja nende happe-alus omadused on toodud tabelis 1. Tabelist näed, et vesiniku oksüdatsiooniaste on mittemetallide vesinikühendites +I. Ainukese erandina on tabelis SiH4, kus H on elektronegatiivsem kui Si ning seega on ühine elektronpaar tõmmatud vesiniku poole ning vesiniku o.a on -I.
Mittemetallide vesinikühendid on erinevate happe-alus omadustega. Perioodis vasakult paremale mittemetallide vesinikühendite sideme polaarsus suureneb ning prootonit on kergem loovutada. Seetõttu suurenevad ka happelised omadused.
HF ⇆ H+ + F–
HF dissotsieerumisel tekib lahusesse prooton ja fluoriidioon. Prootonite hulga kasvades lahuses suureneb ka lahuse happelisus. Fluoriidhappe dissotsiatsioon on tasakaaluline, ülejäänud vesinikhalogeniidid dissotsieeruvad täielikult.
HI → H+ + I–
Rühmas ülevalt alla polaarse kovalentse sideme pikkus suureneb ja seetõttu on prootonit lihtsam loovutada. Vesinikhalogeniidide korral suureneb ühendis kovalentse sideme pikkus ja happelisus järgmises reas HF < HCl < HBr < HI. HI on vesinikhalogeniididest kõige tugevam .
Tabel 1. Tuntuimad mittemetallide vesinikühendid ja nende happe-alus omadused
Vesiniku saamine
Vesinikku on võimalik saada erinevate keemiliste reaktsioonide tulemusena.
Tööstuslikult
Tööstuslikult toodetakse vesinikku looduslikust gaasist metaanist kõrgel temperatuuril katalüsaatorite juuresolekul:
CH4(g) + H2O(g) $\xrightarrow[]{temp,kata\hspace{0cm}lüsaator}$ CO(g) + 3 H2(g) ΔH= 206,2 kJ
Katalüsaatori juuresolekul läheb reaktsioon edasi:
CO(g) + H2O(g) $\xrightarrow[]{kata\hspace{0cm}lüsaator}$ CO2(g) + H2(g) ΔH= -41,2 kJ
Selliselt saadud vesinik pole eriti puhas.
Elektrolüüsi teel puhta vesiniku tootmine
Vaata elektrolüüsi videot.
Puhast vesinikku toodetakse vee elektrolüüsil – katoodil eraldub vesinik ja anoodil hapnik (joonis 3).
: 2 H2O + 2e– → H2 ↑+ 2 OH–
: 2 H2O – 4e– → O2 ↑+ 4 H+
Summaarne vee elektrolüüsi võrrand:
2 H2O $\xrightarrow[]{e\hspace{0cm}lektrolüüs}$ 2 H2↑ + O2↑
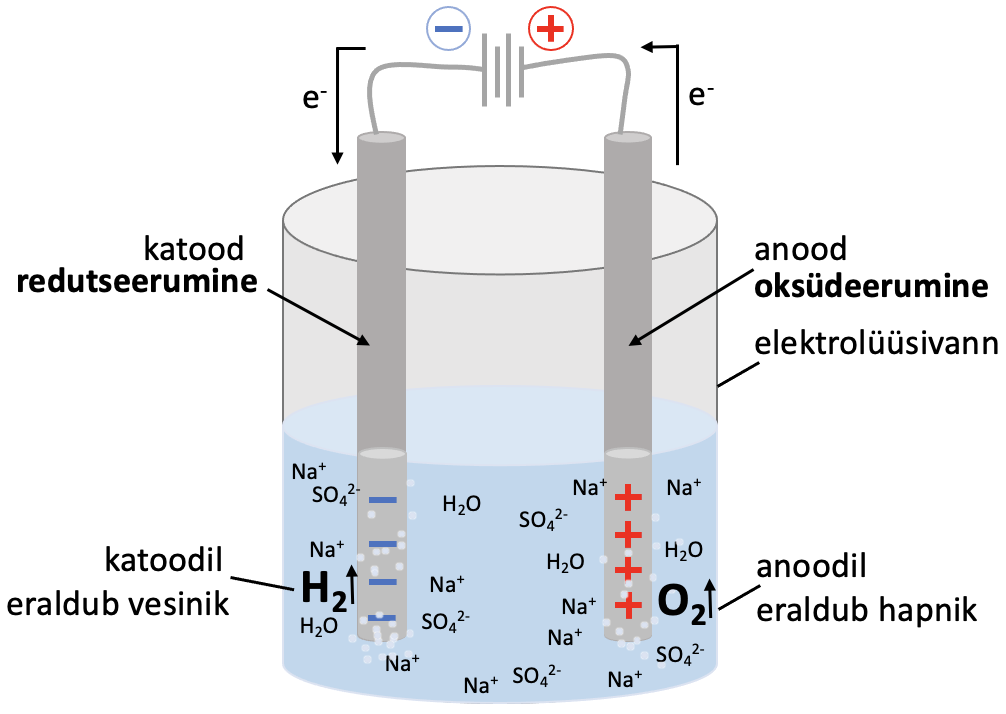
Joonis 3. Vee
Laboratoorselt
Laboris on vesinikku kõige odavam saada metalli reaktsioonil happega
+ hape → sool + vesinik
Zn(t) + 2 HCl(l) → ZnCl2(l) + H2(g)
Kuna metallid tavaliselt sisaldavad lisandeid, sisaldab eralduv H2 lisandina H2S, AsH3, SbH3 jt terava lõhnaga mürgised aineid.
aktiivne metall + vesi → alus + vesinik
2 Na + 2 H2O → 2 NaOH + H2↑
Ca + 2 H2O → Ca(OH)2 + H2↑
See meetod on ebapraktiline ja “ohtlik” vesiniku saamiseks laboris – eriti ei kasutata. Vaata metallide reageerimist veega ka metallide peatükist.
 Loe lisaks: Teisi laboratoorseid vesiniku saamise võimalusi.
Loe lisaks: Teisi laboratoorseid vesiniku saamise võimalusi.
Vesiniku rakendused
Vesiniku üks tähtsamaid ühendeid hapnikuga on vesi (H2O). Ilma veeta poleks elu, sest elusorganismides on põhikoostisosaks vesi, nendes toimuvad keemilised reaktsioonid kulgevad reeglina vesilahustes.
H2O2 vesinikperoksiidi kasutatakse meditsiinis desinfitseeriva vahendina või juuksurisalongides juuste pleegitamiseks (blondeerimiseks).
Vesinikku kasutatakse tänapäeval laialdaselt ammoniaagi tootmisel, raketikütusena, metallurgias metallide redutseerimisel oksiididest, keemiatööstuses paljude ainete saamisel (NH3, HNO3, NaOH jne).
Vesinik kui kütuseelementide kütus
Vesiniku oksüdeerumisel hapnikuga eraldub palju energiat ja seejuures tekib saadus vesi, mis ei saasta loodust. Vee tekkimise reaktsiooni vesinikust ja hapnikust kasutatakse ära keemilistes vooluallikates – nn kütuseelementides. Kütuseelement (fuel cell) on seade, mis toodab keemilisest energiast elektrienergiat, ilma et muundaks seda vahepeal mehaaniliseks. Kütuseelemendis ühel elektroodil (anood) oksüdeerub vesinik ja teisel elektroodil (katoodil) redutseerub hapnik. Järgnevalt ongi ära toodud kütuseelemendi lihtsustatud skeem ja elektroodidel toimuvad reaktsioonid (joonis 4).
Kütuseelemendis toimub järgmine keemiline reaktsioon:
Anood (-): H2 → 2H+ + 2e–
Katood (+): 2e– + 2H+ + ½ (O2) → H2O
Element: H2 + ½ O2 → H2O
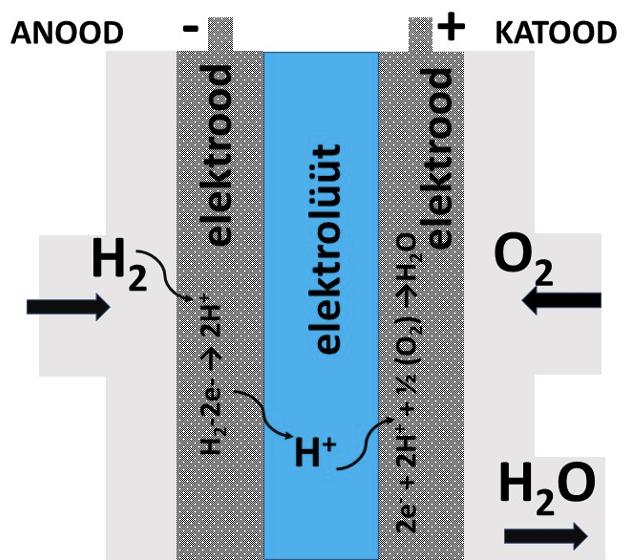
Joonis 4. Kütuseelemendi skeem
Kütuseelemente on erinevaid. Sõltuvalt kasutatavatest materjalidest on nende töötemperatuurid erinevad – osad töötavad madalatel temperatuuridel ning osad kõrgetel. Samuti on erinev nende kasutegur, jäädes keskmiselt ligikaudu 60% kanti.
Vähem aktiivstete metallide saamine
Vesiniku kasutamisel redutseerijana saadakse väga puhtaid metalle. Kasutades redutseerijana süsinikku, jääb alati metalli sisse väikeses koguses lisandina süsinikku.
Fe2O3(t) + 3 H2(g) → 2 Fe(t) + 3 H2O(g)
CuO(t) + H2 (g) → Cu(t) + H2O(g)
Keemiatööstuses kasutatakse vesinikku ammoniaagi, vesinikkloriidi jt sünteesis.
N2(g) + 3 H2(g) ⇆ 2 NH3(g)
Cl2(g) + H2(g) ⇆ 2 HCl (g)
Orgaaniliste ühendite .
CH2=CH2 + H2 → CH3-CH3
Keevitamisel (nn vesinik-hapnik keevitus) – rasksulavate metallide keevitamisel.
Kütusena küttegaasides (nt veegaas – segu CO2-st ja H2-st).
1.3. Mitu liitrit vesinikku eraldub 8g tsingi reageerimisel väävelhappe lahusega normaaltingimustel?
Vastus anda kaks kohta peale koma.
Vastus: 2,76 l
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi:
Zn + H2SO4 → ZnSO4 + H2
Teades tsingi massi 8 g ja arvutades molaarmassi 65 g/mol, leiame selle moolide arvu:
$n(Zn) = {m \over M}= {8g \over 65g/mol}=0.123mol$
Reaktsioonivõrrandist näeme, et tsingi ja vesiniku moolsuhe on 1:1. Seega tekib 0,123 mol vesinikku, mille ruumala on:
V(H2) = n × Vm = 0,123 mol × 22,4 dm3/mol = 2,757 ≈ 2,76 dm3
1.5. Mitu liitrit vesinikku kulub 30g raua saamiseks raud(III)oksiidist normaaltingimustel?
Vastus: 18 l
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi:
Fe2O3 + 3H2 → 2Fe + 3H2O
Leiame tekkiva raua moolide arvu, sest on teada raua mass 30 g ja saame arvutada selle molaarmassi (56 g/mol):
$n(Fe) = {m \over M}= {30g \over 56g/mol}=0.54mol$
Raua ja vesiniku moolsuhe on 2:3, seega tekib vesinikku 0,54 × 3 / 2 = 0,81 mol. Leiame selle ruumala:
V(H2) = n × Vm =0,81 mol × 22,4 dm3/mol = 18,14 ≈ 18 dm3
1.6. Mitu mooli hapniku aatomeid on 3 moolis H2O?
Vastus: 3 mooli
Lahendus: Ühes moolis vees on üks hapnikku, seega 3 moolis on 3 mooli hapnikku.
1.7. Aktiivsete metallide hüdriide saadakse sulale metallile gaasilise vesiniku peale juhtimisel. Mitu grammi NaH saadakse kui sulale naatriumile juhitakse peale 67,2 L H2 ning 20% vesinikust ei osale reaktsioonis, vaid hajub laiali? Metalli on võetud ülehulgas. Arvutused teha normaaltingimustel.
Vastus: 115,2 g
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi: 2Na + H2 → 2NaH
Esmalt leiame vesiniku moolide arvu. Teame selle ruumala 67,2 l ja ka seda, et 20% sellest hajub. Seega osaleb reaktsioonis 80% vesiniku hulgast ehk 67,2×0,8=53,76 liitrit. Leiame nüüd vesiniku moolide arvu:
$n(H_2) = {V \over V_m}= {53.76 l \over22.4dm^3/mol}=2.4mol$
Reaktsioonivõrrandist näeme, et vesiniku ja NaH moolsuhe on 1:2. Seega tekib naatriumhüdriidi 2×2,4=4,8 mol. Leiame selle massi, arvestades, et M(NaH)=24 g/mol:
m(NaH) = n × M = 4,8 mol × 24 g/mol = 115,2 g


