
5.4. Mittemetallide keemilised omadused
Mittemetallilised omadused on seotud aatomite võimega liita elektrone. Mittemetallide aatomid on võrreldes metalliaatomitega suhteliselt väikesed (vaata joonist 1).

Joonis 1. Peaalarühma aatomiraadiused pikomeetrites. Allikas: https://ptable.com/?lang=et#Properties/Radius/Calculated
Mittemetallide aatomid võivad elektrone nii liita kui ka loovutada.
Väliskihis on mittemetallidel elektrone palju rohkem (neli kuni kaheksa) kui metalliaatomitel. Allpool on toodud mõnede mittemetallide ja metallide elektronvalmid. Punaselt on märgitud väliskihid ja ja neil paiknevad elektronid. Väliskihi elektronid saavad osaleda keemilise sideme moodustamises. Element soovib saavutada olukorda, kus väliskiht on täitunud maksimaalselt kaheksa elektroniga ehk saavutanud väärisgaasidega sarnase oleku (okteti reegel). Elektronvalemitest näeme, et süsinik võib liita maksimaalselt 4 elektroni, aga samas saab ka loovutada maksimaalselt 4 elektroni. Seega erinevalt metallidest võivad mittemetalliaatomid elektrone nii loovutada kui ka liita.

Aatomite väikeste mõõtmete tõttu on tuumalaengu mõju väliskihi elektronidele küllaltki suur ja seetõttu hoitakse väliskihi elektrone aatomis kõvasti kinni ning mittemetalliaatomitele pole eriti iseloomulik neid loovutada. Väga paljudes reaktsioonides mittemetalliaatomid pigem seovad elektrone. on tavaliselt seda aktiivsem, mida elektronegatiivsem on vastav element. on suurus, mis iseloomustab keemilise elemendi aatomi võimet keemilise sideme moodustamisel tõmmata enda poole ühist elektronpaari. Elektronegatiivsuse väärtus on seotud aatomiehitusega ning sooviga saavuta välisele elektronkihile maksimaalselt kaheksa elektroni. Enamik mittemetallidel on kaheksast välise elektronkihi elektronist puudu ainult mõni elektron, seega nad hea meelega liidavad elektrone. Aatomite elektronegatiivsuse väärtused on toodud joonisel 2.
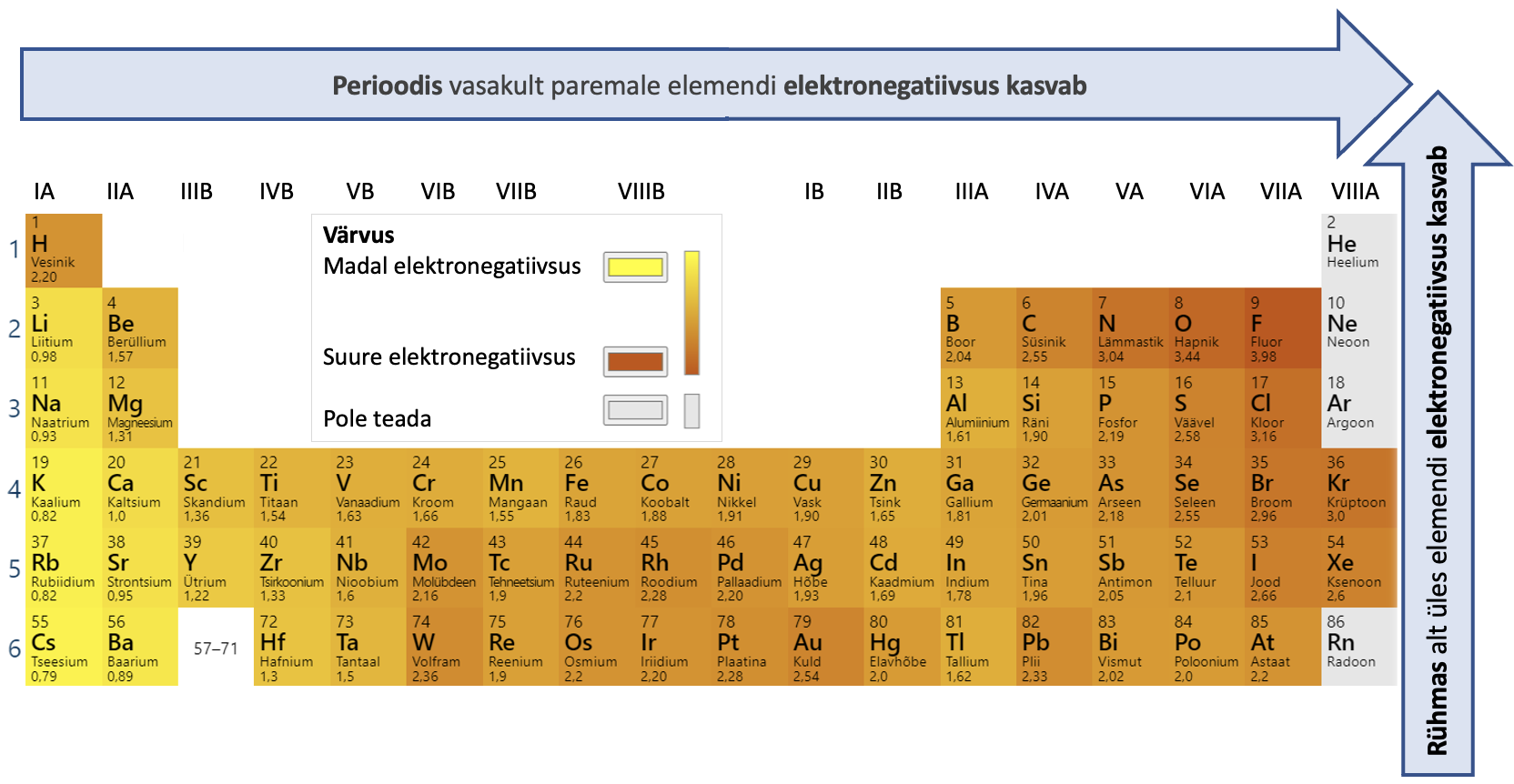
Joonis 2. Aatomite elektronegatiivsuse väärtused
Mittemetallidest kõige aktiivsemad on halogeenid ja kõige vähem aktiivsed on .
Mittemetallidest kõige aktiivsemad on halogeenid (asuvad VIIA rühmas). Kõige suurema aktiivsusega neist on fluor (F2). Fluor reageerib praktiliselt kõikide teiste lihtainetega juba toatemperatuuril. Mittemetallilised omadused ja nende keemiline aktiivsus oksüdeerjana suurenevad rühmas alt üles ning perioodis vasakult paremale.
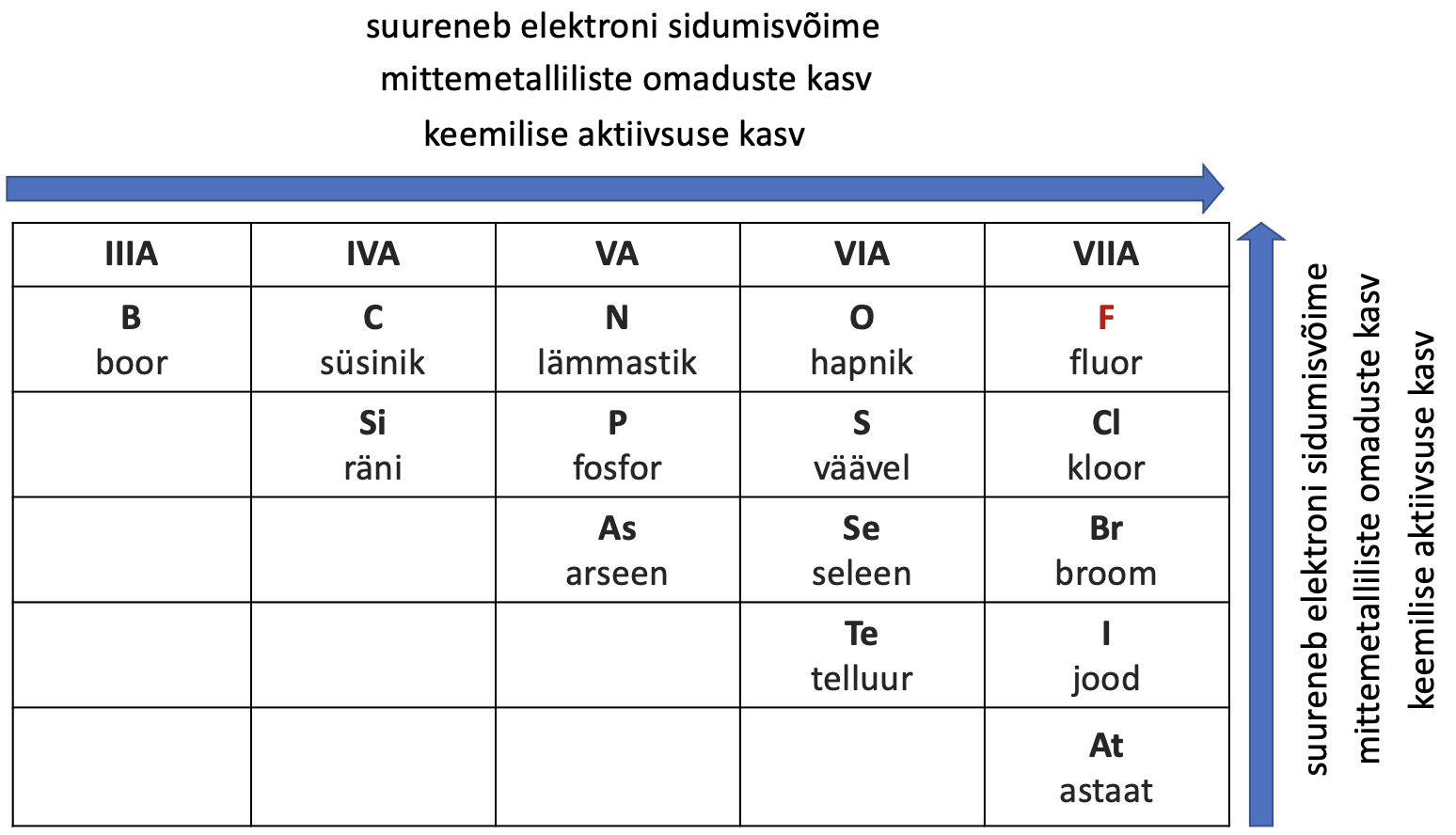
Joonis 3. Mittemetallide omaduste muutus perioodiliussüsteemis
Mittemetallilised omadused suurenevad perioodis vasakult paremale ja rühmas alt üles.
Teiste mittemetallide (nt N2, H2) reageerimisel metallide ja teiste mittemetallidega vajavad reaktsioonid kuumutamist või katalüsaatoreid. Mittemetallilised omadused suurenevad perioodis vasakult paremale ja rühmas alt üles.
Kõige vähem aktiivsed mittemetallid on VIIIA rühma elemendid – väärisgaasid.
Metallidega reageerimisel käituvad mittemetallid oksüdeerijatena, liites endaga metalli aatomite poolt loovutatavad elektronid. Näiteks väävli reaktsioonil naatriumiga väävel seob elektrone ja Na-aatomid loovutavad elektrone (joonis 4).
Metallidega reageerimisel käituvad mittemetallid oksüdeerijatena.
2Na + S → Na2S
Na – 1e– → Na+ oksüdeerub
S + 2e– → S2- redutseerub
Sel viisil reageerides saavutavad mittemetallid ja metallid püsiva oleku – väliskiht on maksimaalselt täitunud kaheksa elektroniga (vt joonist 4).
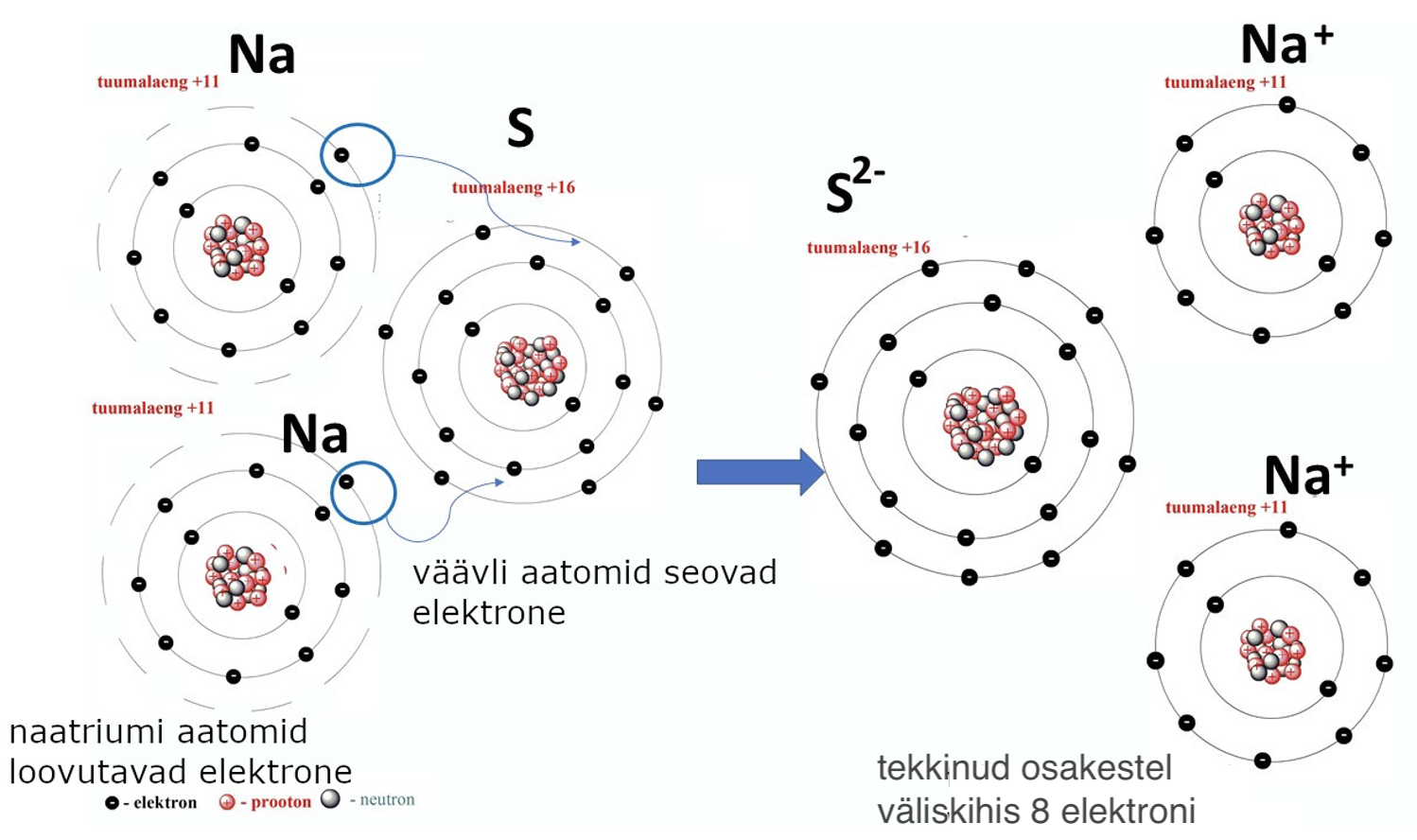
Joonis 4. Na2S tekkimine aatomite tasandil. Naatriumiaatomid loovutavad elektrone ja tekivad Na+-katioonid. Väävliaatom seob elektrone, tekivad S2--anioonid.
Väävli ja naatriumi reaktsioon toimub juba toatemepratuuril segu uhmerdamisel. Videost (joonis 5) on näha, et hõõrdumise tulemusena suurendatakse kokkupuutepinda ja segu süttib põlema.

Joonis 5. Naatriumi ja väävli reageerimine, saadusena tekib naatriumsulfiid (Na2S). Väävel käitub oksüdeerijana ja naatrium redutseerijana.
Samas võivad mittemetallid loovutada elektrone reageerimisel mõne endast aktiivsema mittemetalliga, st käituda redutseerijana. Näiteks regeerimisel hapnikuga on väävel redutseerija:
S (t) + O2(g) → SO2(g)
S0 – 4e– → SIV redutseerija oksüdeerub
O20 + 4e– → 2 O-II oksüdeerija redutseerub



