
5.10. Süsinik ja süsinikuühendid
Võrreldes süsinikku (lihtainena) 2. perioodi teiste mittemetalliliste elementide lihtainetega (F2, O2, N2, Ar) ilmneb selge erinevus. Hapniku, lämmastiku, fluori ja argooni korral on tegemist molekulaarsete ainetega, süsinik on mittemolekulaarne aine. Süsinik moodustab tahkes olekus . Süsiniku peamised on ja (joonis 1). Vaata videot süsiniku kui lihtaine kohta.
Allikas: https://youtu.be/jsMfqaUqGLk

Joonis1. Süsiniku allotroobid teemant ja grafiit. Allikas: https://commons.wikimedia.org/wiki/File:Diamond_and_graphite2.jpg
Süsinikul on kaks elektronkihti ning väliskihil on kokku neli elektroni, mis saavad moodustada keemilisi sidemeid. Süsiniku on C Z=6|1s22s22p2. Keemilise sideme moodustamisel saab süsinik loovutada või liita neli elektroni. Enamikus reaktsioonides on süsinik tüüpiline ehk loovutab viimase kihi elektrone. Enamiku ainetega reageerib süsinik kõrgemal temperatuuril. Joonisel 2 on toodud tähtsamad süsinikuühendid, mis tekivad teiste lihtainetega regeerimisel.
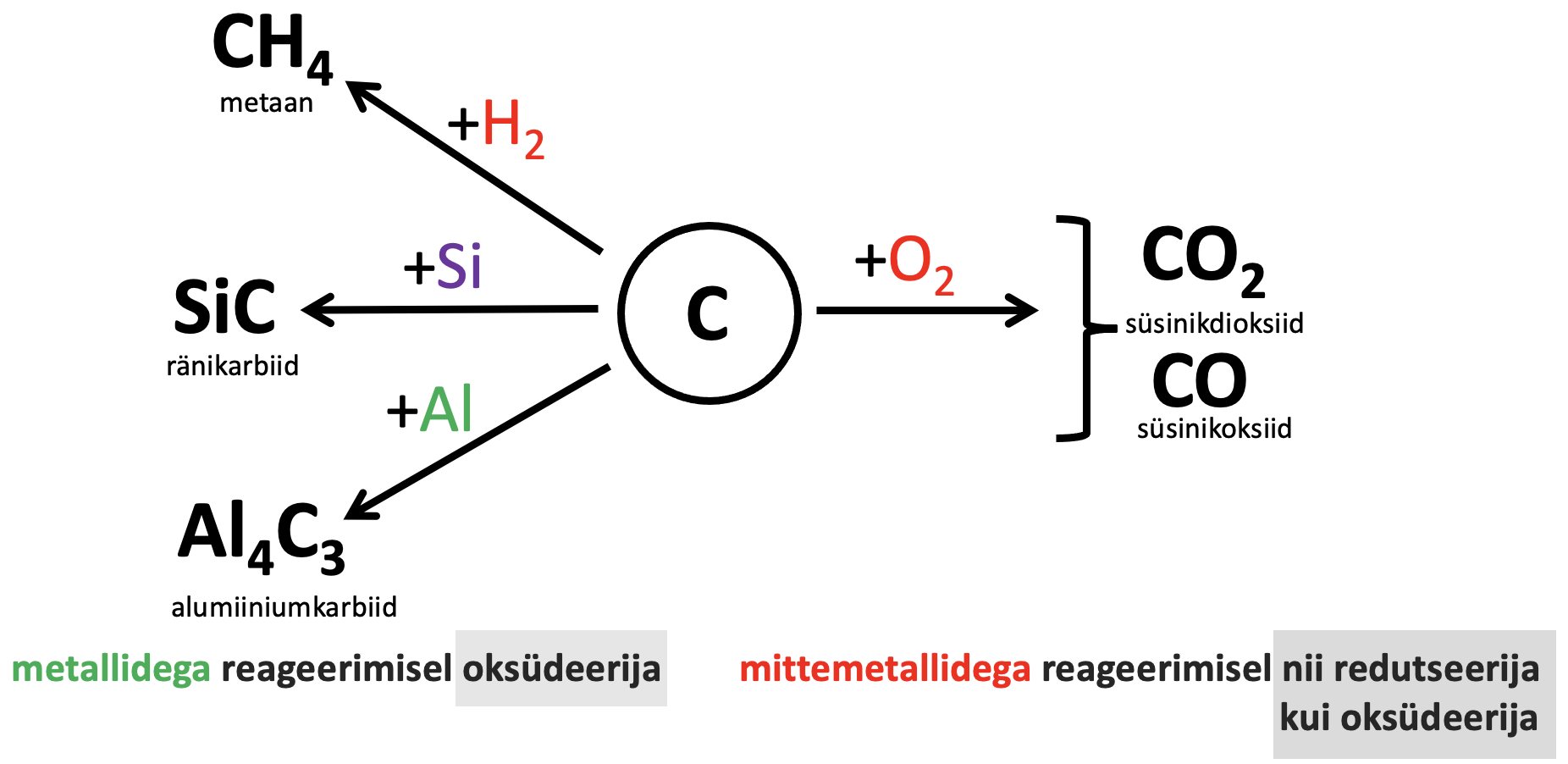
Joonis 2. Süsiniku keemilised omadused
 Vaata ka metallide saamise peatükki.
Vaata ka metallide saamise peatükki.
Süsinikku kasutatakse metallide tootmisprotsessis redutseerijana.
Fe3O4 + 2C $\xrightarrow[]{temp}$ 3Fe + 2CO2
2ZnO + C $\xrightarrow[]{temp}$ 2Zn + CO2
MnO2 + C $\xrightarrow[]{temp}$ Mn + CO2
Vaatame ka tähtsamaid süsinikuühendeid.
Metaan
Metaan on loodusliku gaasi põhikoostisaine. Metaan (CH4) põleb kõrgel temperatuuril.
CH4 + 2O2 $\xrightarrow[]{temp}$ CO2 + 2H2O ΔH= -890 kJ/mol
See on eksotermiline reaktsioon ja vabaneb palju energiat. Tänu suurele soojusefektile kasutatakse metaani kütusena.
Süsinikoksiid
Allikas: https://youtu.be/qDae-Iay4Oo
CO on lõhnatu ja väga mürgine.
CO – süsinikoksiid (vingugaas) on värvusetu, õhust veidi raskem gaas. CO on lõhnatu ja väga mürgine. Vingugaas tekib mittetäielikul põlemisel
2C + O2 → 2CO
Sissehingamisel seob CO vere hemoglobiini püsivaks ühendiks, põhjustades seega kudede hapnikunälja. CO 0,1%-line sisaldus õhus on inimesele surmav sissehingamisel 20 minuti jooksul. Linnades on CO üks õhusaaste põhikomponente.
CO ei reageeri vee, aluste ega hapetega. CO kasutatakse metallide tootmisel tugeva redutseerijana (vaata ka metallide saamise peatükki 4.6).
Süsinikdioksiid
CO2 – süsinikdioksiid on gaasiline aine, värvusetu, kergelt happelise maitsega ning õhust 1,5 korda raskem. Toatemperatuuril ja kõrgel rõhul läheb süsinikdioksiid üle värvusetuks vedelikuks, mille järsul jahutamisel tekib tahke CO2, mida nimetatakse „kuivaks jääks“ (joonis 3). Keemiliselt ja termiliselt on CO2 väga stabiiline ning vastupidav, seetõttu saab seda kasutada tulekustutites.

Joonis 3. Tahke CO2 tüki lisamisel vette CO2 aurustub ja ka lahustub vees. Allikas: https://commons.wikimedia.org/w/index.php?title=File%3ASublimation_of_dry_ice_on_water.small.ogv
 Vaata happeliste oksiidide omadusi.
Vaata happeliste oksiidide omadusi.
CO2 on (vaata happeliste oksiidide omadusi peatükist 1.1), mis vees lahustub ning reageerib osaliselt veega, andes süsihappe:
CO2 + H2O ⇆ H2CO3.
CO2 reageerib nii aluste kui ka aluseliste oksiididega:
СO2 + Ca(OH)2 → CaCO3 + H2O
CO2 + CaO → CaCO3
CO2 kasutatakse toiduainete tööstuses säilitusainena ja jookide karboniseerimisel.
Süsinikdioksiidi saadakse karbonaatide lagundamisel või karbonaatidele happe lisamisel:
CaCO3(t) $\xrightarrow[]{temp}$ CaO(t) + CO2↑(g)
CaCO3(t) + HCl(l) → CaCl2(l) + H2O(v) + CO2(g)↑.
CO2 tekib ka käärimise käigus: C6H12O6 → 2CO2 + 2C2H5OH.
Süsihape ja tema soolad
Süsihape on ebapüsiv , mis vesilahuses osaliselt dissotsieerub (peamiselt I astmes).
H2CO3 ⇆ H+ + HCO3–
HCO3– ⇆ H+ + CO32-
Süsihape reageerib aluste ja aluseliste oksiididega (vaata hapete omadus 1.2). Reaktsioonis alustega toimub astmeline neutralisatsioon ja tekivad karbonaadid.
H2CO3 + NaOH ⇆ NaHCO3 + H2O
naatriumvesinikarbonaat ehk söögisooda
H2CO3 + 2NaOH ⇆ Na2CO3 + 2H2O
naatriumkarbonaat ehk pesusooda
H2CO3 + Na2O ⇆ Na2CO3 + H2O
Aktiivsete metallide karbonaadid lahustuvad vees ja reageerivad teiste sooladega, kui tekib sade.
СaCl2+ Na2CO3 → CaCO3↓+ 2NaCl
Leelismetallide karbonaadid kuumutamisel sulavad ega lagune. Teised karbonaadid lagunevad oksiidiks ja süsinikdioksiidiks.
CaCO3 $\xrightarrow[]{temp}$ CaO + CO2
BaCO3 $\xrightarrow[]{temp}$ BaO + CO2
1.6. Mitu mooli CO2 eraldub 120 g CaCO3 mittetäielikul lagunemisel? 35% CaCO3 ei lagune. Vastus anna kaks kohta peale koma.
Vastus: Eraldub 0,78 mol CO2
Lahendus: kirjutame CaCO3 lagunemise võrrandi:
CaCO3 → CaO + CO2
CaCO3 mass on 120 g, kuid sellest 35% ei lagune. Seega laguneb 65% ehk 0,65×120 g = 78 g. Arvestades, et M(CaCO3) = 100 g/mol, leiame selle moolide arvu:
$n(CaCO_3) = {m \over M}= {78g \over 100g/mol}=0.78mol$


