
4.8. Metallide keemilised omadused
Metallid on tüüpilised redutseerijad keemilistes reaktsioonides ning loovutavad alati redoksreaktsioonide käigus elektrone. Seda näed igapäevaelus sellest, et metalli pind tuhmub kergesti ehk korrodeerub. Metallide üldisemaid keemilisi omadusi saad vaadata järgmisest videost.
Allikas: https://youtu.be/xLBQO2PDpoM
Metallide redoksomadused
Metallidele on iseloomulik loovutada elektrone, kuna tuumalaengu mõju on nõrk tänu metalli aatomi suurtele mõõtmetele. Väliskihi elektrone ei hoita tugevalt kinni ning need loovutatakse kergesti. Metallid on keemilistes reaktsioonides seega tüüpilised redutseerijad. Redutseerijad on ained, milles aineosakesed loovutavad elektrone. Näiteks alumiiniumi reageerimisel joodiga tekib alumiiniumjodiid: 2Al + 3I2 → 2AlI3.

Joonis 1. Alumiiniumi reaktsioon joodiga katalüsaatori juuresolekul. Tekib alumiiniumjodiid: 2Al+3I2→2All3
Jood sublimeerub, ehk muutub tahkest otse gaasiliseks ning on näha tekkinud lillakat joodiauru.
Reaktsioon on väga eksotermiline, st reaktsiooni käigus vabaneb palju energiat, mille tulemusena ka üks läheteaine, jood (I2), osaliselt sublimeerub. on aine üleminek tahkest olekust gaasilisse ilma vahepealse vedela oleku tekkimiseta. Jooniselt 1 on näha lillakad joodiaurud. Selle reaktsiooni käigus metalli aatomid loovutavad elektrone ning mittemetalli (I2) molekulid seovad elektrone.
Al – 3e– → Al3+ on
I2 + 2e– → 2I– on
Elektroni loovutamisel tekib metalli ja metalli kasvab, elektroni liitmisel tekib mittemetallist ja oksüdatsiooniaste kahaneb.
Metallide reaktsioonid mittemetallidega
Enamik metalle reageerib mittemetallidega kõrgemal temperatuuril. Reaktsiooni saab kiirendada ka sobiva katalüsaatori valimisel. Metallide reaktsioonid mittemetallidega leiad tabelist 1.
Tabel 1. Metallide reaktsioonid mittemetalidega
|
METALL |
+ HAPNIK |
→ OKSIID |
4 Fe + 3 O2 $\xrightarrow{temp}$ 2 Fe2O3 raud(III)oksiid 2 Cu + O2 $\xrightarrow{temp}$ 2 CuO vask(II)oksiid 4 Na + O2 $\xrightarrow{temp}$2 Na2O naatriumoksiid (2 Na + O2 $\xrightarrow{temp}$ Na2O2) naatriumperoksiid 2 Zn + O2 $\xrightarrow{temp}$ 2 ZnO tsinkoksiid 4 Al + 3O2 $\xrightarrow{temp}$ 2 Al2O3 alumiiniumoksiid |
|
+ VÄÄVEL |
→ SOOL |
2 Na + S $\xrightarrow{temp}$ Na2S naatriumsulfiid |
|
|
+ HALOGEEN CI2, F2, Br2 jne |
→ SOOL |
2 K + Cl2$\xrightarrow{temp}$ 2 KCl kaalimkloriid 2 Na + Br2 $\xrightarrow{temp}$ 2 NaBr naatriumbromiid Ca + F2 $\xrightarrow{temp}$ CaF2 kaltsiumfluoriid |
|
|
+ H2 VESINIK |
→ hüdriidid |
2 Na + H2 $\xrightarrow{temp}$ 2 NaH naatriumhüdriid |
|
|
+ N2 LÄMMASTIK |
→ nitriidid |
3 Ca + N2 $\xrightarrow{temp}$ Ca3N2 kaltsiumnitriid |
|
|
+ P FOSFOR |
→ fosfiidid |
3 Ca + 2 P $\xrightarrow{temp}$ Ca3P2 kaltsiumfosfiid 3 Mg + 2 P $\xrightarrow{temp}$ Mg3P2 magneesiumfosfiid |
|
|
+ C SÜSINIK |
→ karbiidid |
Ca + 2 C $\xrightarrow{temp}$ CaC2 kaltsiumkarbiid Si + C $\xrightarrow{temp}$ SiC ränikarbiid |
Metallide reaktsioonid hapete lahjade vesilahustega
Metallide reaktsioonide kirjutamisel lahjendatud hapete lahustega kasuta :

Metallide reageerimisel happe lahusega on oksüdeerijaks happe vesinikioonid
Metallid, mis asuvad metallide pingereas vesinikust vasakul, reageerivad lahjendatud hapete vesilahustega ning reaktsiooni tulemusena tekivad sool ja vesinik. Erandiks on lahjendatud lämmastikhappelahus, millest tuleb juttu hiljem.
METALL + HAPPE LAHJENDATUD → SOOL + VESINIK
Zn(t) + 2 HCl(lahjendatud) → ZnCl2(l)+ H2(g)

Mg(t) + 2 HCl(lahj) → MgCl2(l) + H2(g)
Fe(t) + 2 HCl(lahj) → FeCl2(l) + H2(g)
2 Al(t) + 6 HCl(lahj) → 2 AlCl3(l) + 3 H2(g)
Eriti aktiivselt eraldub vesinikku magneesiumi reageerimisel. Järgneva nelja video põhjal saad näha, kui aktiivselt reageerib metall lahjendatud happelahusega. Aktiivsema metalli (Mg) reaktsioonil happelahusega eralduvad intensiivselt vesinikumullid. Kõige aeglasemalt toimub raua (Fe) reatsioon happelahusega.
 |
 |
|
Magneesiumi reageerimine soolhappe lahusega:
|
Alumiiniumi reageerimine soolhappe lahusega:
|
|
 |
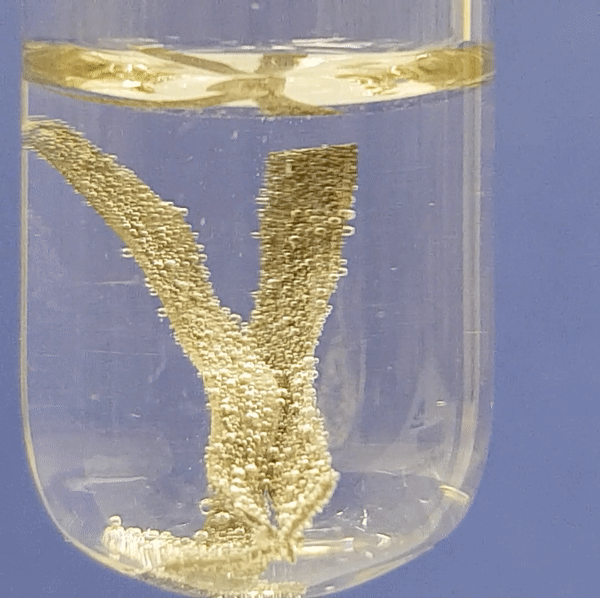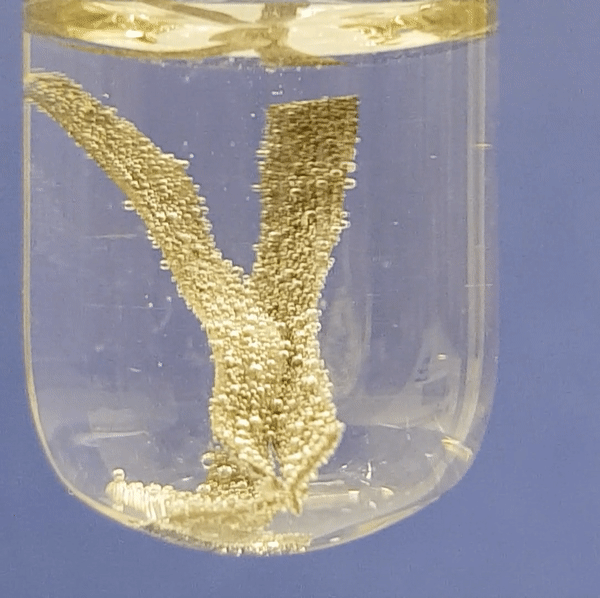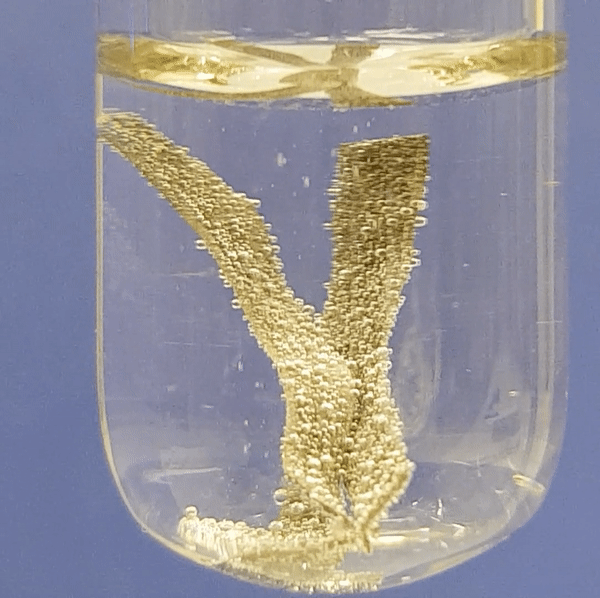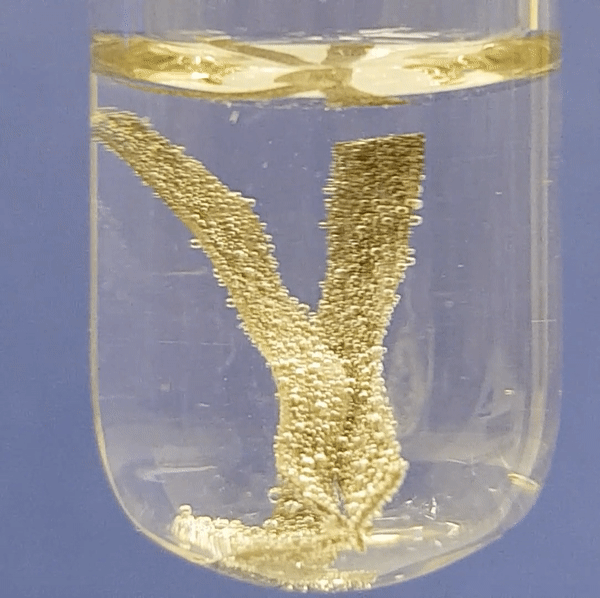 |
|
Tsingi reageerimine soolhappe lahusega:
|
|
Raua reageerimine soolhappe lahusega:
|
Joonis 2. Metallide reageerimine soolhappe lahusega
Reaktsioonide kirjutamisel tuleb lahustuvustabelist vaadata tekkiva soola lahustuvust. Kui metalli pinnale tekib mittelahustuva soola kiht, siis võib metalli ja lahjendatud happelahuse vaheline reaktsioon lakata või pole soolakihi kiire tekkimise tõttu reaktsioon üldse märgatav. Seda võib näha näiteks kaltsiumi reageerimisel lahja väävelhappelahusega.
Ca + H2SO4(lahj)→ CaSO4↓+H2
Metallid, mis asuvad pingereas vesinikust paremal, lahjade happelahusega ei reageeri.
Kaltsiumi pind kattub rasklahustuva kaltsiumsulfaadi tiheda kihiga, mis takistab metalli edasist kokkupuudet happelahusega ja reaktsioon vaibub. Katsete läbiviimisel oleks mõistlik metallid ka oksiidikihist puhastada.
Metallid, mis asuvad pingereast vesinikust paremal, lahjade happelahustega ei reageeri.
Cu + HCl(lahj) → ei toimu
Metallide reaktsioonid lämmastikhappelahusega
Lahja HNO3-lahuse reageerimisel metallidega ei eraldu vesinikku.
Lämmastikhape on väga tugev oksüdeerija. Kontsentreeritud HNO3 on tugevam oksüdeerija kui H2SO4. Lahjendatud HNO3-s (erinevalt H2SO4-st) on oksüdeerijaks NO3– -ioonid, mitte H+-ioonid. Seetõttu ka lahja HNO3-lahuse reageerimisel metallidega ei eraldu vesinikku. Sõltuvalt happe kontsentratsioonist, metalli aktiivsusest ning temperatuurist on saadused erinevad.
METALL + LÄMMASTIKHAPE → SOOL + VESI + LÄMMASTIKUÜHEND
tsink + lämmastikhape → tsink(II)nitraat + lämmastikdioksiid + vesi
Zn + 4 HNO3(konts) → Zn(NO3)2 + 2 NO2↑ + 2H2O
tsink + lämmastikhape → tsink(II)nitraat + lämmastikoksiid + vesi
3 Zn + 8 HNO3(lahj)→ 3 Zn(NO3)2 + 2 NO↑ + 4 H2O
Lämmastikhappe vesilahusega reageerivad ka vähemaktiivsed metallid Cu, Hg, Ag.
Metalli reageerimisel lämmastikhappe lahusega võib tekkida veel teisi lämmastikühendeid. Koolikeemias seda teemat laiemalt ei käsitleta, aga huvi korral võid lisaks lugeda siit
 Loe lisaks: Metallide reaktsioonid lämmastikhappelahusega.
Loe lisaks: Metallide reaktsioonid lämmastikhappelahusega.
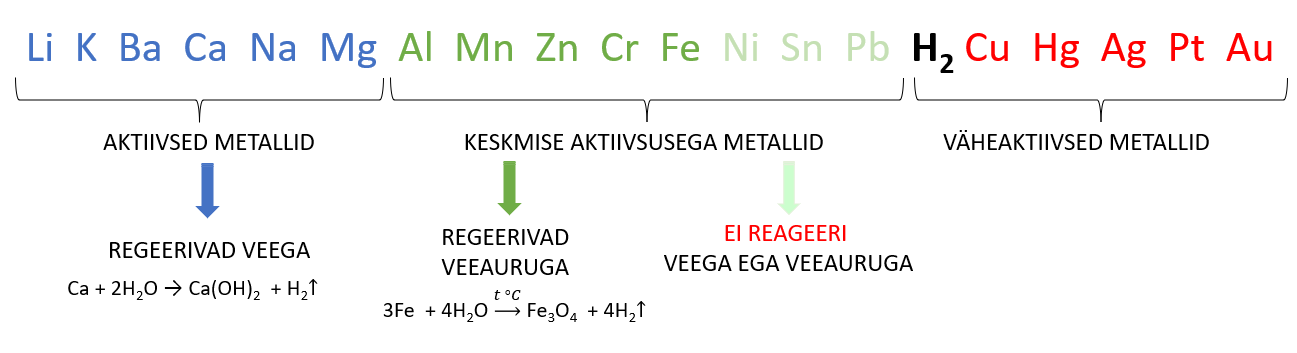
Metallide reaktsioonid vee ja veeauruga
Metallide reageerimine veega sõltub metalli aktiivsusest. Taas on reaktsioonide kirjutamisel abiks metallide pingerida. Eristada saab kolme tüüpi reaktsioone.
- AKTIIVNE METALL + VESI → HÜDROKSIID + VESINIK
- KESKMISE AKTIIVSUSEGA METALL + VEEAUR → OKSIID + VESINIK
- VÄHEAKTIIVSED METALLID EI REAGEERI EI VEE EGA VEEAURUGA
Metallid alates alumiiniumist ei reageeri veega tavatingimustel (st toatemperatuuril). Põhjuseks on tihe oksiidikiht metalli pinnal. Kui oksiidikihti metalli pinnal ei oleks, siis reaktsioon toimuks, mistõttu ei ole võimalik Al toota soolalahuse elektrolüüsil. Veega reageerib alumiinium temperatuuril üle 180 °C:
2 Al + 6 H2O → 2 Al(OH)3 + 3 H2 (tekkida võib ka oksiidi ja hüdroksiidi segu).
Aktiivse metalli reageerimisel veega eraldub vesinik ja tekib leelise lahus.
Aktiivsed metallid Li, Rb, K, Cs, Ba, Sr, Ca, Na, Mg regeerivad veega. Redutseerijaks on metall ja oksüdeerijaks on vesi. Veest eraldub leelismetallide toimel vesinik. Alates kaaliumist toimub reaktsioon nii tormiliselt, et tekkinud leelismetall ja vesinik süttivad.
2 Li(t) + 2 H2O(v) → 2 LiOH(l) + H2(g)
2 Rb(t) + 2 H2O(v) → 2 RbOH(l) + H2(g) (süttib põlema)
Ba(t) + 2 H2O(v) → Ba(OH)2(l) + H2(g) (energiline reaktsioon)


Joonis 3. Na ja Ca reaktsioon veega
Allolevalt videolt näed, et Mg-tüki ümber on tekkinud vees aluseline keskkond, sest fenoolftaleiin () on värvunud roosaks. Vesinikumullide eraldumine intensiivistub vähesel kuumutamisel. Toatemperatuuril Mg reaktsioon veega praktiliselt ei toimu.
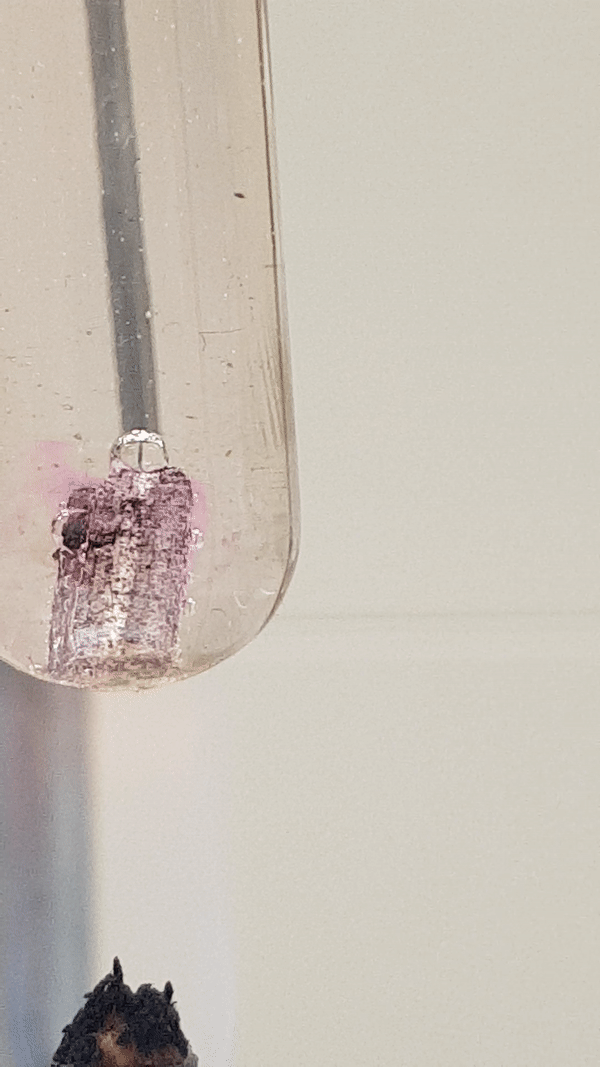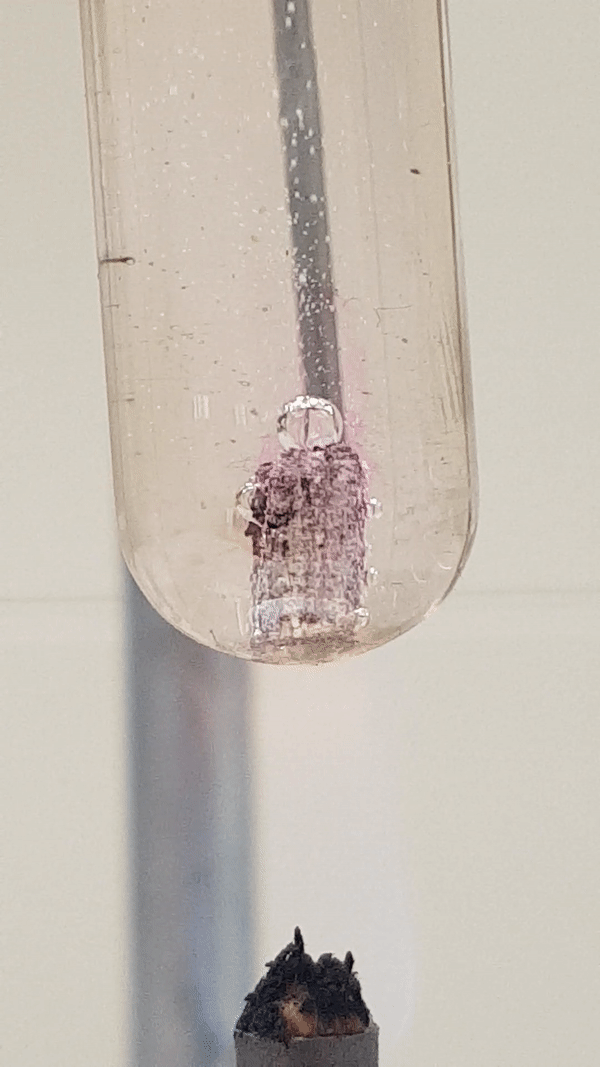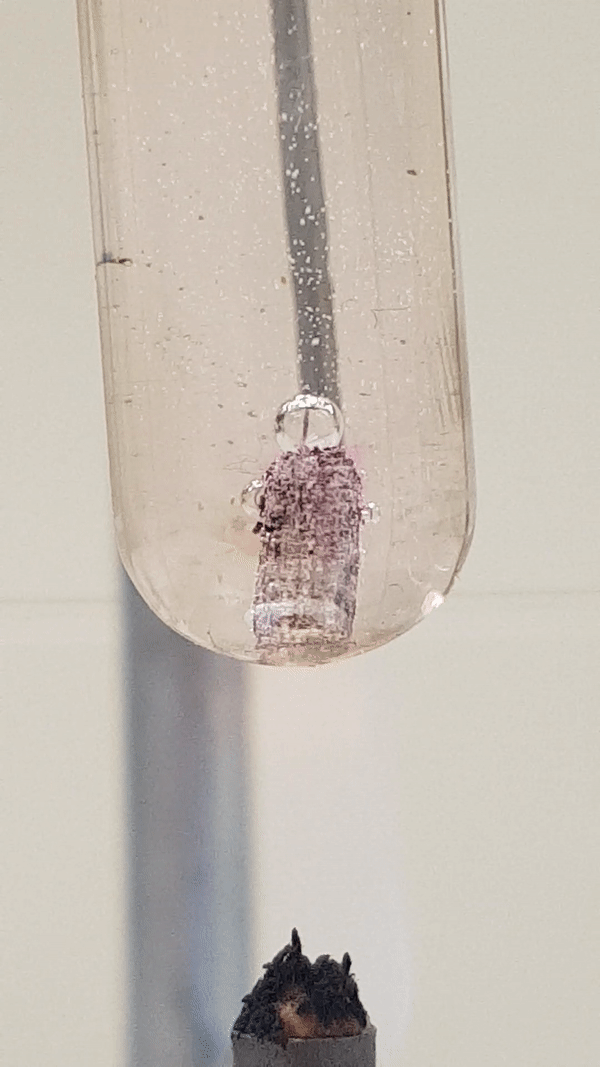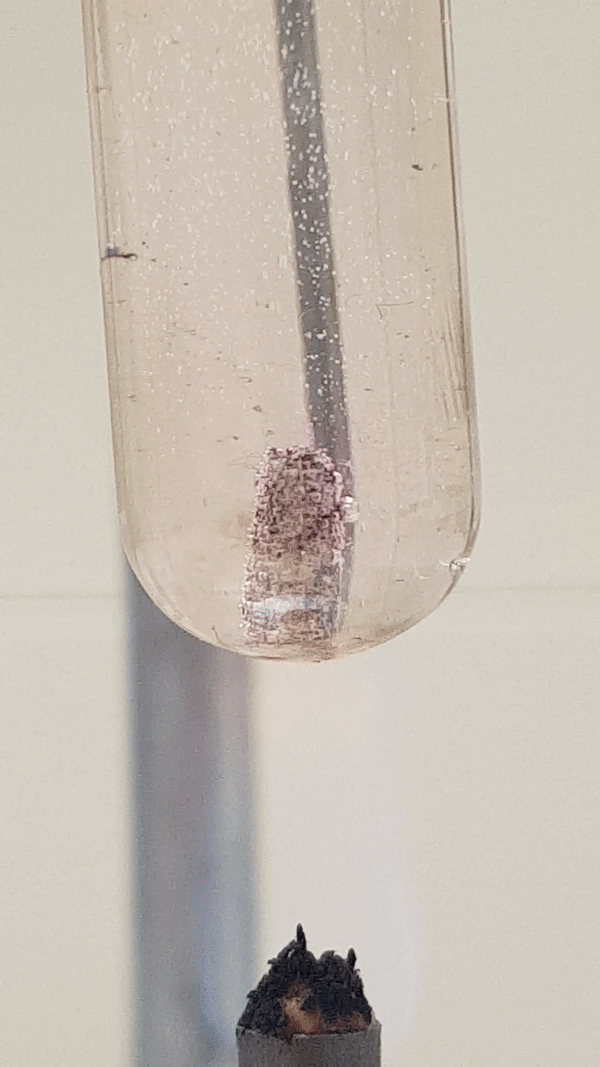
Joonis 4. Mg reaktsioon veega (lisatud on indikaatorit fenoolftaleiini). Vähesel kuumutamisel tekib magneesiumhüdroksiid ja eraldub vesinik. Reaktsiooni tunnusena näed, et aluse tekkimisel värvub lahus indikaatori tõttu roosaks, lisaks näed gaasi eraldumist. Mg(t) + 2 H2O(v) → Mg(OH)2(l) + H2(g)
Metallide reaktsioonid soolade vesilahustega
Üldreegel on, et metalli reageerimisel soolalahusega tõrjub aktiivsem metall välja vähem aktiivse metalli.
Metallide sukeldamisel soolade vesilahustesse võib toimuda väga palju erinevaid protsesse. Sageli toimuvad paralleelreaktsioonid. Reaktsioonid võivad olla mõjutatud nii metalli aktiivsusest kui ka soolalahuse happesusest. Kui soovitakse viia läbi reaktsioon, kus aktiivsem metall tõrjub vähem aktiivse metalli soolalahusest välja, tuleb järgida järgmisi reegleid:
- aktiivsem metall ei reageeri soola lahuses veega;
- reageeriv sool peab lahustuma vees;
- lähtemetall peab olema aktiivsem kui väljatõrjutav metall.
Kui on jälgitud eelnimetatud reegleid, siis saame kirjutada reaktsioonivõrrandeid järgneva skeemi alusel:
METALL + SOOL → UUS SOOL + UUS METALL
Fe(t) + CuSO4(l) → Cu(t) + FeSO4(l)
Reaktsiooni saame kirjutada ioonvõrrandina:

Kuna raud on pigereas eespool, saab raud välja tõrjuda metallilise vase vasesoola lahusest.
Nende reaktsioonide kirjutamisel on jällegi abiks metallide pingerida.

Joonis 5. Videost näed, et raudplaadile tilgutatakse sinakat vask(II)sulfaadi lahust. Toimub reaktsioon ja on näha, et hallika raudplaadi pinnale tekib punakat värvi vasekiht.
 Loe lisaks: Amfoteersete metallide reaktsioonid leelistega.
Loe lisaks: Amfoteersete metallide reaktsioonid leelistega.
.


