
4.3. Mis on metall?
moodustavad enam kui kolmveerandi keemilistest elementidest. Metalliliste elementide paigutust perioodilisussüsteemis kajastab hästi tabeli poolpikk variant elementidest: jooniselt 1 on näha, et metallid jäävad tabeli vasakusse poolde ning neid liigitatakse järgmiselt: , ning d-metallid (). Ka , mis kirjeldab aatomi elektronstruktuuri ning näitab elektronide jaotumist kihtidesse, viitab otseselt sellele, millise metalliga on tegu: s-, p- või d-metalliga. Nt kui elektronvalem lõpeb s-tähega, siis on tegemist s-metalliga.
on lihtaine, milles esineb ja millel on seetõttu nn metallilised omadused (hea elektri- ja soojusjuhtivus, iseloomulik läige jne). Metalliaatomite väliselektronkihis on üldjuhul vähe elektrone. Need elektronid asuvad tuumast kaugemal, võrreldes mittemetallidega (vaata joonist 1), mistõttu need loovutatakse lihtsalt ühendite moodustamisel. Väliskihi elektronide loovutamine on seda lihtsam, mida kaugemal elektronid tuuma mõjusfäärist asuvad. Metallide tuumalaengu mõju pole neile kuigi tugev.
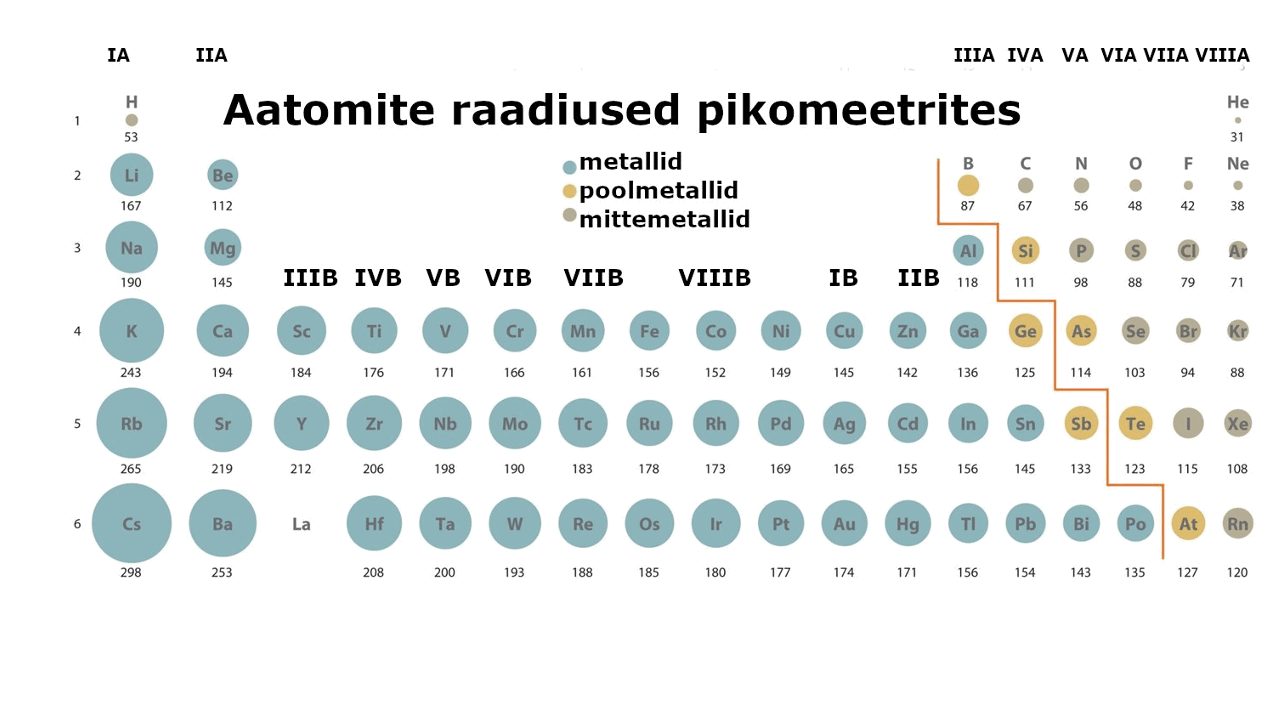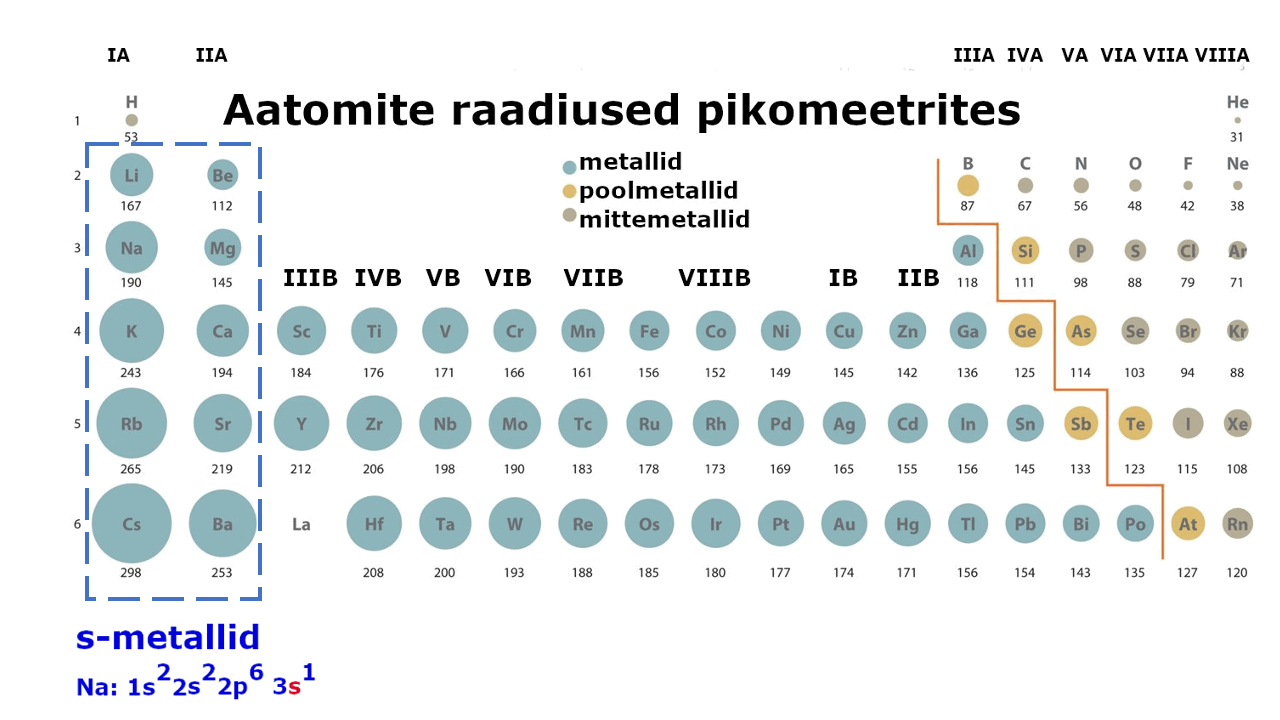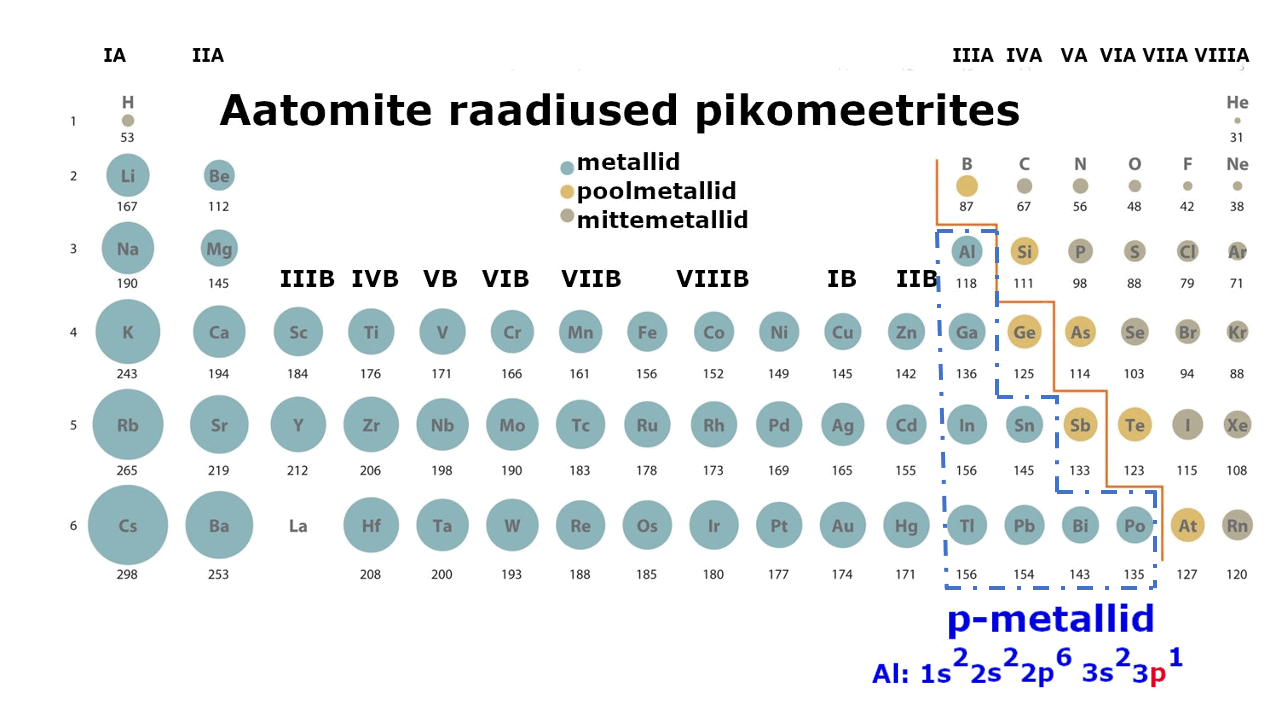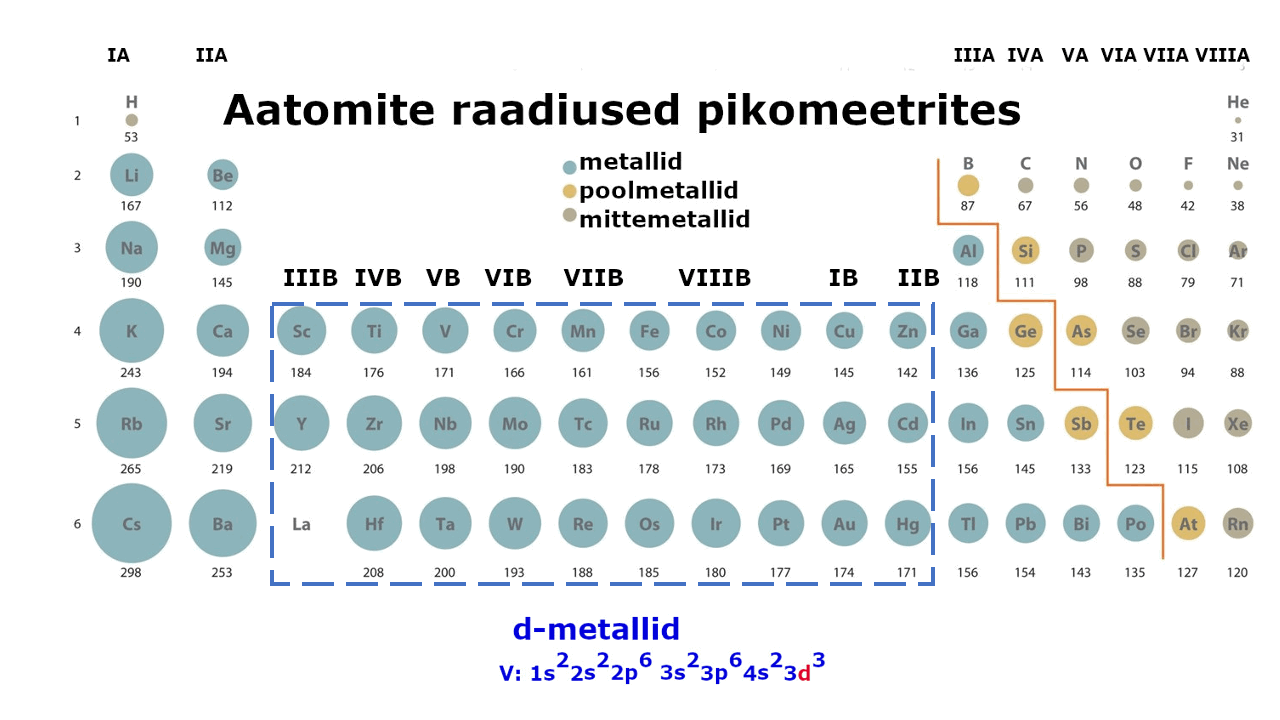
Joonis 1. Aatomite raadiuste muutus perioodilisustabelis ja s-, p-, d-metallid
Eriti lihtsalt loovutavad väliskihist elektrone I A rühma metallid ehk . Paljud reaktsioonid leelismetallide osavõtul toimuvad kergesti, võib isegi öelda, et tormiliselt. Näiteks reageerivad nad kergesti õhus oleva õhuhapnikuga (O2), kaotades silmnähtavalt metallidele omase läike (vaata videot Na pinna oksüdeerumise kohta).
Reaktsioonil veega leelismetallid (eriti Na, K, Rb, Cs) süttivad põlema.

Joonis 2. Kaaliumi lõikamisel näeme, et kaaliumi läikiv pind oksüdeerub kiiresti õhuhapnikuga ning tuhmub (pinnale tekib perroskiidide kiht, KO2). Teiseks on toodud kaaliumi reaktsioon veega, mille tulemusena tekib kaaliumhüdroksiid. Näha on ka gaasilise aine, vesiniku eraldumist. Reaktsioonivõrrand 2 K + 2 H2O → 2 KOH + H2↑.
Metallide aktiivsus suureneb rühmas ülevalt alla ning perioodis paremalt vasakule. Kõige metallilisem element on tseesium (Cs).
Metalliline side
Metallilised omadused on seotud aatomite võimega loovutada väliskihi elektrone. Metalli kristallvõres asuvad aatomid üksteisele nii lähedal, et osaliselt kattuvad aatomite elektronorbitaalid, kus väliskihielektronid asuvad. Nõrgalt seotud väliskihi elektronid saavad väga kergesti liikuda ühe tuuma mõjualast teise tuuma mõjualasse. See toimub üle kogu metallikristalli. Sel viisil tekib metallides eriline side, mida nimetatakse metalliliseks sidemeks. Väga lihtsustatud mudel metallilise sideme kirjeldamiseks pakuti välja 20. sajandi algul ning see kandis nime “elektrongaasi mudel”. Selle mudeli kohaselt asuvad metalli sõlmpunktides üksteise kõrval metalli katioonid. Katioone hoiavad koos nende vahel kiiresti liikuvad elektronid, mis takistavad katioonide tõukumist. Tänapäeva teadus on aga näidanud seda, et selline mudel pole päris korrektne. Näiteks ei selgita mudel metallide elektrijuhtivuse vähenemist temperatuuri tõstmisel – elektrongaasi mudeli teooriast järelduks vastupidine sõltuvus.
Metalli kristallivõre sõlmpunktides on metalli aatomid, mis saavad üksteisega väliskihi elektrone vahetada (vaata joonist 3). Puhtal kujul avaldub metalliline side vaid leelis- ja leelismuldmetallide korral, kus väliskihielektronid on ühistatud. Neile on iseloomulik väga suur plastilisus, pehmus (eriti leelismetallidel), madalad sulamis- ja keemistemperatuurid. Side nõrgeneb aatomiraadiuse kasvamisel (rühmas ülevalt alla), keemis- ja sulamistemperatuur vähenevad.

Joonis 3. Metalliline side
Metallidel on rida iseloomulikke ühiseid omadusi, mis tulenevad metallilisest sidemest:
- head soojus- ja elektrijuhid;
- tavatingimustel kristalsed ained (v.a Hg);
- plastilised, sepistatavad, metalse läikega, hea peegeldusvõimega.
Nende kohta saad lugeda järgnevatest peatükkidest.


