
3.5. Lahustuvus ja lahuse kontsentratsioon
Millest sõltub ainete lahustumine vees ning kuidas teha arvutusi võttes arvesse aine lahustumist, saad vaadata järgnevast videost.
Allikas: https://youtu.be/qX48GTpOo-A
on , milles antud temperatuuril ainet enam ei lahustu.
Kui lisada lahustisse järjest enam lahustuvat ainet, siis ühel hetkel aine enam ei lahustu ja enamikel juhtudel sadeneb välja. Kui osa lahustatavast ainest ei lahustu, siis nimetatakse saadud lahust . Küllastunud lahuses on kontsentratsioon maksimaalne ja rohkem ainet enam sellel temperatuuril ei lahustu.
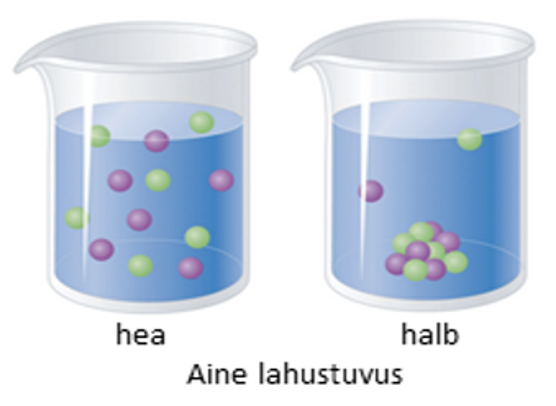
Joonis 1. Kui aine lahustub hästi ehk selle on suur, siis seonduvad kõik aineosakesed veega ja tahket ainet lahusesse ei jää (vasakul). Kui aine ei lahustu hästi (paremal), siis on veega seonduvaid aineosakesi vähe ja osa ainest sadeneb lahusest välja. Allikas: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/section_08/7e54d0c43e9597309aa9ecfdafbc69bb.jpg
Kui temperatuuri tõsta, siis nihkub protsessi tasakaal alati endotermilise protsessi suunas (Le Chȃtelier’ printsiip).
Enamiku soolade lahustumine on endotermiline protsess, järelikult temperatuuri tõstmisel nende lahustuvus suureneb. Mida suurem on endotermilise protsessi soojusefekt, seda rohkem mõjutab temperatuurimuutus lahustuvust.
Allolevalt graafikult on näha, et NaCl lahustuvus sõltub väga vähesel määral temperatuurist. Järelikult on NaCl lahustumise soojusefekt väga väike.
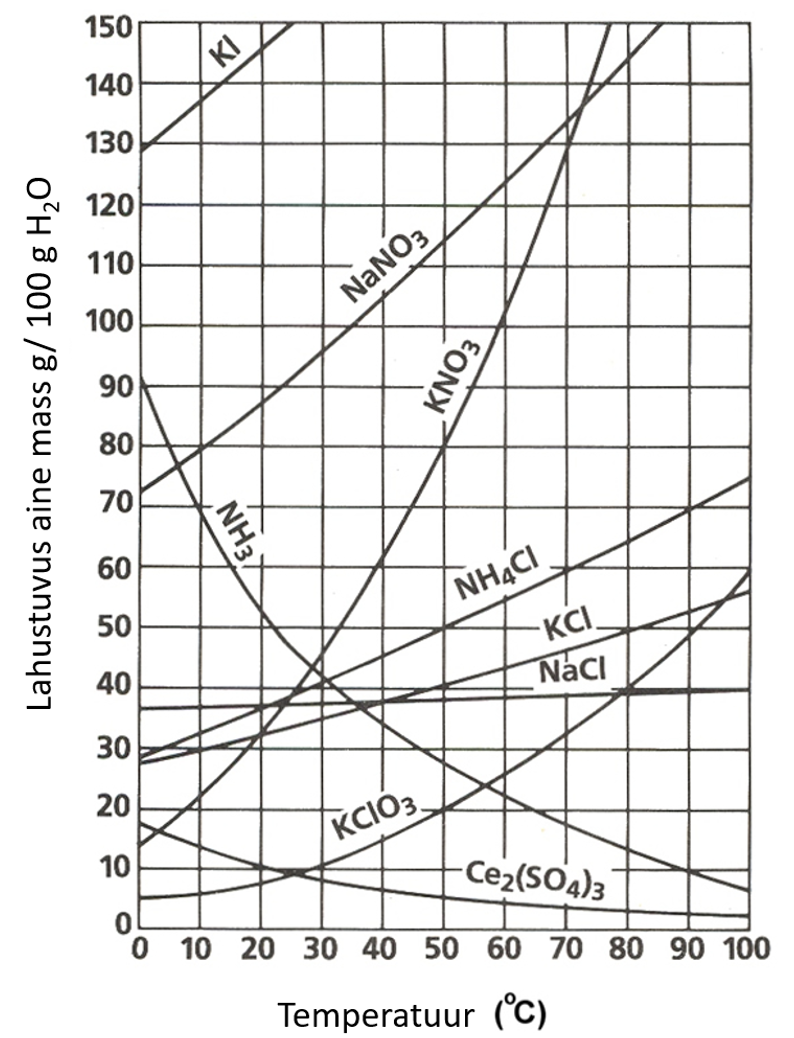
joonis 2. Soolade ja ammoniaagi lahustuvuse sõltuvus temperatuurist. Allikas: 3.1 Solubility Curves – Chemistry LibreTexts
Gaaside lahustumine on eksotermiline protsess ja temperatuuri tõstes gaaside lahustumine väheneb.
Gaaside lahustumisel pole vaja esialgseid osakestevahelisi sidemeid lõhkuda, kuna gaasid koosnevad vabalt liikuvatest molekulidest. Gaaside lahustuvus on üldjuhul üsna väike ja gaasimolekulid hüdraatuvad lahustumisel vähesel määral, seega on gaaside lahustumine vähesel määral eksotemiline protsess: kui temperatuur tõsta, siis protsess nihkub gaasi eraldumise suunas.
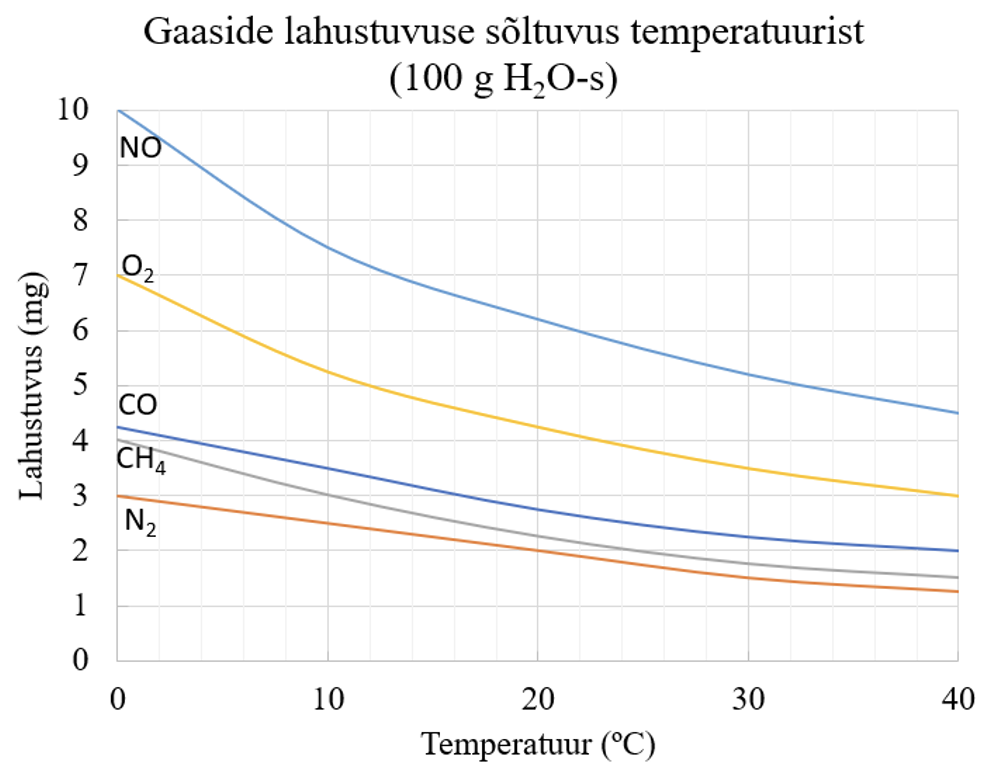
Joonis 3. Erinevate gaaside lahustuvuse sõltuvus temperatuurist
1.4. 80 g naatriumnitraati
Vastus: 55 g
Lahendus: Temperatuuril 70 °C on naatriumnitraadi lahustuvus 135 g. Seega saab juurde lisada 135 g – 80 g = 55 g.
1.5.
Vastus: 33%
Lahendus: Temperatuuril 80 °C on KCl lahustuvus 50 g / 100 g vees. Lahuse kogumass on seega vee mass + KCl mass ehk 100g + 50 g = 150 g. KCl on seega:
P(KCl) = 50 g / 150 g * 100 = 33%
1.6.
Vastus: 12%
Lahendus: Temperatuuril 80 °C on NH4Cl lahustuvus 70 g/100 g vees. Lahuse kogumass on seega 70 g + 100 g = 170 g ja NH4Cl massiprotsent on 70 g / 170 g × 100% = 41 %.
Temperatuuril 30 °C on NH4Cl lahustuvus aga 40 g/100 g vees. Lahuse kogumass on seega 40 g + 100 g = 140 g ja NH4Cl massiprotsent on 40 g / 140 g × 100% = 29 %.
Seega langeb massiprotsent 41% – 29% = 12% võrra.
Lahustuvus
Lahustuvus on aine suurim mass grammides, mida antud temperatuuril saab lahustada kindlas koguses, tavaliselt 100 g vees.
$Lahustuvus = \frac{lahustunud\ aine\ mass\ (g)}{100\ g\ lahustit\ (H_{2}O)} \times 100%$
Näidisülesanne 1
Tuuli tegi tassi suhkrulahust, selleks võttis ta tassitäie vett ehk 200 grammi vett ja lahustas selles supilusikatäie (25 g) suhkrut.
$Lahuse\hspace{0.2cm}massiprotsent = \frac{25\ g\ suhkrut}{200\ g\ vett + 25\ g\ suhkrut} \times 100%$ $= 11 $%
Tuuli jõi seega 11% suhkrulahust.
Kui suhkru lahustuvus puhtas vees temperatuuril 20 °C on 204 g suhkrut 100 grammi vee kohta, siis mitu grammi suhkrut peaks Tuuli veel lisama valmistatud suhkrulahusele, et ta saaks küllastunud suhkrulahuse?
204 g suhkrut oleks 100 g vees küllastunud lahuse korral.
m grammi suhkrut oleks 200 g vees küllastunud lahusese korral.
$m(suhkur)=\frac{200\hspace{0.1cm}g\hspace{0.1cm}\times \hspace{0.1cm}204\hspace{0.1cm}g}{100\hspace{0.1cm}g}=408\hspace{0.1cm}g$
Kuna klaasi oli lisatud juba 25 g suhkrut, siis juurde peaks lisama 408 g – 25 g = 383 g suhkrut.
Suhkru edasisel lisamisel lahusesse näeksime suhkru väljasadenemist.
2.1.
Vastus: ei ole küllastunud
Lahendus: Mari lahus koosneb 50 g glükoosist ja 200 ml veest. Glükoosi lahustuvus on 909 g ühes liitris vees, siis 200 ml ehk 0,2 liitris lahustub glükoosimaksimaalselt 909 g ×0,2 = 182 grammi. Kuna Mari lahuses on vaid 50 g glükoosi 200 ml-s, siis ei ole lahus küllastunud.
2.2.
Vastus: 20%
Kuna vee tihedus on 1 g/ml, siis 200 ml lahuse mass on 200 g. Lahuse kogumass on 50 g glükoosi + 200 g vett ehk 250 grammi. Glükoosi massiprotsent:
$P(glükoos) = {50\hspace{0.1cm}g\over 250\hspace{0.1cm}g}*100=20$%
2.3.
Vastus: 227 g
Kui ühes liitris vees lahustub 909 grammi glükoosi, siis 0,25 liitris lahustub 909 g/l × 0,25 l = 227 grammi.
2.4.
Vastus: 2,78%
Lahendus: Lisatud soola kogumassi, on 10 spl × 14,3 g/spl = 143 grammi. Vee ruumala oli 5 liitrit, seega selle mass oli tihedust 1 g/cm3=1 kg/dm3 arvestades 5 kg ehk 5000 g. Pärast soola lisamist oli soolalahuse kogumass 143 g + 5000 g = 5143 grammi. Soola massiprotsent selles:
$(P(sool) = {143 \over 5143}*100=2.78)% $
2.5.
Vastus: 180 g
Lahendus: Kui 1000 ml vees lahustub 360 g soola, siis 500 ml vette tuleks lisada poole vähem ehk 360 g / 2 = 180 g.
3.1. Lahendus: Kasuta valemit $c = {n \over V}$
Molaarse kontentratsiooni ühik on mol/dm3 ehk M
3.2. Lahendus: Kasuta valemit n = c × V
3.3. Lahendus: Baariumbromiidi molekulvalem on BaBr2. Teada on V=200 ml ehk 0,2 dm3 ja c=4 M, seega on moolide arv n=4 M × 0,2 dm3 = 0,8 mol. Molekulvalemist näeme, et 0,8 moolis baariumbromiidis on sama arv moole ehk 0,8 mol baariumioone ja kaks korda rohkem bromiidioone ehk 2×0,8 = 1,6 mol.
3.4. Lahendus: Teada on baariumbromiidi V=200 ml ehk 0,2 dm3 ja c=4 M, seega on moolide arv n=4 M × 0,2 dm3 = 0,8 mol.
Reaktsioonivõrrandist näeme, et BaBr2 ja H2SO4 moolsuhe on 1:1, seega on H2SO4 vaja samuti 0,8 mol.
Väävelhappe lahuse kontsentratsioon c=0,4 M, seega on ruumala $V(H_2SO_4) = {n \over c}= {0.8\hspace{0.1cm}mol \over 0.4\hspace{0.1cm}M}=2\hspace{0.1cm} liitrit$


