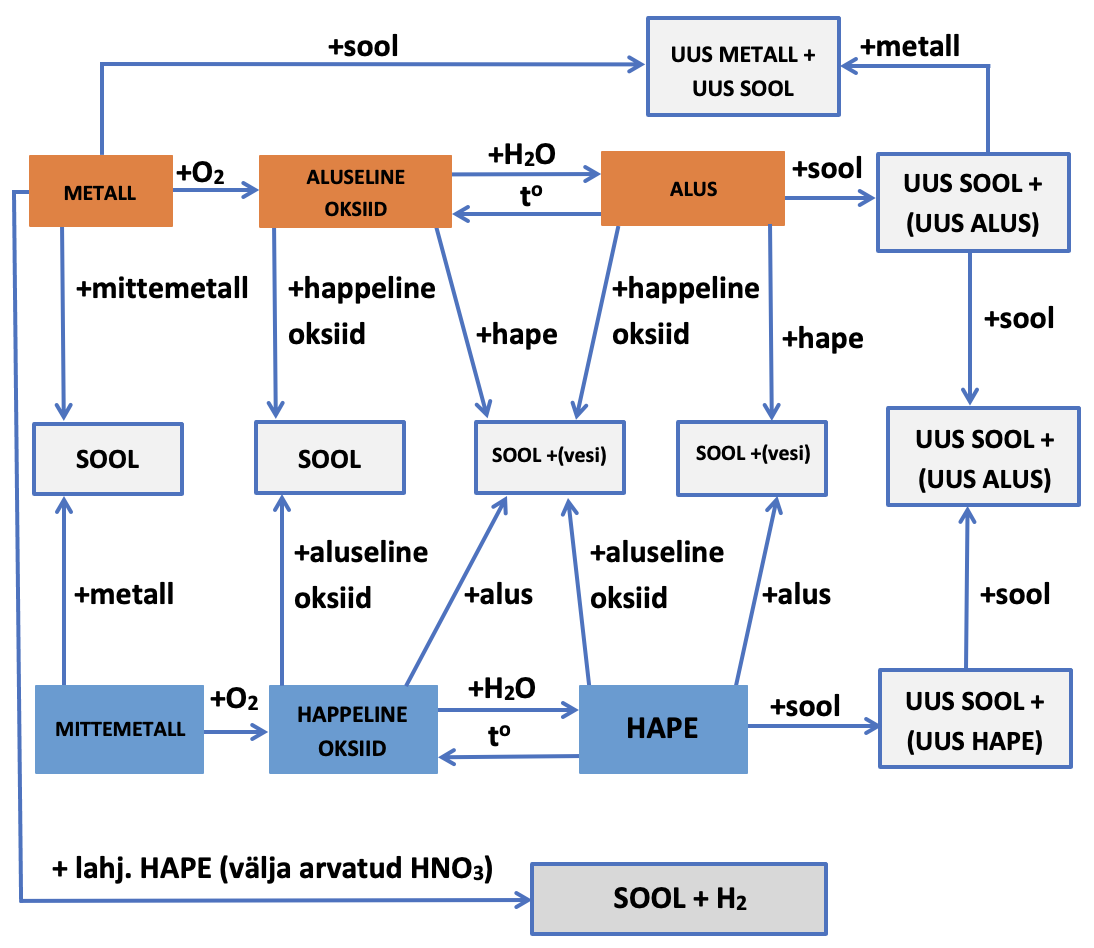
1.5. Seosed anorgaaniliste ainete põhiklasside vahel
Kuidas saada happest soola või aluselisest oksiidist alust? Anorgaaniliste ainete vahelisi seoseid saad vaadata järgmisest videost.
Allikas: https://youtu.be/vTmaYTCx-sk
Seoseid aineklasside vahel õppisid juba eelmistes osades. Toome need siin veelkord ära, nüüd kokkuvõtlikult tabelitena.
Tabel 1. Seosed aineklasside vahel
|
Reaktsioon |
Näited |
Selgitus |
|
LIHTAINE + HAPNIK → OKSIID |
C + O2 → CO2 2 Ca + O2 → 2 CaO |
Toimub peaaegu alati. Hapnikuga ei reageeri väärismetallid (Au, Pt), . |
|
+ VESI → |
CO2 + H2O → H2CO3 SO2 + H2O → H2SO3 |
Erandina ei reageeri veega SiO2. Happelise oksiidi ja happe koostises oleva mittemetallilise elemendi o.a ei muutu (nt CO2, H2CO3 – mõlemas aines on C o.a +4). |
|
ALUSELINE OKSIID + VESI → LEELIS |
CaO + H2O → Ca(OH)2 Na2O + H2O → 2 NaOH |
Veega reageerivad ainult tugevalt . Tugevalt aluselised oksiidid on I A rühma metallide ja II A rühma metallide , välja arvatud BeO ja MgO. Reaktsiooni tulemusel tekib tugev alus ehk leelis. |
|
ALUS + HAPE → SOOL + VESI |
NaOH + HCl → NaCl + H2O Ca(OH)2 + H2SO4 → CaSO4 + 2H2O |
Tegemist on neutralisatsioonireaktsiooniga. Väga nõrga aluse ja väga nõrga happe vahel reaktsiooni ei toimu. |
|
HAPPELINE OKSIID + ALUS → SOOL + VESI |
SO2 + Ca(OH)2 → CaSO3 + H2O CO2 + 2 NaOH → Na2CO3 + H2O |
Tekib happelisele oksiidile vastava happe sool. Happelise oksiidi ja happe koostises oleva mittemetallilise elemendi o.a ei muutu (nt CO2, H2CO3 – mõlemas aines on C o.a +4). |
|
ALUSELINE OKSIID + HAPE → SOOL + VESI |
Li2O + H2SO4 → Li2SO4 + H2O CaO + 2 HCl → CaCl2 + H2O |
Tugevalt aluseliste oksiididega toimub reaktsioon energiliselt, nõrgalt aluseliste puhul võib olla vajalik kuumutamine. |
|
ALUSELINE OKSIID + HAPPELINE OKSIID → SOOL |
BaO + CO2 → BaCO3 Na2O + SO2 → Na2SO3 |
Aktiivsemate oksiididega toimub reaktsioon kiiremini, vähem aktiivsetega on vajalik kuumutamine. Tekib happelisele oksiidile vastava happe sool. |
| + HAPE → SOOL + VESINIK |
Ca + H2SO4 → CaSO4 + H2↑ 2 Na + 2 HCl → 2 NaCl + H2↑ |
Lahjendatud hapetega reageerivad vesinikust vasakul pool olevad metallid. |
| METALL + VESI → ALUS + VESINIK |
Ca + 2 H2O → Ca(OH)2 + H2↑ 2 Na +2 H2O → 2 NaOH + H2↑ |
Reageerivad vaid aktiivsed metallid (Li-st kuni Mg-ni), tekib alus. |
| ALUS$\xrightarrow{temp.}$OKSIID + VESI |
Fe(OH)2 $\xrightarrow{temp.}$ FeO + H2O Cu(OH)2 $\xrightarrow{temp.}$ CuO + H2O |
Kuumutamisel lagunevad paremini vees lahustumatud . I A rühma hüdroksiidid ei lagune kuumutamisel. Mida väiksema aktiivsusega on metall, seda kergemini selle hüdroksiid kuumutamisel laguneb. |