
1.1. Oksiidid
Oksiidide peatükis räägime, mis on , kuidas oksiide nimetatakse ning nende keemilisi valemeid koostatakse. Vaatame, kuidas oksiide liigitada, milliste reaktsioonidega erinevaid oksiide saab ning viimasena käsitleme oksiidide keemilisi omadusi.
Kõige üldisemalt saame defineerida, et oksiidid on ained, mis koosnevad kahest elemendist, millest üks on hapnik. Oksiide leidub kõikjal meie ümber. Üks enam levinud oksiide on näiteks vesi ehk divesinikoksiid (H2O). Suur osa maakoorest koosneb tahketest oksiididest. Samuti on enamik metalle, mis puutuvad kokku hapniku või veega, kaetud oksiidi- või oksiidide kihiga.
Järgnev video võtab kokku olulisemad oksiidide nimetamise, saamise ja keemiliste omaduste reeglid.
Allikas: https://www.youtube.com/watch?v=mPn6iPeGfwk&list=PLDWTb1SlW-s0UQDpn7rtAmyba3HoLd2xu
Nimetamine
Oksiidide nimetamisel peab esmalt teadma, kas tegemist on metalli- või mittemetallioksiidiga. koosnevad metallilisest elemendist ja hapnikust (nt CaO, Na2O). koosnevad mittemetallilisest elemendist ja hapnikust (nt H2O, CO2).
 Korda videost üle, kuidas määrata oksüdatsiooniastet ja tasakaalustada ühendit.
Korda videost üle, kuidas määrata oksüdatsiooniastet ja tasakaalustada ühendit.
Metallioksiidide nimetamine
Metallioksiidide nimetamisel tuleb eelnevalt teada, kas on püsiva oksüdatsiooniastmega või mitte. Sellest tulenevalt on kaks metallioksiidide nimetamise reeglit:
1. metalli nimi + oksiid, kui oksiidi koostises oleval metallilisel elemendil on püsiv (I, II A rühmas ja III A-rühmas alumiiniumil):
nt CaO – kaltsiumoksiid, Na2O – naatriumoksiid, Al2O3 – alumiiniumoksiid;
2. metalli nimi + (o.a) + oksiid, kui oksiidi koostises oleval metallilisel elemendil on muutuv oksüdatsiooniaste (ülejäänud metallillised elemendid), nt
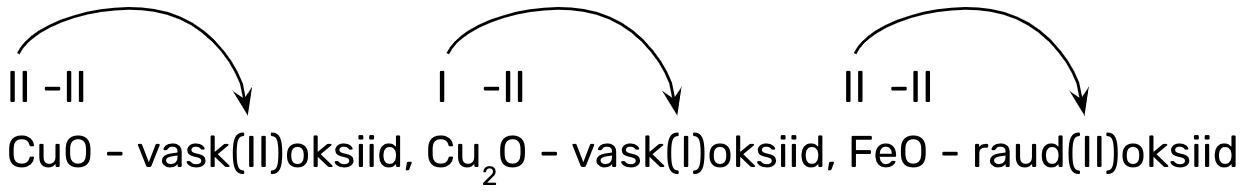
Mittemetallioksiidide nimetamine
Mittemetallioksiidide nimetamisel kasutatakse kreekakeelseid eesliiteid:
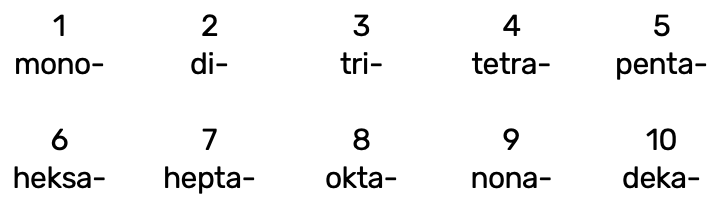
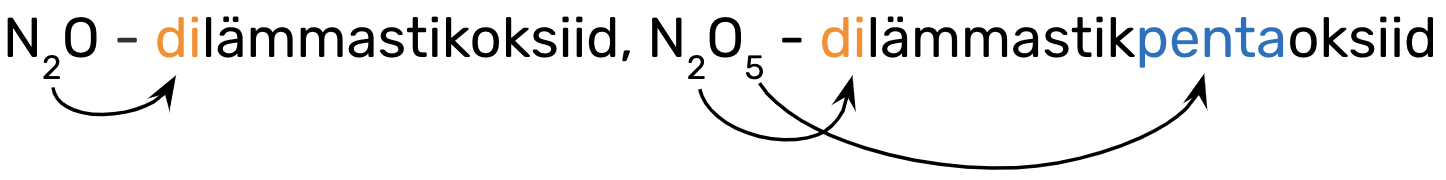
Eesliide käib selle mittemetallilise elemendi nimetuse ette, mille aatomite arvu ta näitab, nt
Vali oksiidi õige nimi.
Valemite koostamine
Oksiidide valemite koostamisel tuleb lähtuda järgmistest reeglitest:
- kirjuta kõrvuti oksiidi moodustava metallilise või mittemetallilise elemendi ja hapniku sümbolid;
- kui on tegemist mittemetallilise elemendiga, siis jälgi eesliiteid ja kirjuta need vastava elemendi sümboli järele indeksisse;
- kui on tegemist metallilise elemendiga, märgi elementide sümbolite kohale oksüdatsiooniastmed ja tasakaalusta vajadusel valem.
Näide 1. Koostame divesinikoksiidi valemi.
- Kõigepealt märgi kõrvuti vesiniku ja hapniku sümbolid: HO.
- Kuna tegemist on mittemetallioksiidiga, arvesta eesliiteid.
- Kuna eesliide on vesiniku ees ja di- tähendab kahte, siis on molekulis 2 vesiniku aatomit ning molekuli valemi saame kirjutada H2O.
Näide 2. Koostame liitiumoksiidi valemi.
- Kõigepealt märgi kõrvuti liitiumi ja hapniku sümbolid: LiO.
- Tegemist on metallioksiidiga, märgi elementide kohale oksüdatsiooniastmed:
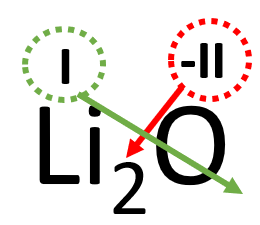
- Kuna oksüdatsiooniastmed on erineva väärtusega, tuleb valem tasakaalustada.
- Hetkel on liitiumi aatomil positiivne laeng ja hapniku aatomil kaks negatiivset laengut. Selleks, et ühendi laeng oleks tervikuna null, peab võtma kaks positiivselt laetud liitiumi aatomit, see kirjutatakse alla indeksisse.
- Sellest tulenevalt kujuneb liitiumoksiidi valemiks Li2O.
Milline on oksiidi õige valem?
Oksiidide liigitamine
Oksiidid jaotatakse metallioksiididideks ja mittemetallioksiidideks. Samas on võimalik neid jaotada ka happelisteks, aluselisteks, neutraalseteks ja amfoteerseteks oksiidideks.
on hapetele vastavad oksiidid, mis tuleneb sellest, et enamik happelisi oksiide reageerib veega ja moodustub . Tuntuimad happelised oksiidid on mittemetallioksiidid, nt SO2, CO2.
on alustele vastavad oksiidid, mis tuleneb sellest, et enamik aluselisi oksiide reageerib veega ja moodustub alus. Tavaliselt on aluselised oksiidid metallioksiidid, nt CaO, Li2O.
on oksiidid, millel puuduvad nii aluselised kui ka happelised omadused, nt CO, NO ja N2O. Need oksiidid ei reageeri aluste, hapete ega veega.
on oksiidid, millel on korraga nii aluselised kui ka happelised omadused ehk need oksiidid reageerivad nii aluste kui ka hapetega, nt Al2O3, ZnO, Cr2O3.
Eri liiki oksiidide näited leiad allolevast tabelist, kus ühendi all on ära toodud selle nimi:
|
ALUSELISED |
HAPPELISED |
NEUTRAALSED |
AMFOTEERSED |
|
Li2O |
SO2 |
H2O |
ZnO |
|
Na2O |
SO3 |
CO |
BeO |
|
CaO |
NO2 |
N2O |
Al2O3 |
|
MgO |
P4O10 |
NO |
PbO |
Oksiidide saamine
Nagu alguses juba mainitud, puutume igapäevaelus kokku väga paljude erinevate oksiididega (H2O – vesi, õhus leidub veel lisaks CO2, CO, NO, NO2 jne, maakoores SiO2, CaO, MgO jne). Üks peamisi põhjuseid, miks oksiide nii laialdaselt leidub, on see, et oksiidid tekivad väga kergesti liht– või liitaine kokkupuutel õhuhapnikuga.
1. Oksiidid tekivad liht- või liitainete reageerimisel hapnikuga.
2 Ca + O2 → 2 CaO
4 Al + 3 O2 → 2 Al2O3
CH4 + 2 O2 → CO2↑ + 2 H2O
Reageerimist hapnikuga nimetatakse ka põlemisreaktsiooniks. Metallide põlemisel tekivad aluselised oksiidid ning mittemetallide põlemisel happelised oksiidid.
Oksiide saab toota ka tööstuslikult, näiteks soolade kuumutamisel kõrgetel temperatuuridel.
2. Oksiidide teke soolade termilisel lagunemisel.
CaCO3 (t) 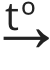 CaO(t) + CO2(g)
CaO(t) + CO2(g)
Lubjakivi (CaCO3) kuumutamisel põhineb kustutamata lubja (CaO) tootmine.
3. Oksiidide teke rasklahustuvate hüdroksiidide termilisel lagunemisel.
2 Al(OH)3 (t) 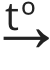 Al2O3(t)+ 3 H2O(g)
Al2O3(t)+ 3 H2O(g)
Cu(OH)2 (t) 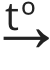 CuO(t) + H2O(v) (Joonis 1)
CuO(t) + H2O(v) (Joonis 1)
Ca(OH)2(t) 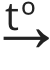 CaO(t) + H2O(g)
CaO(t) + H2O(g)
(Ca(OH)2 – kustutatud lubi; CaO – kustutamata lubi)

Joonis 1. Pildil on illustreeritud oksiidi teke rasklahustuvast hüdroksiidist, Cu(OH)2-st. Laborites saab sellist katset läbi viia, kuumutades sinist värvi tahket Cu(OH)2 piirituslambi kohal. Tekkinud must sade on CuO. Värvuse muutumine on üks keemilise reaktsiooni tunnuseid.
Oksiidide keemilised omadused
Sõltuvalt sellest, kas tegemist on happelise, aluselise, amfoteerse või neutraalse oksiidiga, on oksiididel erinevad keemilised omadused ehk võime reageerida teiste ainetega.
1. Happelise oksiidi reageerimisel veega moodustub hape.
+ H2O = HAPE
SO3(t) + H2O(v) → H2SO4(l) väävelhape
SO2(g)+ H2O(v)  H2SO3(l) väävlishape
H2SO3(l) väävlishape
CO2(g)+ H2O(v)  H2CO3(l) süsihape
H2CO3(l) süsihape
P4O10(t) + H2O(v) → H3PO4(l) fosforhape
N2O5(g) + H2O(v) → HNO3(l) lämmastikhape
SiO2 on happeline oksiid, kuid veega ei reageeri, on liiva põhikomponent.
Oluline on meeles pidada, et oksiidis ja talle vastavas happes peab mittemetallilisel elemendil olema sama oksüdatsiooniaste (o.a). Happelised oksiidid ja neile vastavad on toodud tabelis 1.
Tabel 1. Happelistele oksiididele vastavad happed
|
HAPPELINE OKSIID |
VASTAV HAPE |
HAPPE NIMETUS |
|
SO2 |
H2SO3 |
väävlishape |
|
SO3 |
H2SO4 |
väävelhape |
|
CO2 |
H2CO3 |
süsihape |
|
P4O10 |
H3PO4 |
fosforhape |
|
N2O5 |
HNO3 |
lämmastikhape |
2. Aluselise oksiidi reageerimisel veega moodustub tugev alus ehk leelis.
ALUSELINE OKSIID + H2O = TUGEV ALUS
CaO + H2O → Ca(OH)2
Na2O+ H2O → 2 NaOH
Veega reageerivad ainult I A rühma ja alates kaltsiumist II A rühma metallide oksiidid (magneesium reageerib veega halvasti, ainult kuumutamisel).
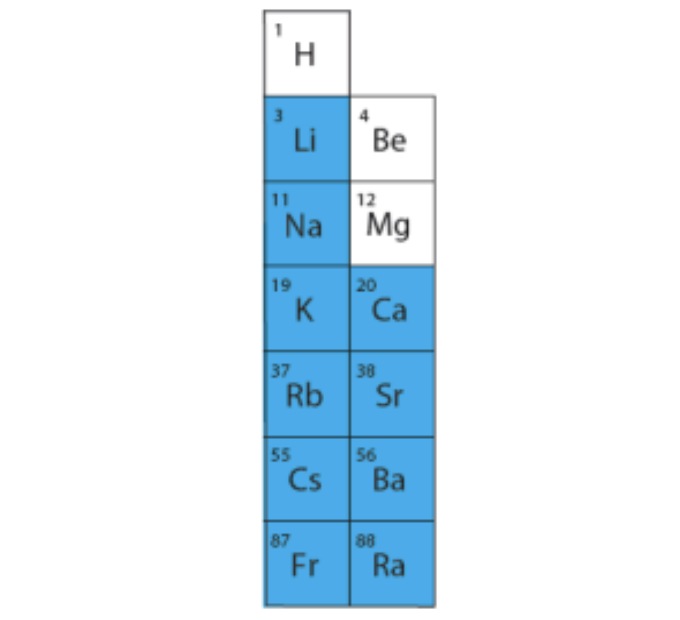
Joonis 2. Sinisega on märgitud metallid, mille oksiidid reageerivad veega tavatingimustel ja tekib tugev alus ehk leelis.
Tabel 2. Aluselistele oksiididele vastavad
|
ALUSELINE OKSIID |
VASTAV ALUS |
ALUSE NIMETUS |
|
Li2O – liitiumioksiid |
LiOH |
liitiumhüdroksiid |
|
Na2O – naatriumoksiid |
NaOH |
naatriumhüdroksiid |
|
CaO – kaltsiumoksiid |
Ca(OH)2 |
kaltsiumhüdroksiid |
|
BaO – baariumoksiid |
Ba(OH)2 |
baariumhüdroksiid |
3. Amofoteersed ja neutraalsed oksiidid ei reageeri veega.
Amfoteersed oksiidid (Al2O3) ja neutraalsed oksiidid veega ei reageeri (NO, N2O, CO jt).
4. Aluselise oksiidi reageerimisel happelise oksiidiga moodustub sool.
ALUSELINE OKSIID + HAPPELINE OKSIID = SOOL
CaO + CO2  CaCO3
CaCO3
6 Li2O + P4O10 → 4 Li3PO4
See reaktsioon toimub alati ning tekib happelisele oksiidile vastava happe sool. Happelisele oksiidile vastava happe leiad tabelist 1.
5. Happeline oksiid reageerib alusega, moodustub sool ja vesi.
HAPPELINE OKSIID + ALUS = SOOL + H2O
SO2(g) + 2 NaOH(l) → Na2SO3(l) + H2O(v)
CO2(g) + Ca(OH)2(l) → CaCO3(t) + H2O(v)
See reaktsioon toimub alati.
6. Aluseline oksiid reageerib happega, moodustub sool ja vesi.
ALUSELINE OKSIID + HAPE = SOOL + H2O
2 HNO3 + CaO → Ca(NO3)2 + H2O
See reaktsioon toimub alati.


