5.1. Keemiline side
Ainetes on üksikud aatomid enamasti ebapüsivad, mistõttu ühinevad nad molekulideks või kristallideks.
Ainult vähesed keemilised elemendid esinevad looduses vabade aatomitena. Ainetes on üksikud aatomid enamasti ebapüsivad, mistõttu ühinevad nad suuremateks osakesteks – molekulideks või kristallideks. Seega enamike ainete korral on keemilise elemendi aatomid vastastiktoimes sama elemendi või mõne teise elemendi aatomitega. Aatomitevahelist toimet nimetatakse keemiliseks sidemeks. Sideme konkreetseks tekkepõhjuseks on aatomeid siduvate ühiste elektronpaaride moodustumine või aatomitest tekkinud vastaslaenguga ioonide tõmbumine.
Keemilise sideme moodustumine
Keemilise sideme tekkimisel vabaneb alati energiat.
Keemilise sideme tekkimisel vabaneb alati energiat (vaata joonist 1). Molekulide tekkimine aatomitest ja molekulide lagunemine aatomiteks on kaks vastassuunalist protsessi. Molekuli lagundamiseks tuleb lõhkuda keemilisi sidemeid, milleks kulub energiat.
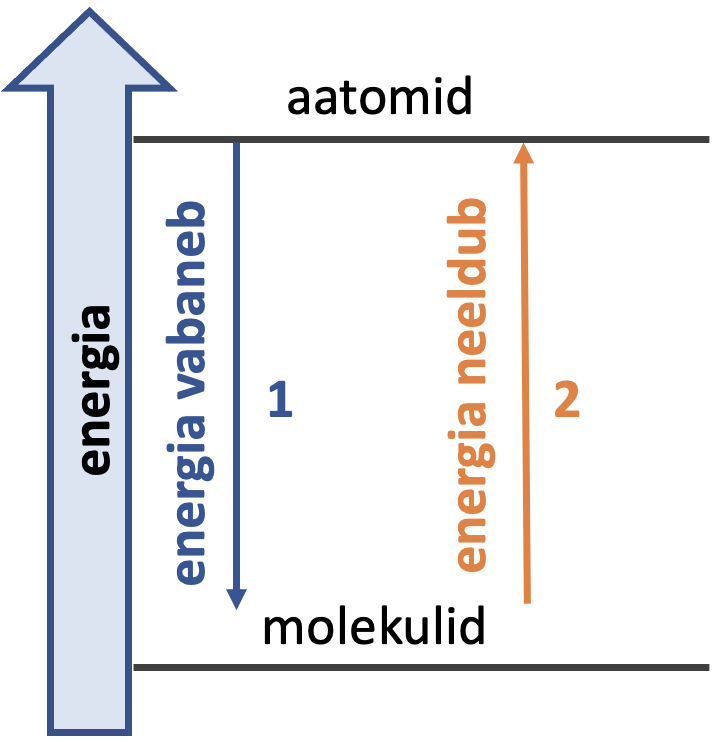
Joonis 1. Energiamuutused keemilise sideme tekkel (1) ja lagunemisel (2)
Molekulil on alati madalam energia kui tema koosseisus olevatel üksikutel aatomitel.
Molekul on väikseim iseseisev osake ja koosneb kovalentse(te) sideme(te)ga seotud aatomitest. Molekulil on alati madalam energia kui tema koosseisus olevatel üksikutel aatomitel.
Keemiline side on aatomitevaheline vastastiktoime, mis on seotud elektronpilvede (orbitaalide) osalise kattumisega, mis vähendab süsteemi energiat. Keemilise sideme liigid on kovalentne side, iooniline side, metalliline side ja vesinikside.
Kovalentne side
Kovalentne side on aatomitevaheline side, mis tekib ühiste elektronipaaride moodustumisel. Selleks on kaks võimalust. Kõige sagedamini moodustub ühine elektronipaar viisil, kus mõlemad aatomid annavad selleks ühe elektroni. Näiteks vesinikumolekul tekib, kui mõlemad vesinikuaatomid annavad oma elektroni sideme moodustamiseks (joonis 2).
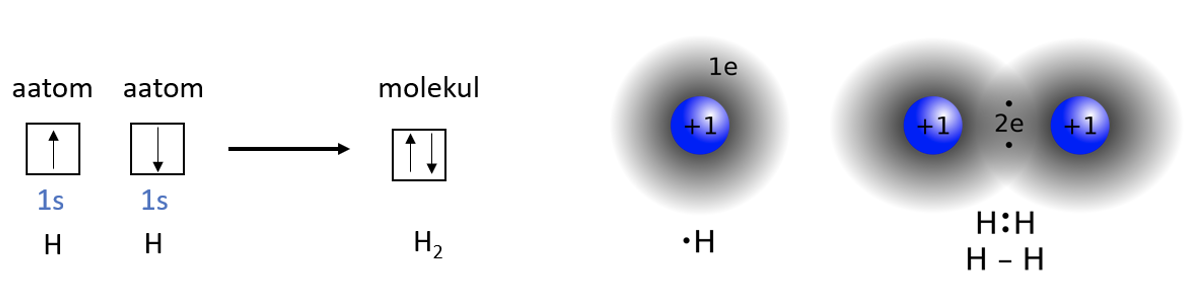
Joonis 2. Vesinikumolekuli teke. Vasakul on kujutatud H2 moelkuli teket ruutskeemina, paremal on toodud sfääriliste 1s orbitaalide kattumine ja ühise elektronpaari moodustumine. Allikas: https://en.wikipedia.org/wiki/Covalent_bond
Lämmastikuaatomil on väliskihis 5 elektroni, 3 neist on paardumata. Lämmastikuaatomi paardumata elektronid ühinevad vesinikuaatomite elektronidega – tekivad ühised elektronpaarid ehk moodustub kolm keemilist sidet (joonis 3).
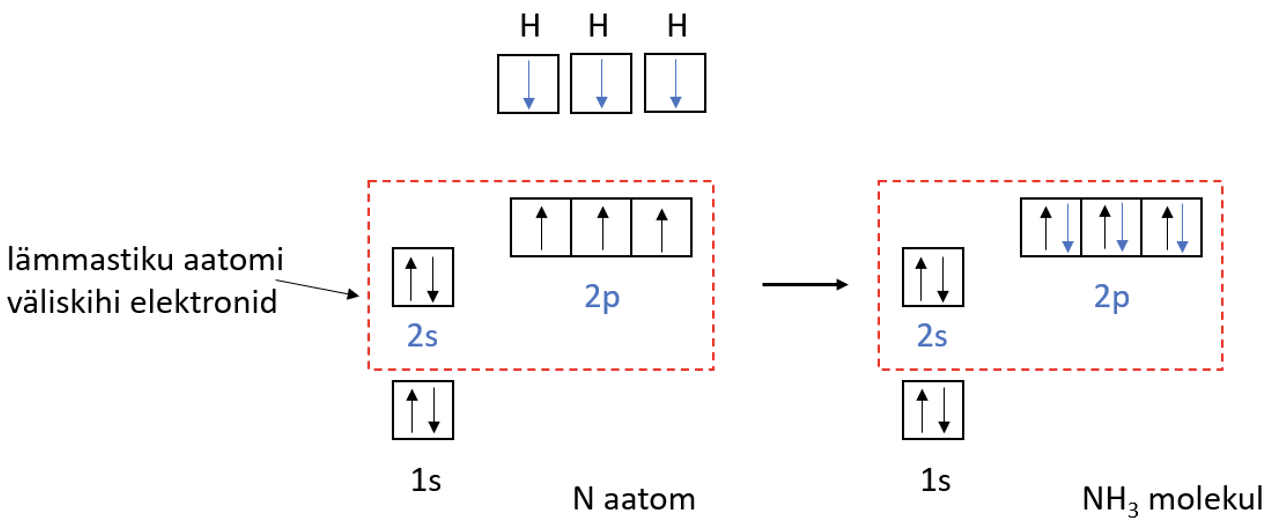
Joonis 3. NH3 teke
Osakese väliskihi elektrone ja keemilist sidet kujutatakse ka täppskeemina:
· üksik täpp tähistab ühte elektroni välisel elektronkihil,
: kaks täppi tähistab elektronpaari,
‑ tähistab üksiksidet,
= tähistab kaksiksidet,
≡ tähistab kolmiksidet.
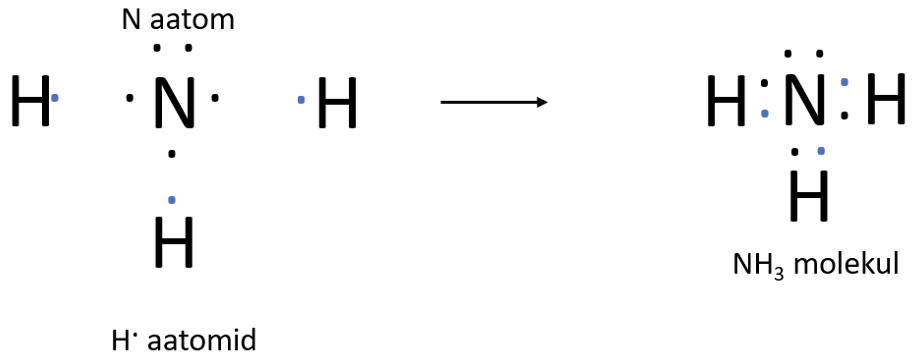
Joonis 4. NH3 molekuli tekkimine täppskeemiga
Teine võimalus keemilise sideme tekkeks on, kui üks osake annab elektronpaari ja teine tühja orbitaali. Näiteks NH3 molekul seob prootoni H+, mille tulemusena tekib N-H side NH4+ ioon (joonis 5).
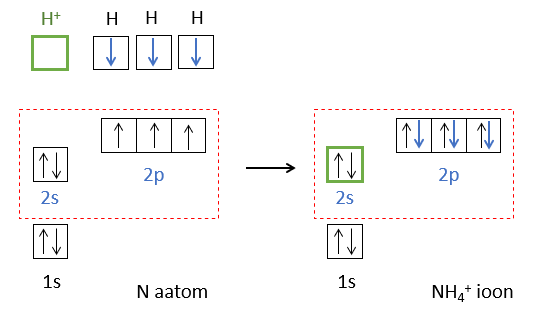
Joonis 5. NH4+ iooni moodustumine
Sideme polaarsus
Kovalentne side võib olla mittepolaarne (kui elektronpaar on jagatud võrdselt mõlema aatomi vahel) või polaarne (kui elektronpaar on tõmmatud rohkem ühe aatomi poole. Kovalentse sideme hindamiseks kasutatakse keemias suurust elektronegatiivsus (elektronegatiivsust tähistatakse sümboliga χ, elektronegatiivsuste väärtusi vaata jooniselt 6). Elektronegatiivsus näitab elemendi aatomite võimet tõmmata enda poole ühist elektronpaari. Elektronegatiivsus suureneb perioodis vasakult paremale ja rühmas alt üles. Kõige suurem elektronegatiivsus on fluoriaatomil ja kõige väiksem tseesiumiaatomil.
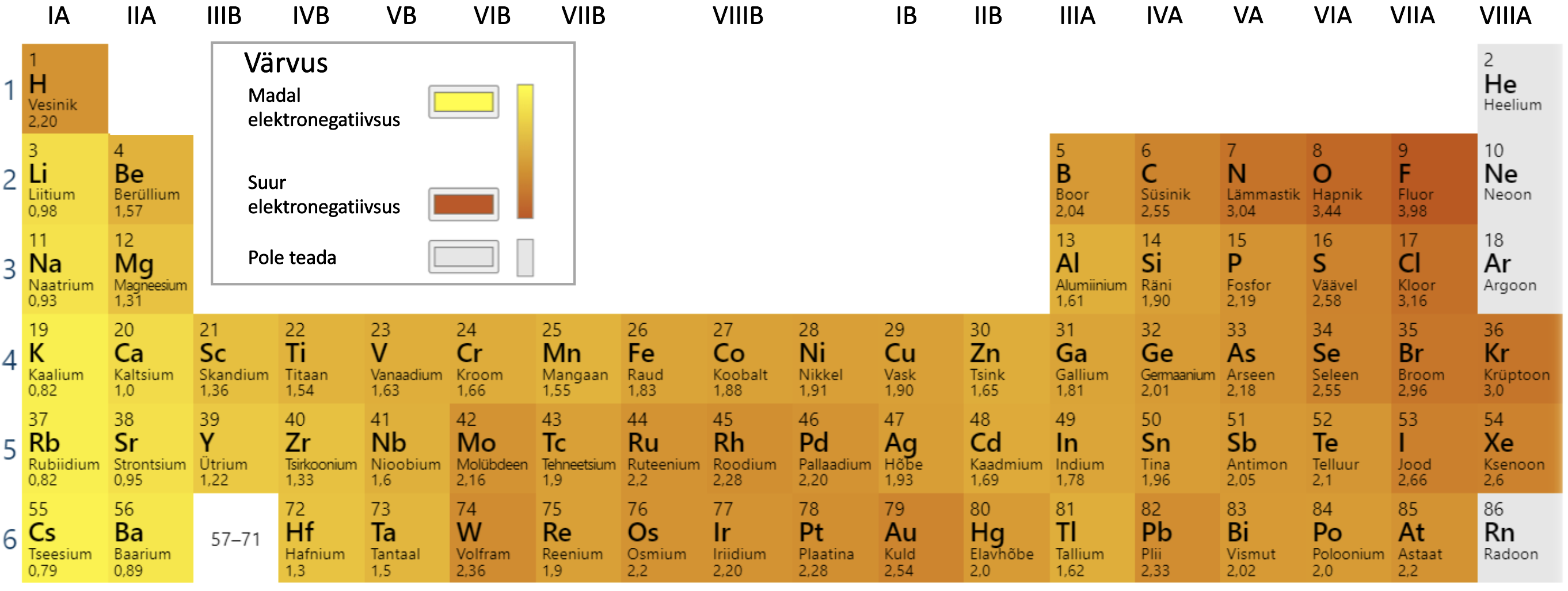
Joonis 6. Mõnede elementide elektronegatiivsuste väärtused. Allikas: https://ptable.com/?lang=et#Properties/Electronegativity
Lihtainete kaheaatomilistes molekulides (H2, O2, N2 jt) on ühine elektronpaar võrdselt mõlema aatomi valduses, sest aatomid seovad elektronpaari ühesuguse tugevusega (vt joonist 7). Väga tihti on aga kovalentne side moodustunud eri tüüpi aatomite vahel (H2O, HI, NaCl jt). Need aatomid mõjutavad ühist elektronpaari erinevalt, kuna on erineva suuruse ning tuumalaenguga. Ühine elektronpaar on alati tõmmatud mittemetallilisema elemendi ehk elektronegatiivsema elemendi aatomi poole.
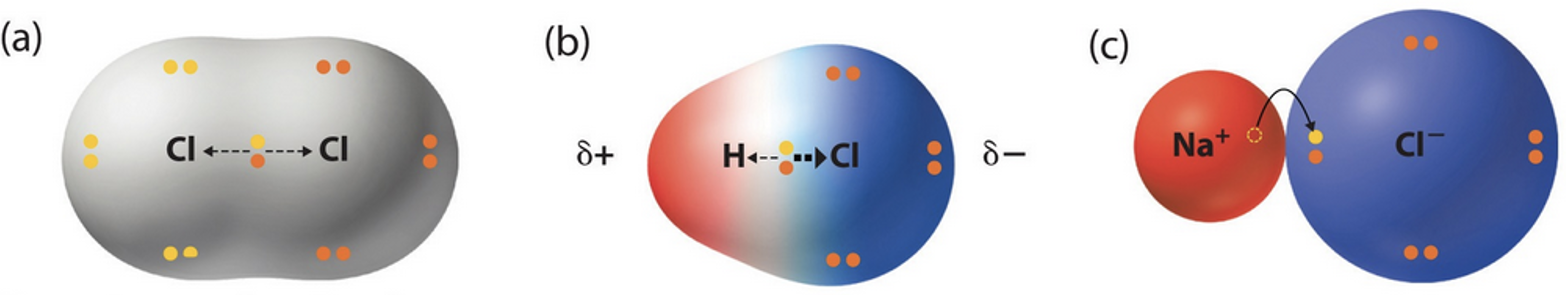
Joonis 7. a) mittepolaarne kovalentne side, kus elektronpar on jagatud kahe aatomi vahel võdselt, b) polaarne kovalentne side, kus ühine elektronpaar on tõmmatud elektronegatiivsema elemendi poole, c) iooniline side, kus elektron on läinud elektronegatiivsemale aatomile.
Polaarse kovalentse sideme puhul on aatomeid siduv ühine elektronpaar tõmmatud elektronegatiivsema elemendi aatomi poole ja molekulide osadel on erinimelised osalaengud. Mida rohkem on ühine elektronpaar ehk elektronpilv tõmmatud elektronegatiivsema elemendi aatomi poole, seda polaarsem on side. Näiteks vesinikkloriidi molekulis on vesinik väiksema elektronegatiivusega kui kloori aatom ning ühine elektronpilv on tõmmatud kloori aatomi poole: δ+H :Clδ-. Vesiniku aatom on polariseeritud positiivselt ja kloori aatom negatiivselt.
Mittepolaarse kovalentse sideme korral on aatomeid siduv elektronpaar võrdselt mõlema aatomi valduses.
Iooniline side esineb vastasmärgiliste laengutega ioonide vahel kristallivõres. Iooniline side kujutab endast polaarse kovalentse sideme üht äärmuslikku piirjuhtu (teine piirjuht on mittepolaarne side). Ioonilise sideme korral on aatomeid siduv ühine elektronpaar täielikult üle läinud elektronegatiivsema elemendi aatomile, mille tulemusena on tekkinud vastasmärgiliste laengutega ioonid. Vastasmärgilisi ioone hoiavad koos elektrostaatilised tõmbejõud (joonis 6 c).
Elektronegatiivsuste suhtelise erinevuse järgi saab määrata kovalentse sideme alaliike. Elektronegatiivsuste suhtelist erinevust tähistatakse sümboliga Δχ ning selle leidmiseks tuleb lahutada ühendis keemilist sidet moodustavate elementide elektronegatiivsuste väärtused. HCl korral Δχ = χkloor - χvesinik = 3,2 - 2,2 =1.
Kui Δχ < 0,5, siis on tegemist kovalentse mittepolaarse sidemega (H2, Cl2, aga ka molekulid, mille elektronegatiivsuste erinevus on väga väike).
Kui 0,5 < Δχ < 2,0 loetakse side kovalentseks polaarseks (HF, HCl, H2O).
Kui Δχ > 2,0, loetakse side valdavalt iooniliseks (NaCl).
Vesinikside
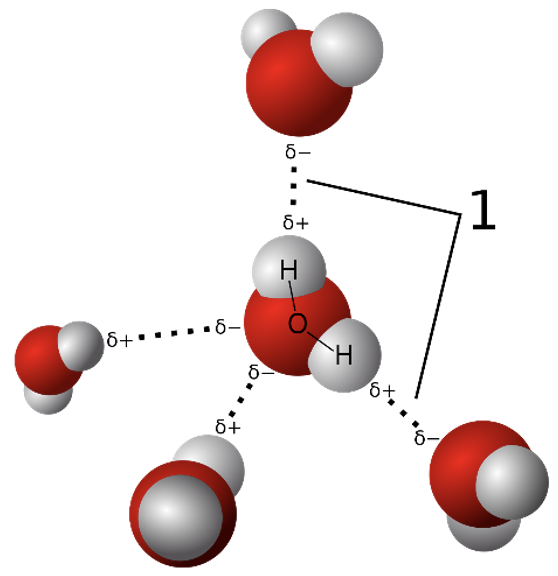
Vesinikside on väga laialt levinud ning mõjutab paljude protsesside kulgemist. Näiteks vesiniksidemete teke soodustab aine lahustumist. Ühe aatomiga tekib vesinikul tugev side – kovalentne polaarne side, teisega nõrgem – nn vesinikside (vaata joonist 8). HF molekulis on ühine elektronpaar tõmmatud fluori aatomi poole, kusjuures vesiniku aatom on jäänud peaaegu elektronpaarita. F aatomil on negatiivne osalaeng (δ-) ning vesiniku aatomil positiivne osalaeng (δ+). H-side tekib postiivse osalanguga vesinikuaatomi ja teise HF molekuli negatiivse osalaleguga fluoriaatomi vahel. H-sidet märgitakse skeemides punktiirjoonena.
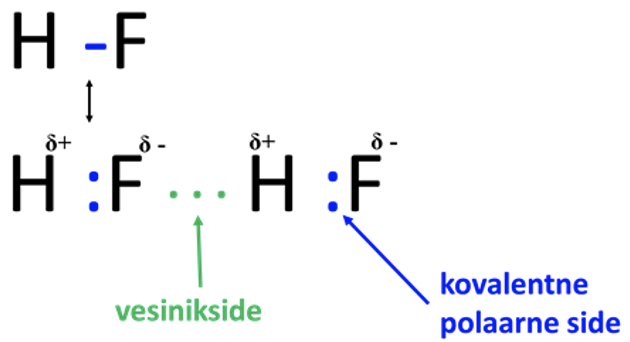
Joonis 8. Vesinikside vesinikfluoriidis
Vesinikside on elektronegatiivse elemendiaatomi (F, O, N) ja polaarse sidemega seotud vesinikuaatomi vaheline täiendav side ja on nõrgem, kui kovalentne side (H-sideme näide veemolekulide vahel joonis 9). Enamasti esineb H-side molekulide vahel, kuid võib esineda ka suuremate molekulide erinevate osade vahel (näiteks DNAs ja RNAs).