5.2. Struktuur ja ainete omadused
Ainete erinevad osakesed – aatomid, molekulid, ioonid – moodustavad vastastiktoimete tõttu erinevaid korrapäraseid ruumilisi struktuure –kristallivõresid. Kristallivõre on ruumiline struktuur, mis kirjeldab ioonide, aatomite ja molekulide korrapärast asetust kristallis. Eristatakse nelja erinevat tüüpi kristallivõresid: aatomvõre, metallivõre, ioonvõre ja molekulvõre.
Ioonvõre
Ioonilise sidemega ained moodustavad püsivaid ioonkristalle ehk ioonvõresid.
Ioonilise sidemega ained on tavatingimustes tahkes olekus ja moodustavad püsivaid ioonkristalle ehk ioonvõresid. Ioonvõres on kristallivõre sõlmpunktides ioonid (joonis 1). Tugevad elektrostaatilised jõud (iooniline side) takistavad ioonide väljumist tekkinud korrapärasest struktuurist. Mida tugevam on iooniline side, seda kõrgem on aine sulamis- ja keemistemperatuur. Ioonvõrega ained ei juhi elektrivoolu. Sulas olekus ja vesilahuses saavad ioonid vabamalt liikuda, mistõttu elektrijuhtivus kasvab (vaata ka tabelis 2 toodud väärtusi ja võrdlust teiste kristallvõretüüpidega).
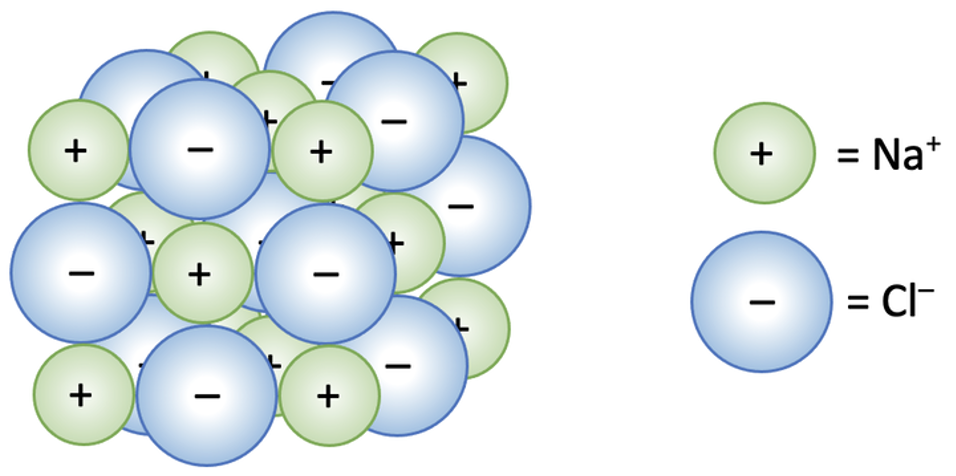
Joonis 1. NaCl ioonvõre. Allikas: https://www.elevise.co.uk/gac2c.html
Mida ioonilisemad on ained, seda paremini need lahustuvad vees, kuna tekib tugev vastastiktoime lahusesse tekkinud iooni ja vee molekulide vahel. Neid järeldusi kinnitavad tabelis 1 toodud andmed. Keemilise sideme ioonilisust saame hinnata keemilist sidet moodustavate osakeste elektronegatiivsuste erinevuse kaudu, mida suurem on osakeste elektronegatiivsuste erinevus seda ioonilisemaks muutub side. Tüüpilised ühendid (NaCl, CsCl, CsF), milles esineb iooniline side moodustuvad väga aktiivsete metallide (IA ja IIA rühma metallidega) ja halogeenidega. Iooniliste ainete lahustuvuse korral tuleb lisaks sideme elektronegatiivsuste erinevusele arvesse võtta ka ioonvõre energiat, mida suurem on ioonvõre energia, seda halvemini aine lahustub (aine lahustumisel lõhutakse ioonvõre).
Tabel 1. Ioonvõrega ainete füüsikalisi parameetreid
|
Ühendi valem |
Molekulmass |
Sulamistemperatuur (oC) |
Lahustuvus grammides 100 g vees 20 oC juures |
|
NaCl |
58,5 |
801 |
36 |
|
CaCl2 |
111 |
772 |
74,5 |
|
NaF |
42 |
993 |
40,4 |
|
CaF2 |
78 |
1418 |
0,0016 |
|
CaO |
56 |
2613 |
reageerib veega, Ca(OH)2 |
|
Na2O |
39 |
1132 |
reageerib veega, NaOH |
|
NaOH |
40 |
323 |
100 |
Iooniliste ühendite kristallid on mehaaniliselt kõvad, kuid haprad. Kui ioonide kihid kristallis välismõju tõttu nihkuvad, satuvad kohakuti sama laengumärgiga ioonid. Tekkiv ioonide tõukumine soodustab kristallvõre purunemist ja muudab kristalli hapraks.
Aatomvõre
Kovalentse sidemega ained võivad tahkes olekus moodustada aatomitest koosneva kristallvõre ehk aatomvõre.
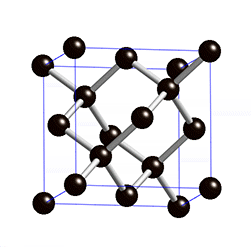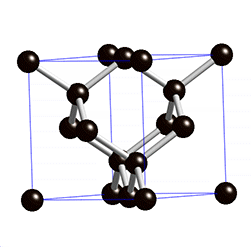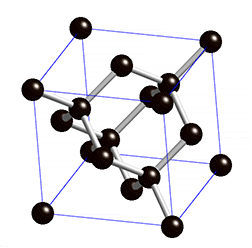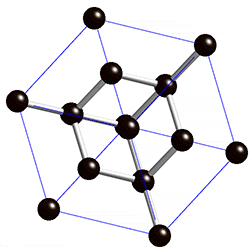
Kovalentse sidemega ained võivad tahkes olekus moodustada aatomitest koosneva kristallvõre ehk aatomvõre. Aatomvõres on kristallvõre sõlmpunktides aatomid. Omavahel võib olla seotud palju aatomeid. Näiteks teemandis (vaata joonist 2) on iga süsinikuaatom kovalentselt seotud nelja naaberaatomiga, moodustades tetraeedri. Vabade elektronide puudumise tõttu ei juhi teemant elektrit. Selline struktuuri eripära tagab väga hea stabiilsuse, keemilise vastupidavuse ning erakordse tugevuse. Teemandi sulamistemperatuur on üle 4830 kraadi (vaata ka tabelis 2 toodud väärtusi ja võrdlust teiste kristallvõre tüüpidega).
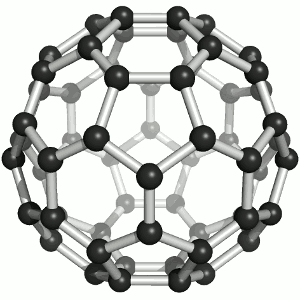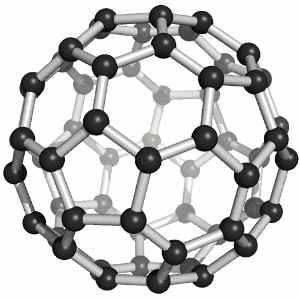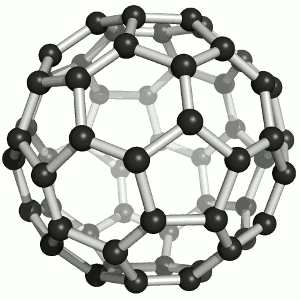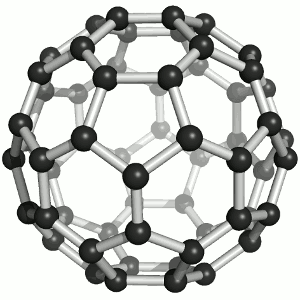
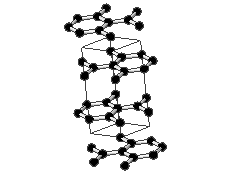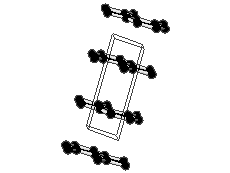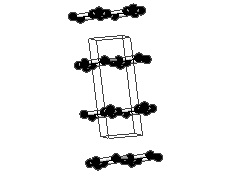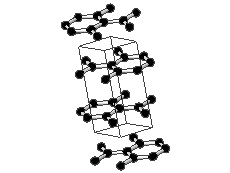
Joonis 2. Aatomvõrega ained: teemant, fullereen C60 ja grafiit. Allikad:
https://enginyeriafisica.etsetb.upc.edu/ca/recerca/la-nostra-recerca/nanotecnologia/fulere/image_view_fullscree;
https://et.wikipedia.org/wiki/S%C3%BCsinik#/media/Fail:Diamond_Cubic-F_lattice_animation.gif;
https://www.che.kyutech.ac.jp/chem24/hp/english/lecture/crystal%20structure/graphite/graphite.htm
Süsinikmaterjalidena kasutatakse tänapäeval laialdaselt fullereene (joonis 2). Fullereenides (pallikujulised osakesed) võib süsinikuaatomite arv ulatuda paarikümnest sadadeni. Iga süsinikuaatom on seotud kolme naaberaatomiga ühe kaksiksideme ja kahe üksiksideme kaudu. Keemiliselt on fullereenid suhteliselt stabiilsed. Korrapärase struktuuri lõhkumiseks on vaja kõrget temperatuuri – rohkem kui 1000 °C.
Grafiidikristallis on iga süsinikuaatom tasapinnaliselt seotud kolme naaberaatomiga ning nende vahel on tugev kovalentne side. Sidemetevaheline nurk on 120 °. Süsinikuaatomid grafiidis on sp2-hübridisatsioonolekus. Iga süsinikuaatomi neljast valentselektronist kolme kasutatakse sideme moodustamiseks. Süsinikuaatomid moodustavad korrapärase kuusnurga, kus C-C sideme pikkus on ~ 0.14 nm. Kuusnurgad omakorda moodustavad grafeenikihid, mis paiknevad paralleelselt üksteise kohal ning kahe kihi vaheline kaugus on ~ 0.34 nm. Kihtide vahel eksisteerivad ainult nõrgad toimed, mille tõttu saavad kihid nihkuda. Iga süsinikuaatomi neljas väliskihielektron aitab moodustada delokaliseeritud π-sidet, mis on laiali määritud kõigi süsinike aatomite vahel. Seetõttu on grafiit hea elektrijuht.
Aatomvõre esineb ka näiteks sellistes ainetes nagu SiO2, Si, SiC, B jne.
Aatomitest koosnevates kristallides on kovalentseid sidemeid väga raske lõhkuda, sellepärast on sellistel ainetel väga kõrged sulamis- ja keemistemperatuurid. Kovalentsed ained on mehaaniliselt väga kõvad, kuid haprad ja võivad kergesti puruneda. Enamikul aatomvõrega ainetel puudub elektrijuhtivus (või see on halb) ja nad praktiliselt ei lahustu vees.
Molekulvõre
Molekulaarsetel ainetel on tahkes olekus kristallvõre sõlmpunktides molekulid ehk moodustub molekulvõre.
Molekulaarsetel ainetel on tahkes olekus kristallvõre sõlmpunktides molekulid ehk moodustub molekulvõre (joonis 3). Molekulidevahelised tõmbejõud on võrreldes molekulisiseste keemiliste sidemetega suhteliselt nõrgad, kuid neist piisab, et hoida molekule koos tahkes aines või vedelikus. Molekulaarseid võresid moodustavad toatemperatuuril gaasilised ained, enamik orgaanilisi aineid, kuid ka mõned toatemperatuuril tahked ained nagu väävel, valge fosfor jne. Molekulvõre laguneb temperatuuri tõstes väga kergesti (tabel 2). Nendel ainetel on väga madalad sulamistemperatuurid, nad aurustuvad kergesti, praktiliselt ei lahustu vees ja neil puudub elektrijuhtivus tahkes ja vedelas olekus.
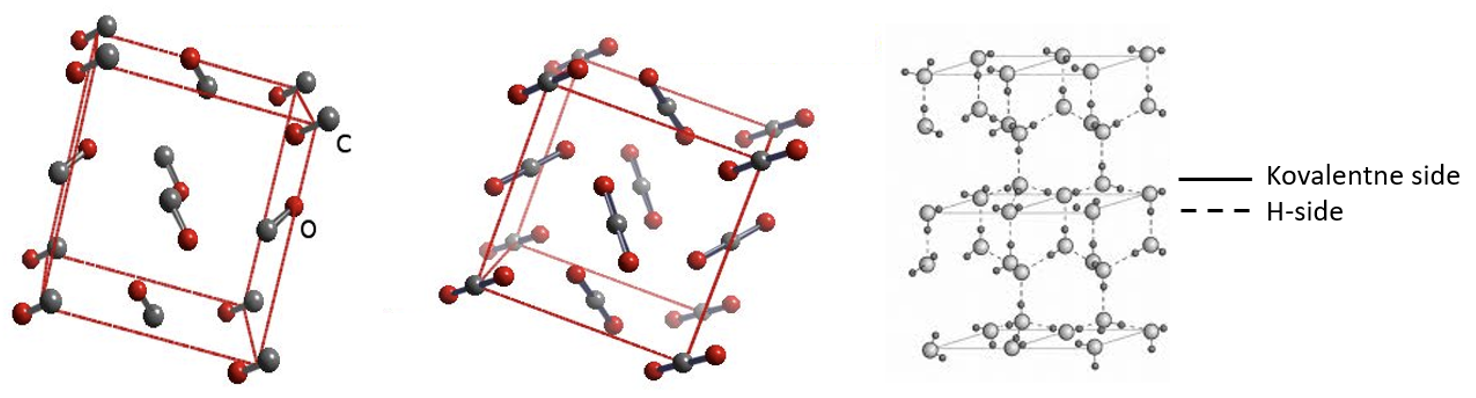
Joonis 3. Molekulvõrega ained CO, CO2 ja H2O
Metallivõre
Kõik metallid moodustavad metallivõre, kus võre sõlmpunktides on metalliaatomid.
Kõik metallid moodustavad metallivõre, kus võre sõlmpunktides on metalliaatomid. Mõningad metallivõrede näited on toodud joonisel 4. Metallidel on väga erinevad füüsikalised omadused (tugevus, sulamistemperatuurid jne). Metallide omaduste kohta saad pikemalt lugeda metallide peatükist.
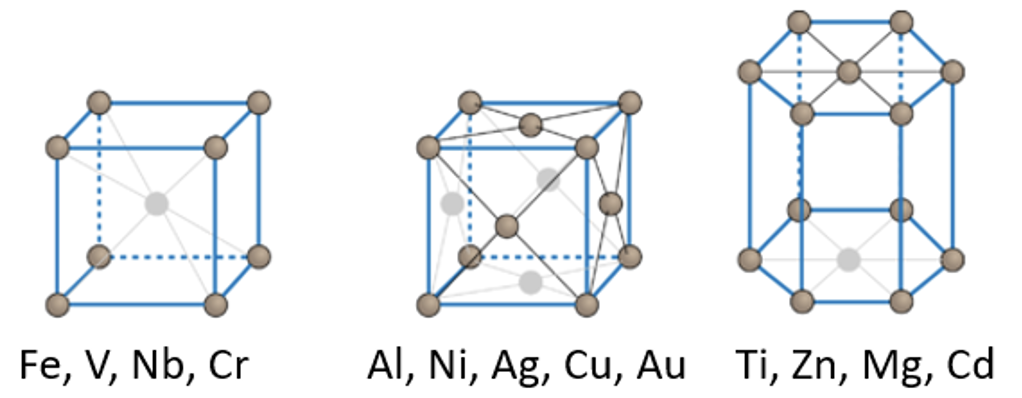
Joonis 4. Erinevate metallide kristallivõred. Allikas: https://courses.lumenlearning.com/cheminter/chapter/crystal-structures-of-metals/
Võretüübi seose füüsikaliste omadustega võtab kokku tabel 2.
Tabel 2. Võretüüp ja vastavad füüsikalised omadused
|
|
Ioonvõre |
Aatomvõre |
Molekulvõre |
Metallivõre |
|
Osakesed aines |
ioonid |
mittemetalliaatomid |
molekulid |
metalliaatomid |
|
Osakeste |
elektrostaatilised jõud - iooniline side |
kovalentne side |
mitmesugused nõrgad jõud (van der Waals) |
|
|
Kõvadus |
suur |
suur |
väike |
NB! sõltub metallist |
|
Soojusjuhtivus tahkes olekus |
väike |
tavaliselt väike |
väike |
suur |
|
Elektrijuhtivus tahkes olekus |
isolaator |
isolaator |
isolaator |
juht |
|
Elektrijuhtivus vedeles olekus |
juht |
isolaator |
isolaator |
juht |
|
Elektrijuhtivus vesilahuses |
juht |
- |
- |
- |
|
Sulamistemperatuur |
suhteliselt kõrged |
väga kõrged |
madalad |
NB! sõltub metallist |
|
Agregaatolek toatemperatuuril |
tahke |
tahke |
valdav enamus gaasilised |
tahked (välja arvatud Hg) |
|
Näiteid |
soolad, aktiivsete metallidele vastavad |
teemant (C) |
valge fosfor( P4) He, Cl2, O2, I2, Br2, F2, CH3OH, CH3COOH, H2SO4 jt. |
metallid, metallide sulamid |

