5.9. Fosfor ja fosforiühendid
Esmakordselt sai fosforit 1669. aastal saksa keemik Henning Brandt. Otsides võimalust saada elueliksiiri ja filosoofilist kivi, avastas ta helendava aine fosfori (ta lähtus uriinist, kuumutas selle aurustumisjääki koos söe ja liivaga). Pikemat aega püüti seda meetodit hoida saladuses, sest demonstreerides helendavat fosforit kõrgemale seltskonnale oli võimalik teenida raha. Selle, et fosfor on element, tõestas korrektselt Lavoisier. Fosfor on kreeka keeles "valgusekandja". Looduses kuulub fosfor küllalt levinud elementide hulka, kuid lihtainena looduses ei esine, esineb põhiliselt kaltsiumfosfaadina (Ca3(PO4)2). Fosfor on tähtis bioelement, sest kuulub valkude ja teiste elutegevuses oluliste ühendite koostisse. Luudes ja hammastes sisalduv kaltsiumfosfaat annab neile tugevuse. Hammastes on kõige rohkem mineraali Ca10(PO4)6(OH)2, mida võib lihtsustatult vaadata kui kahest ainest koosnevat mineraali – Ca3(PO4)2 + Ca(OH)2. Happeliste jookide joomisel toimuvad erinevad reaktsioonid, nt Ca(OH)2 + 2H+ → Ca2+ + 2H2O. Selle tulemusel hambavaap laguneb ja tekivad augud.
Pesemisvahendites kasutatakse leelismetallide fosfaate, polüfosfaate ning peroksofosfaate. Vee pehmendajad – polüfosfaadid – moodustavd Ca2+- ja Mg2+-ioonidega kelaatseid komplekse, takistades katlakivi teket. Põhiosa toodetavatest fosfaatidest leiab rakendust fosforväetistena. Üks enim kasutavaid ja odavamaid fosforiväetisi on superfosfaat.
Fosfori allotroobid
Fosforil on erinevaid allotroope (vaata jooniseid 1 ja 2), enamik neist on polümeersed, kus P-aatomid on ühinenud P2, P4 ning P2∞ molekulideks. Tuntumad neist on kolm: valge fosfor (P4), punane fosfor (P2∞) ning must fosfor.
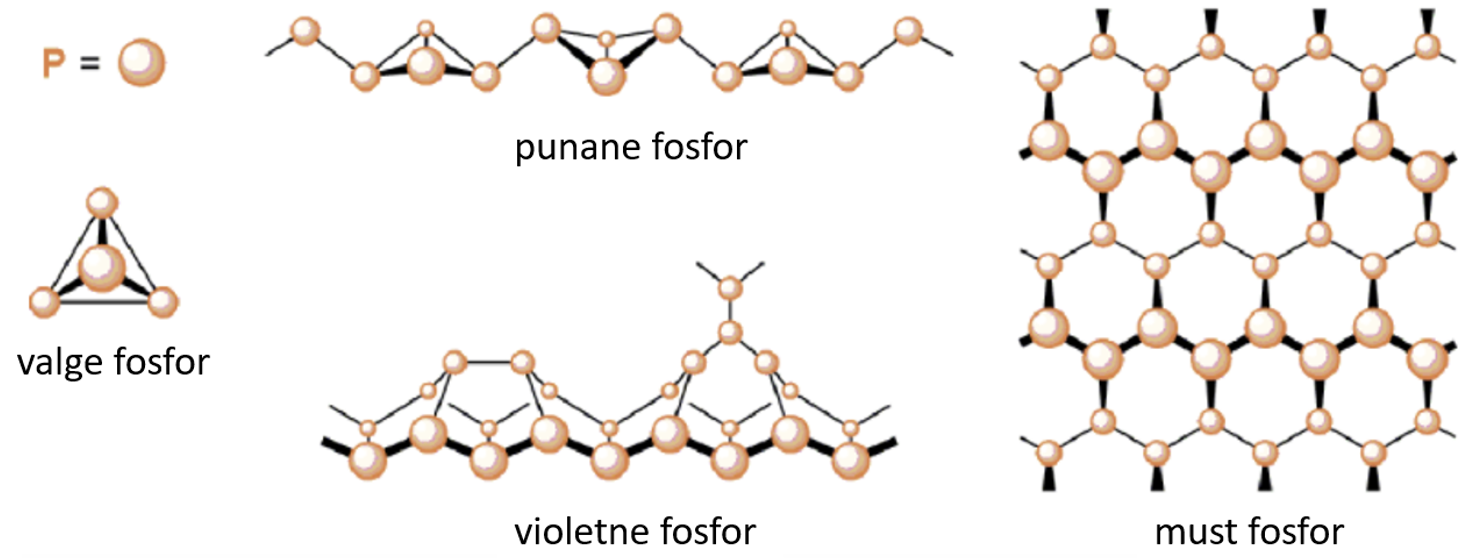
Joonis 1. Valge, punase, violetse musta fosfori struktuurid. Allikas: https://www.semanticscholar.org/paper/Fundamental-Chemistry-Involving-Phosphorus(I)-and-Binder/b338e6574838832e09e2fa8bddd8901ca3c2fe15/figure/9

Joonis 2. Fosfori allotroobid valge, punane, violetne ja must fosfor. Allikas: https://en.wikipedia.org/wiki/Phosphorus#/media/File:PhosphComby.jpg
Valge fosfor on molekulaarne aine, mille võre sõlmpunktides on fosfori P4 molekulid. Võre meenutab teemandi struktuuri. Lihtaine helendab pimedas. Valge fosfor vees ei lahustu, kuid lahustub hästi mõnedes orgaanilistes lahustites. Valget fosforit hoitakse vee all (ei reageeri veega), sest õhu käes ta oksüdeerub ning võib süttida põlema (süttimistemperatuur 50 oC). Pikemal hoidmisel muutub valge fosfor punaseks fosforiks. Kuumutamisel on üleminek kiire. Nahale sattumisel tekitab fosfor raskesti paranevaid haavandeid. Fosfor ei juhi elektrit. Puhtal valgel fosforil on värvusetud läbipaistvad kristallid, mis murravad valgust. Valguse käes õhuhapniku toimel muutub valge fosfor kiiresti kollaseks vahataoliseks massiks, osaliselt oksüdeerudes, osaliselt muutudes punaseks fosforiks. Nõrkade molekulidevaheliste jõudude tõttu on madala sulamistemperatuuriga - Tsul on 44,1 oC, lendub kergesti, on noaga lõigatav ning iseloomuliku lõhnaga.
Punane fosfor tekib valge fosfori kuumutamisel õhu juurdepääsuta 300 - 400 oC-ni ning rõhu all. Punane fosfor on stabiilsem kui valge fosfor. Puhas punane fosfor praktiliselt ei ole mürgine. Punane fosfor oksüdeerub palju halvemini kui valge fosfor – süttib alles temperatuuril 250 oC, ei helenda pimedas. Puhas amorfne punane fosfor pole väga tuleohtlik, kuid lisandid ning hõõrdumine võivad süttimist soodustada. Ei juhi elektrit. Sulamistemepratuur on varieeruv: 585 - 600 oC. Punase fosfori üleviimisel vedelasse olekusse on vajalik osade sidemete lõhkumine. Näiteks temperatuuril 423 oC sisaldab fosfori aur P2 molekule, mis moodustavad kohe P4 molekulid.
Punane fosfor on tikutoosi süütepinna põhiline koostisaine (P, KClO3, MnO2 jt). Tiku hõõrdumisel mööda süütepinda tekib veidi valget fosforit, mis süttides süütab põlema ka tiku.
Must fosfor tekib valge fosfori kuumutamisel 200 oC juures väga kõrgel rõhul (~ 1200 MPa) või kuumutamisel 400 oC kraadi juures katalüsaatori juuresolekul. Struktuurilt on must fosfor lähedane grafiidile – kihiline, pooljuht, hea soojusjuht ja korrapärase struktuuriga. Siksakkihid on ühendatud van der Waalsi jõududega. Must fosfor on fosfori allotroopidest keemiliselt kõige passiivsem.
Fosfori keemilised omadused
Fosfor on lämmastiku elektronanaloog: 1s22s22p63s23p3, kus väliskihis on 5 elektroni, millest 3 on paardumata. Seega fosfor võib okteti saavutamiseks liita 3 elektroni või loovutada kolm kuni viis elektroni. Üldiselt moodustab ühendeid, kus on 3 või 5 polaarset kovalentset keemilist sidet.
Fosfor on palju aktiivsem kui lämmastik, sest sidemed P4 molekulis on nõrgemad kui kolmikside lämmastikumolekulis. Mittemetallidega reageerimisel (need, mis on mittemetallisemad fosforist) käitub kui redutseerija ning reageerimisel vesiniku ning metallidega kui oksüdeerija (vaata joonist 3).
Metallidega reageerimisel tekivad fosfiidid. Fosfiidid on ühendid, kus fosfori oksüdatsiooniaste on –III. Reaktsioonid toimuvad kõrgemal temperatuuril.
3Na + P → Na3P naatriumfosfiid
4P + 5O2 → P4O10 tetrafosfordekaoksiid
2P + 5Cl2 → 2PCl5 fosforpentakloriid
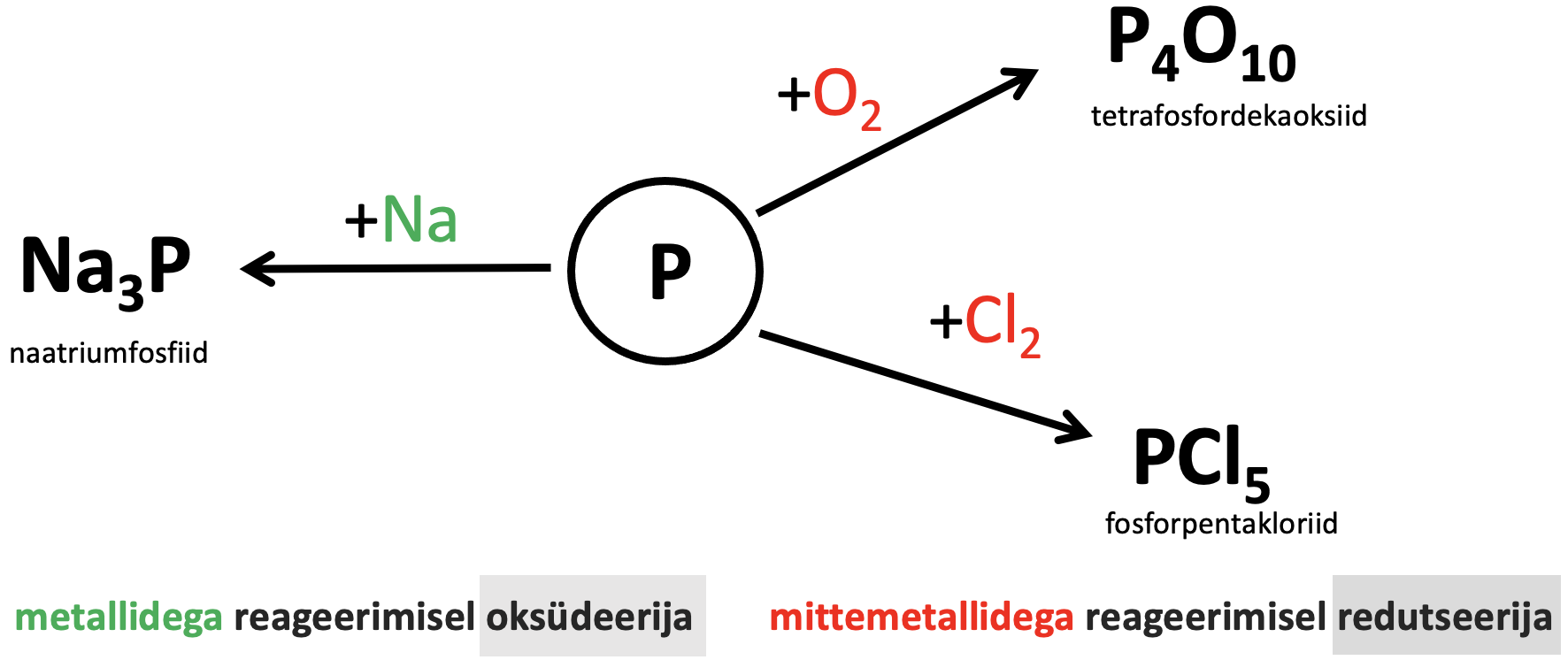
Joonis 3. Fosfori keemilised omadused
Vaatame nüüd fosfori tähtsamaid ühendeid.
Fosfori oksiid P4O10 (P2O5)
Fosfor reageerib hapnikuga ning selle tulemusena võivad tekkida erinevad oksiidid. Hapniku vaeguses tekib fosfor(III)oksiid. Tetrafosfordekaoksiid tekib fosfori põlemisel, kui hapnikku on piisavalt. Valge fosfor põleb ilma süütamata, põlemine jätkub isegi vee all – seetõttu kasutatakse seda sageli süütajana. Praktikas tekib tavaliselt P4O10 ning P4O6 oksiidide segu. Valge fosfori aeglasel oksüdatsioonil eraldub energia valgusena (aurude aeglane oksüdatsion õhus) – fosfor helendab. Aeglane oksüdatsioon võib kergesti üle minna aktiivseks põlemiseks.
4P + 3O2→ 2P2O3 esinevad dimeeridena 4P + 3O2→ P4O6
4P + 5O2→ 2P2O5 esinevad dimeeridena 4P + 5O2→ P4O10
Tetrafosfordekaoksiid koosneb enamasti P4O10 molekulidest, kuid ta võib moodustada ka suuremaid polümeerseid molekule. Praktikas märgitakse sageli aine valem lihtsustatult P2O5, mis tähistab selle ühendi kvantitatiivset koostist, mitte molekuli ehitust.
P4O10 on valge tahke aine, mis seob tugevasti õhuniiskust ja vett, mistõttu kasutatakse seda näiteks ainete kuivatamisel.
Veega reageerimisel, kui vett on piisavalt, tekib tetrafosfordekaoksiidist fosforhape (H3PO4):
P4O10(t) + 6H2O(v) → 4H3PO4(l)
Happelise oksiidina regeerib aluste ja aluseliste oksiididega.
P4O10(t) + 12NaOH(l) → 4Na3PO4(l) + 6H2O(v)
P4O10(t) + 6Na2O(t) → 4Na3PO4(t)
Fosforhape H3PO4
Fosforhape reageerib aluste, aluseliste oksiidide ja metallidega.
Fosforhape on valge kristalne aine, mis lahustub vees hästi. Ta on keskmise tugevusega hape ja dissotsieerub vesilahuses tavatingimustes vaid osaliselt, loovutades vaid ühe prootoni (H+).
H3PO4⇆ H+ + H2PO4-
Teist ja kolmandat prootonit (H+) annab ära raskesti.
Fosforhape reageerib aluste, aluseliste oksiidide ja metallidega.
H3PO4(l) + 3NaOH(l) → Na3PO4 + 3H2O(v)
2H3PO4(l) + 3Na2O(t) → 2Na3PO4(l) + 3H2O(v)
2H3PO4(l) + 3Na(t) → 2Na3PO4(l) + 3H2(g)
Reageerib ka mõnede sooladega.
Na2CO3(t) + H3PO4(l) ⇆ Na2HPO4(l) + CO2(g) +H2O(v)
Ülesande 1 lahendused
1.1. P4O10 on happeline oksiid, mis seob väga tugevalt vett. Arvuta mitu grammi vett seob 25 g tetrafosfordekaoksiid? Vastus anna üks koht peale koma.
Vastus: 25 g tetrafosfordekaoksiidi seob 9,5 g vett.
Lahendus: kirjutame ja tasakaalustame P4O10 ja vee vahelise reaktsiooni:
P4O10 + 6 H2O → 4 H3PO4
Tuleb leida P4O10 moolide arv, selleks leiame esmalt molaarmassi.
M(P4O10) = 284 g/mol
\(n(P_4O_{10})= {m \over M}={25g \over 284 g/mol}=0.088mol\)
Reaktsioonivõrrandist näeme, et P4O10 ja vee moolsuhe on 1:6. Seega on seotava vee moolide arv 0,088×6=0,528 mol. Arvestades, et vee molaarmass on 18 g/mol, leiame selle veekoguse massi:
m(H2O) = n × M = 0,528 mol × 18 g/mol = 9,504 ≈ 9,5 g
1.2. Fosfor reageerib hapnikuga, mille tulemusena tekib P4O10. Mitu grammi tetrafosfordekaoksiidi tekib 62g fosfori reageerimisel 3 mooli hapnikuga? Vastus anna täisarvuna.
Vastus: Tetrafosfordekaoksiidi tekib 142 g
Lahendus: kirjutame ja tasakaalustame fosfori ja hapniku vahelise reaktsiooni:
4 P + 5 O2 → P4O10
Esmalt tuleb leida fosfori moolide arv, arvestades, et fosfori molaarmass on 31 g/mol:
\(n(P)= {m \over M}={62g \over 31g/mol}=2mol\)
Reaktsioonivõrrandist näeme, et fosfori ja hapniku moolsuhe on 4:5. Seega 2 mooli fosforiga reageerib 2 × 5 / 4 = 2,5 mooli hapnikku ja teeme arvutused fosfori moolide arvu järgi, sest hapnikku on ülehulgas. Fosfori ja P4O10 moolsuhe on 4:1, seega tekib P4O102 × 1 / 4=0,5 mol. Arvestades, et M(P4O10) = 284 g/mol, leiame selle massi:
m(P4O10) = n × M = 0,5 mol × 284 g/mol = 142 g
1.5. 200 g 20% H3PO4-lahusele lisati 400g vett. Milline on fosforhappe sisaldus lahuses peale vee lisamist (arvuta lahuse massiprotsent)? Vastus anna üks koht peale koma.
Vastus: Fosforhappe sisaldus lahuses on: 6,7%
Lahendus: esmalt leiame H3PO4 massi alglahuses. Lahust on 200 g ja 20% sellest H3PO4, mille mass on seega 0,2×200 g = 40 g.
Alglahusele lisatakse juurde 400 g vett, seega on lahuse lõppmass 200 + 400 = 600 g. Lõpplahuse massiprotsent on:
\(P(H_3PO_4)= {40g \over 600g}*100=6.66...≈6.7\)%

