5.3. Mittemetallide üldiseloomustus
Mittemetallilised elemendid moodustavad ligikaudu 1/3 perioodilisustabeli keemilistest elementidest, jäädes tabeli parempoolsesse ülemisse nurka (vaata joonist 1).
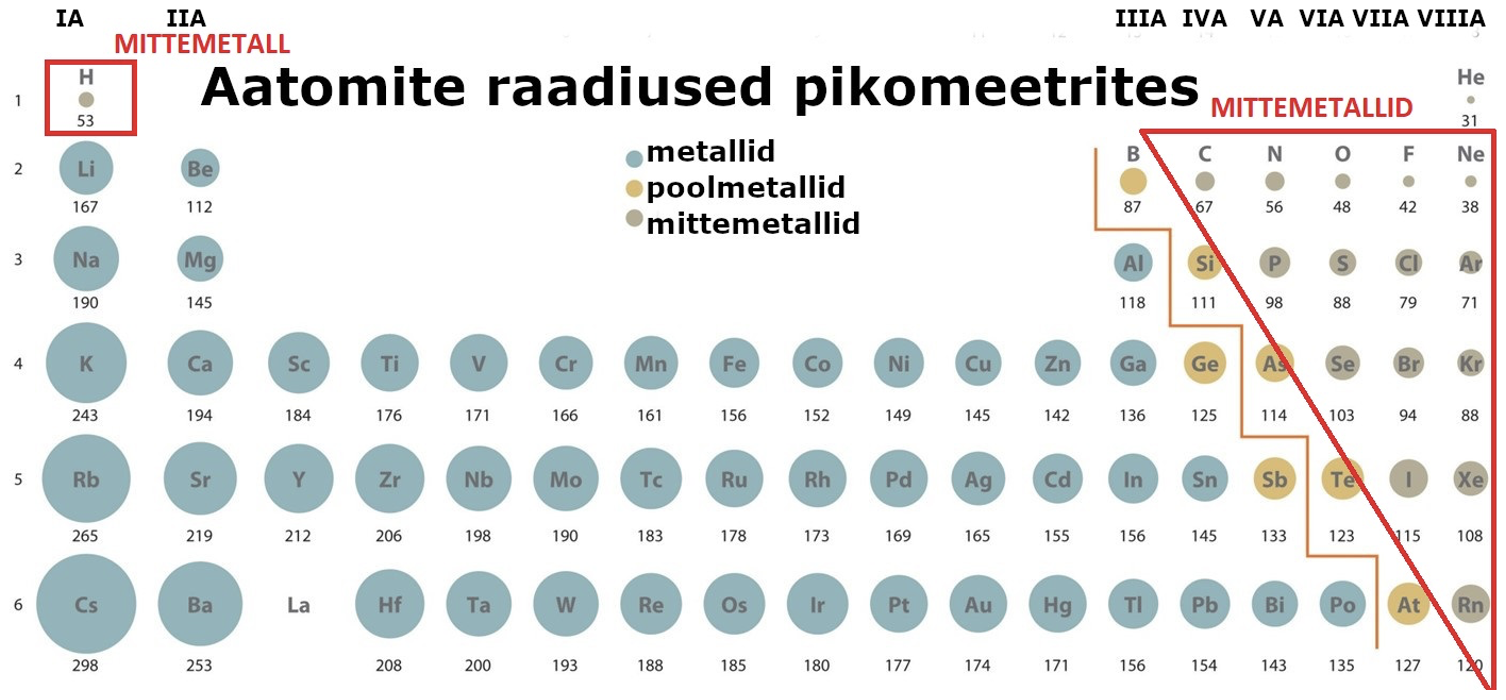
Joonis 1. Aatomite raadiused pikomeetrites. Punase piirjoonega on märgitud mittemetallilised elemendid
Mittemetallide struktuur ja füüsikalised omadused
Mittemetallides on aatomid omavahel seotud kovalentsete sidemetega (v.a väärisgaasid). Võrreldes metallidega on mittemetallide omadused märgatavalt varieeruvad. Nende seas on nii gaasilisi (H2, N2, O2, Cl2, F2) kui ka tahkeid aineid (B, Si, P4, S8, I2 jt). Ainult üks neist – broom (Br2) – on tavatingimustes pruun vedelik. Perioodilisuse tabelis rühmas ülevalt alla suurenevad aatomite mõõtmed, samuti suurenevad ainete molekulide mõõtmed. Seetõttu muutub agregaatolek perioodilisuse tabelis rühmas ülevalt alla gaasilisest tahkeks.

Joonis 2. VII A rühmas on halogeenid, kus kloor on gaasiline, rühmas allpool leiame tahke joodi. Allikad: https://www.chemistryworld.com/podcasts/chlorine/3005734.article ja https://et.wikipedia.org/wiki/Jood#/media/Fail:Iod_kristall.jpg
Agregaatoleku muutusega perioodilisuse tabelis muutub ka mittemetallide sulamistemperatuur. Molekulaarsed mittemetallid moodustavad tahkes olekus molekulvõre (joonis 3). Molekulidevahelised jõud hoiavad molekulide kristallivõre koos. Kristallivõres on sidemed seda nõrgemad, mida väiksemad on molekulid. Sellised mittemetallid on tavatingimustes gaasilises olekus, näiteks H2, Cl2, O2. Suuremate molekulidega mittemetallid on tavatingimustest tahked, kuid kuna molekulidevahelised sidemed ei ole väga tugevad, siis on need ained haprad ja suhteliselt madala sulamistemperatuuriga (näiteks väävel ja fosfor).
Ained, millel on aatomvõre (joonis 3), on suhteliselt kõrge sulamistemperatuuriga (teemant Tsul= 3642 oC, grafeen) ning samas haprad (nt süsiniku allotroop teemant).
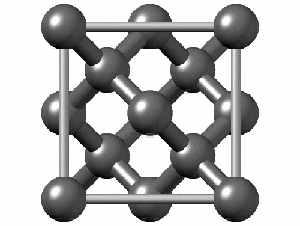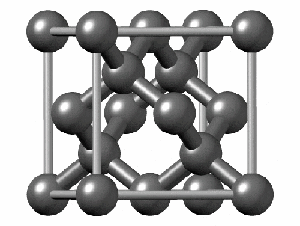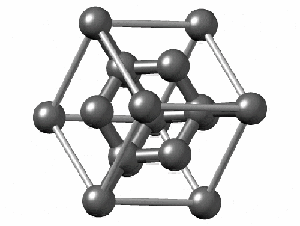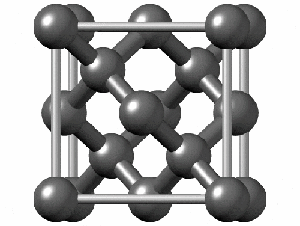
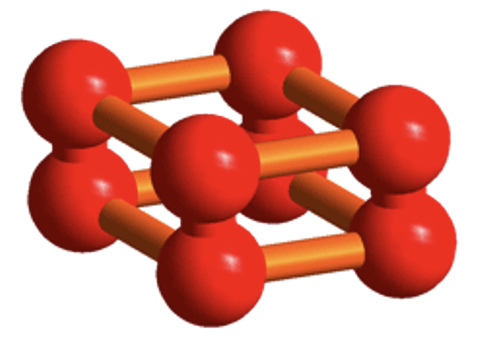
Joonis 3. Teemandil on aatomvõre ja ta on kõrge sulamistemperatuuriga. Paremal hapniku molekulvõre, kus on näha kristallvõre servades hapniku molekulid. Selline tahke hapnik saab eksisteerida väga madalal temperatuuril.
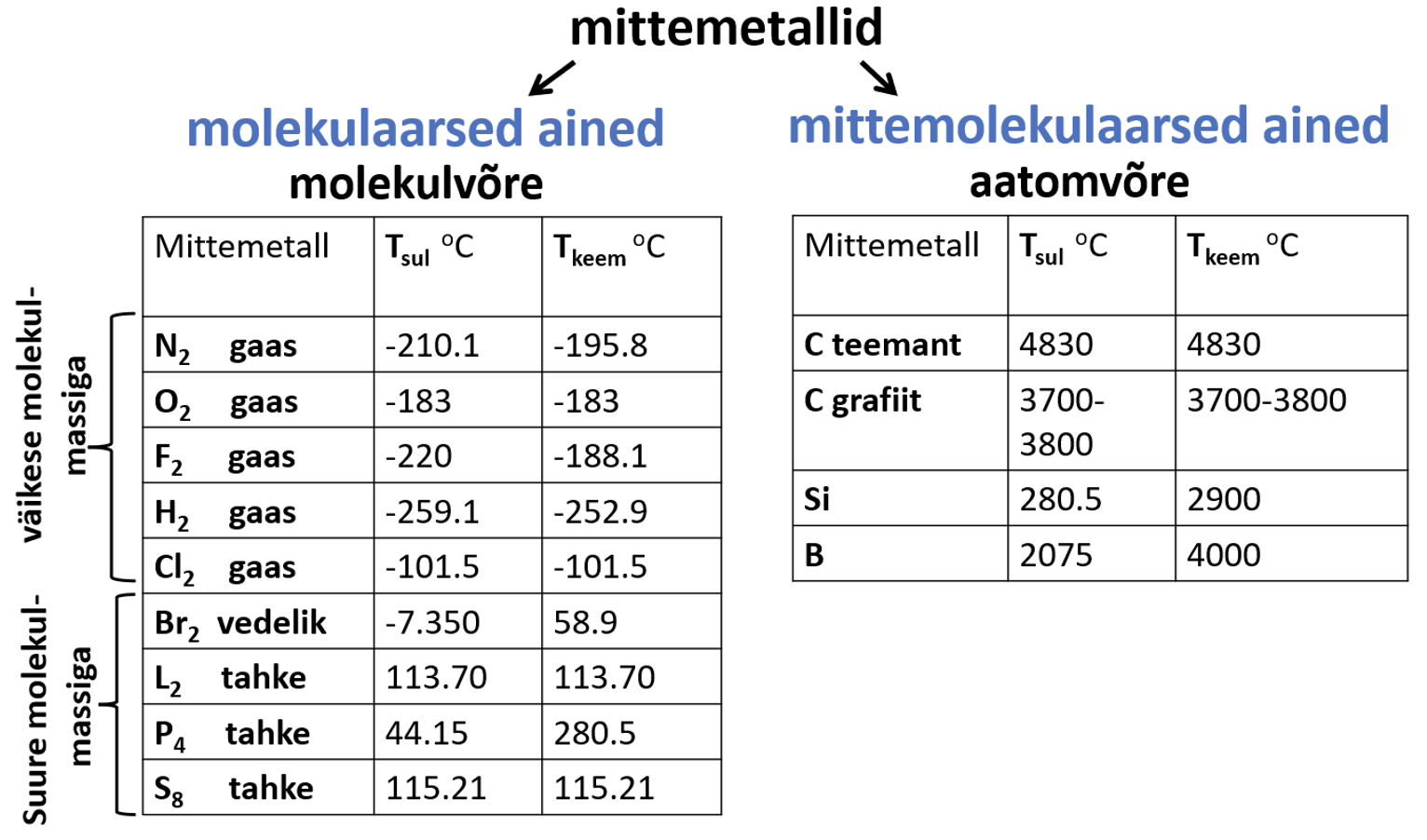
Tabel 1. Levinumate mittemetallide sulamis-ja keemistemperatuurid.
Allotroopia
Paljud mittemetallid moodustavad erineva ehituse ja omadusega lihtaineid. Sama elemendi erinevaid lihtaineid nimetatakse allotroopideks. Eristatakse kolme tüüpi allotrioopiat.
1. Molekulis on erinev arv sama elemendi aatomeid, näiteks hapnik ja osoon:

2. Molekulide erinev paigutus kristallis. Näiteks rombiline ja monokliinne väävel.

3. Mittemolekulaarsed allotroobid, milles on aatomite paigutus kristallvõres erinev, näiteks teemant ja grafiit:

Allikas: https://commons.wikimedia.org/wiki/File:Diamond_and_graphite2.jpg
 Loe lisaks: Ainete levinumad allotroobid.
Loe lisaks: Ainete levinumad allotroobid.
Fosfori erinevaid vorme on 7, tuntumad neist on valge, punane ja must fosfor (joonis 4). Puhtal valgel fosforil on värvusetud läbipaistvad kristallid, mis murravad valgust. Valguse käes muutub valge fosfor õhuhapniku toimel kiiresti kollaseks vahataoliseks massiks, muutudes osaliselt punaseks fosforiks. Punane fosfor on fosfori aatomitest koosnev polümeerne aine – Pꝏ, valge fosfor koosneb nelja-aatomilistest molekulidest – P4. Valge fosfor on mürgine ja väga reaktsioonivõimeline, mistõttu teda hoitakse vee all pimedas, sest veega ta ei reageeri. Valge fosfor oksüdeerub õhu käes kiiresti, helendab ning tekitab nahale sattudes raskesti paranevaid haavandeid. Teised fosfori allotroobid nii ohtlikud ja keemiliselt aktiivsed ei ole.
Süsinik võib moodustada mitmeid erineva ehituse ja erisuguste omadustega allotroopseid teisendeid, millest tuntumad on grafiit, teemant, karbüün ja fullereenid. Enamik süsiniku allotroope on hallika värvusega või mustad.

Joonis 4. Mõningate mittemetallide värvused
Grafiit on tumehall, metallile iseloomuliku läikega kristalne aine. Ta koosneb üksteisega nõrgalt seotud süsinikuaatomite kihtidest ja on seetõttu üsna pehme, lõhenedes kergesti kihtideks. Selle omaduse tõttu kasutatakse grafiiti pliiatsisüdamike ja määrdeainete valmistamisel. Grafiit juhib elektrit, sest väliskihi elektronid saavad kihi piires liikuda – side grafiidis meenutab veidi metallilist sidet. Grafiidi struktuur on toodud joonisel 5.

Joonis 5. Grafiidi struktuur. Mustad pallid struktuuris on süsinikuaatomid.
Laboritingimustes on võimalik grafiiti tekitada suhkrule (C11H22O11) kontsentreeritud väävelhappe lahuse lisamise teel, mille tulemusena tekib süsinik, vesi, süsinikdioksiid ja vääveldioksiid. Söestunud suhkru pilt on toodud joonisel 6.

Joonis 6. Söestunud suhkur
Paljud gaasilised mittemetallid on värvusetud (lämmastik, hapnik, väärisgaasid jt). Üksikutel esineb ka eriline värvus: kloor on rohekaskollane, broomiaurud on punakaspruunid. Jood (I2) on toatemperatuuril tahke aine (vaata joonist 4) ja meenutab välimuselt metalli, aga joodiaurud on ka lillakad (vaata joonist 7).

Joonis 7. Joodiaurud
Enamik mittemetalle ei juhi elektrit, kuid leidub erandeid – süsiniku allotroop grafiit juhib hästi elektrit.

