5.7. Väävel ja väävliühendid
Väävlil esineb mitmeid erinevaid allotroopseid teisendeid. Kõige püsivam tavatingimustel koosneb kaheksa-aatomilistest molekulidest, S8, milles väävliaatomid on seotud siksakiliseks rõngaks (joonis 1). Seda nimetatakse ka rombiliseks väävliks. Toatemperatuuril on väävel kollane ja rabe kristalne aine.

Joonis 1. Vasakul on rombiline väävel ja paremal nõeljatest kristallidest moodustunud monokloiinne väävel
Enamasti esineb rombliline väävel peenekristallilise pulbrina, kuid eritingimustel on võimalik saada suuri väävlikristalle. Kõrgemal temperatuuril on püsiv monokliinne väävel. Tahkis koosneb nõeljatest kollastest kristallidest (joonis 1).
Väävli keemilised omadused
Väävel käitub kuumutamisel oksüdeerijana metallide ja vähem aktiivsete mittemetallidega ning redutseerijana aktiivsemate mittemetallidega.
Väävel on suhteliselt aktiivne mittemetall, mis võib reageerida paljude metallide ja mittemetallidega. Oksüdeerijana käitub väävel kuumutamisel paljude lihtainetega (metallide ja vähemaktiivsete mittemetallidega) ja tekivad sulfiidid.
H2 + S $\xrightarrow[]{temp}$ H2S
2Na + S → Na2S
Väävel käitub redutseerijana kuumutamisel aktiivsemate mittemetallidega (joonis 2).
Väävel põleb õhus sinaka leegiga, tekib kollane kergesti liikuv vedelik, mis reaktsioonisegu edasisel kuumutamisel muutub pruuniks venivaks massiks.

Väävel põleb sinaka leegiga S +O2 → SO2
Väävli keemilised omadused lihtainena võtab kokku joonis 2.
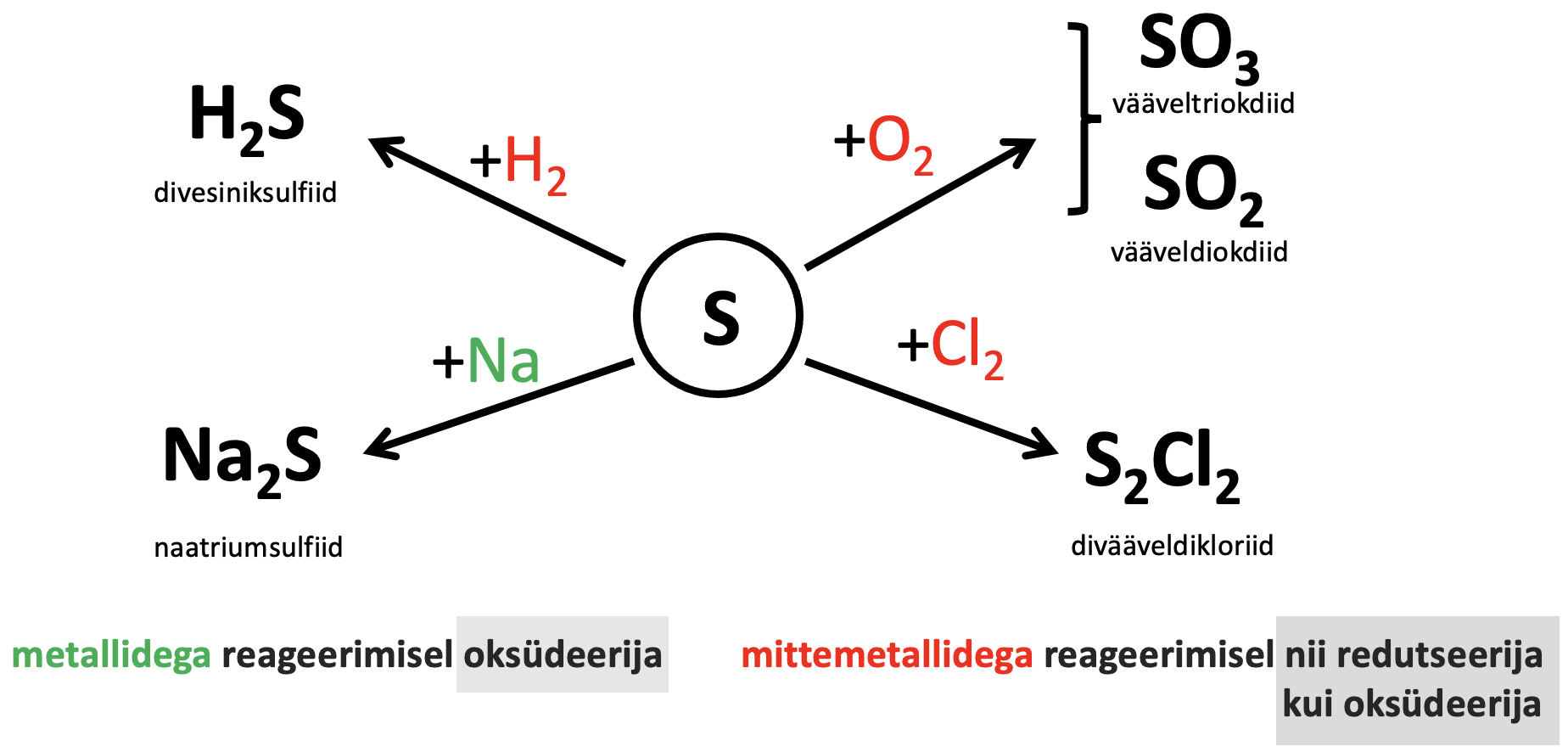
Joonis 2. Vääveli keemilised omadused
Järgnevalt vaatame üle väävli tähtsamad ühendid.
Organismis kuulub väävel põhiliselt valkude koostisse, kus S-H rühmitused tugevdavad valkude struktuuri. Raskmetallide mürgisus ongi põhiliselt seotud vesiniku eraldumisega valkude S-H rühmades (nende metallide side väävliga on tugev, vastavad sulfiidid on vähelahustuvad). Valkude sünteesil redutseeritakse vajalik väävel sulfaatidest. Valkude lagunemisel organismis tekivad tagasi sulfaadid. Organismi anaeroobsel kõdunemisel eraldub H2S. H2S-i oksüdeerumisel eralduvat energiat kasutavad oma elutegevuses väävlibakterid: 2H2S + O2 → 2H2O + 2S. Looduses esineb tasakaal sulfaatide ning sulfiidide vahel. Inimene rikub seda tasakaalu märgatavalt, tootes sulfiidsetest maakidest sulfaate.
Sulfiidid
Divesiniksulfiid H2S on väga mürgine. Ohtlikkust suurendab see, et tugevamal mürgistusel lõhnataju kaob. H2S on tugev redutseerija.
H2S + Br2 → 2 HBr + S
H2S + I2 → 2 HI + S
Divesiniksulfiidi saadakse sulfiidide reageerimisel tugeva happega:
Na2S + HCl → NaCl + H2S↑
Seda reaktsiooni kasutatakse sulfiidioonide (S2-) kindlakstegemiseks – tunda on mädamuna haisu.
Na2S naatrumsulfiid tekib NaOH reageerimisel H2S-ga.
NaOH + H2S ⇆ Na2S + H2O
Naatriumsulfiid lahustub vees ja reageerib sellega, tekitades aluselise keskkonna.
SO2 ja H2SO3
Väävli tuntumad ühendid oksüdatsiooniastmes IV on vääveldioksiid SO2 ja väävlishape H2SO3.
Vääveldioksiidi saadakse väävli põletamisel
S + O2 → SO2
Tekkiv SO2 on mürgine ja väga terava lõhnaga värvusetu gaas, mille vees lahustumisel tekib väävlishape:
SO2 + H2O ⇆ H2SO3
Sama reaktsioon toimub vääveldioksiidi sissehingamisel, tekkiv hape on söövitav. Väävlishapet kasutatakse desinfitseerimisvahendites.
Väävlishape laguneb ioonideks peamiselt I astmes ja on keskmise tugevusega hape.
H2SO3 ⇆ H+ + HSO3-
HSO3 - ⇆ H+ + SO32-
Sulfitid saavad olla nii oksüdeerijad kui ka redutseerijad.
Väävlishappe soolasid nimetatakse sulfititeks. Sulfitid saavad olla nii oksüdeerijad kui ka redutseerijad. Sulfitid oksüdeeruvad õhuhapniku toimel:
2Na2SO3 + O2 → 2Na2SO4
Tööstuslikult saadakse vääveldioksiidi püriidist (vaata ka metallide saamist püriidist).
4FeS2 + 11O2 → 8SO2 + Fe2O3
Laboratoorselt saadakse vääveldioksiidi sulfititele kontsentreeritud väävelhappe lisamise teel:
Na2SO3(t) +2H2SO4(konts) → 2NaHSO4(l)+ SO2↑ + H2O(v)
SO3, H2SO4
Hapet tuleb lahjendada valades hapet peene joana vette!
Väävli tuntumad ühendid oksüdatsiooniastmes VI on vääveltrioksiid (SO3) ja väävelhape (H2SO4). Tööstuslikult saadakse vääveltrioksiidi SO2 katalüütilisel oksüdeerimisel kõrgel temperatuuril.
2SO2+ O2 $\xrightarrow[]{temp}$ 2SO3
SO3 reageerimisel veega tekib väävelhape.
SO3 + H2O ⇆ H2SO4
Väävelhappe on värvuseta, lõhnata, veest ligikaudu kaks korda raskem õlitaoline väga viskoosne vedelik. Ta seguneb veega mistahes vahekorras, eraldades palju soojust. Hapet tuleb lahjendada, valades hapet peene joana vette.
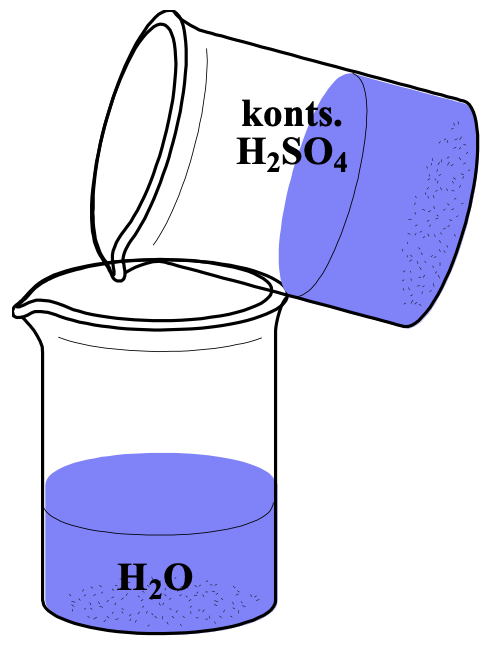
Joonis 3. Kontsentreeritud H2SO4 lahjendamine, valades hapet peene joana vette
Kontsentreeritud väävelhape on väga hügroskoopne (vett siduv) ja tugev oksüdeerija. Kontsentreeritud väävelhape reageerib metallidega, aga ei eraldu vesinikku.
2K + 2H2SO4 (konts) → K2SO4 + SO2 + 2 H2O
2Na + 2H2SO4 (konts) → Na2SO4 + SO2 + 2 H2O
Zn + 2H2SO4 (konts) → ZnSO4 + SO2↑ + 2 H2O
Lahjendatud väävelhappe reageerimisel metallidega on oksüdeerijaks H+-ioonid – eraldub H2.
Zn + H2SO4 → ZnSO4 + H2↑
Vesilahustes on H2SO4 tugev hape – tugevaim kaheprootoniline hape. Lahjades vesilahustes laguneb täielikult ioonideks.
H2SO4 → H+ + HSO4-
HSO4- → H+ + SO42-
Lahjendatud väävelhappe lahus reageerib veel aluseliste oksiidide, nõrga happe soolade ja alustega.
H2SO4(l) + Na2O(t) → Na2SO4(l) + H2O(v)
H2SO4(l) + Na2CO3(l) → Na2SO4(l) + H2O(v) + CO2(g)
3H2 SO4(l) + 2Fe(OH)3 → Fe2(SO4)3(l) + 6 H2O(v)
Ülesande 1 lahendused
1.1. Väävlivabaks nimetatakse kütust, mille väävlisisaldus on kõige rohkem 10 mg/kg. Autobensiini keskmine koostis vastab isooktaanile C8H12 (tihedus 0,75 kg/dm3). Arvuta vääveldioksiidi kogus kuup-detsimeetrites, mis paisatakse keskkonda sõiduauto ühe paagitäie (70 L) bensiini täielikul põlemisel (maksimaalse lubatud väävlisisalduse korral). Vastus anna kaks kohta peale koma.
Vastus: V(SO2) – 0,37 dm3
Lahendus: Esmalt tuleb leida maksimaalne väävli kogus paagitäies kütuses. Teame kütuse ruumala 70 l = 70 dm3 ja tihedust 0,75 kg/dm3, millest saame leida selle massi:
m(kütus)= V × ρ = 70 dm3 × 0,75 kg/dm3 = 52,5 kg
Kuna väävli maksimaalne sisaldus kütuses on 10 mg ühe kg kohta, siis 52,5 kilogrammis on seda 10 mg/kg × 52,5 kg = 525 mg = 0,525 g. Leiame selle väävlikoguse moolide arvu, arvestades, et M(S) = 32 g/mol:
\(n(S) ={ m \over M}={0.525g\over 32 g/mol}=0.0164mol\)
Kirjutame välja väävli täieliku põlemise reaktsiooni:
S + O2 → SO2
Kuna väävli ja vääveldioksiidi moolsuhe on 1:1, tekib vääveldioksiidi 0,0164 mol. Saame selle ainehulga ruumala leida:
V(SO2) = n × Vm = 0,0164 mol × 22,4 dm3/mol = 0,367 ≈ 0,37 dm3
1.2. 0,25 dm3 väävelhappe lahust sisaldas 0,5 mol H2SO4 (ρ = 1,12 g/cm3). Arvuta selle lahuse protsendiline koostis (massiprotsent). Vastus anna üks koht peale koma.
Vastus: Lahuse protsendiline koostis on: 17,5%
Lahendus: Massiprotsendi leidmiseks on vaja teada nii H2SO4 kui ka lahuse kogumassi. Leiame need.
H2SO4 mass: teame moolide hulka 0,5 mol ja saame arvutada molaarmassi M(H2SO4)=98 g/mol. Nende kaudu leiame massi:
m(H2SO4) = n × M = 0,5 mol × 98 g/mol = 49 g
Väävelhappe lahuse kogumass: teame ruumala 0,25 dm3=250 cm3 ja tihedust ρ = 1,12 g/cm3. Nende kaudu leiame massi:
m(lahus) = V × ρ= 250 cm3 × 1,12 g/cm3 = 280 g
Nüüd saame leida lahuse massiprotsendi:
\(P(H_2SO_4) = {m(H_2SO_4) \over m(lahus)}*100={49g \over 280g}*100=17.5\)%
1.3. Mitu grammi SO3 peab lahustuma vees, et saada 200g 25%-list väävelhappelahus? Vastus anna täisarvuna.
Vastus: Vees peab lahustama 41 g SO3
Lahendus: kirjutame ja tasakaalustame esmalt SO3 vees lahustumise võrrandi:
SO3 + H2O → H2SO4
Teame, et tuleb saada 25%-line väävelhappe lahus massiga 200 g. Kuna 25% sellest on väävelhape, on väävelhappe mass järelikult 0,25×200=50 g. Saame leida väävelhappe molaarmassi [M(H2SO4)=98 g/mol] ja seejärel moolide arvu:
\(n(H_2SO_4) ={ m \over M}={50g\over 98 g/mol}=0.51mol\)
Reaktsioonivõrrandi järgi on SO3 ja H2SO4 moolsuhe 1:1, seega peab ka SO3 hulk olema 0,51 mol. Saame arvutada molaarmassi M(SO3)=80 g/mol ja leida massi:
m(SO3) = n × M = 0,51 mol × 80 g/mol = 40,81 ≈ 41 g
1.5. 20 g väävlit reageeris rauaga, tekkis 20 g raud(II)sulfiid. Milline oli reaktsiooni saagis? Vastus anna üks koht peale koma.
Vastus: Reaktsioonisaagis on 36,4%
Lahendus: kirjutame ja tasakaalustame reaktsioonivõrrandi:
Fe + S → FeS
Teame, et reageeris 20 g väävlit, seega saame leida selle moolide arvu, arvestades, et M(S) = 32 g/mol:
\(n(S) ={ m \over M}={205g\over 32 g/mol}=0.625mol\)
Kuna väävli ja raud(II)sulfiidi moolsuhe on 1:1, pidanuks raud(II)sulfiidi teoreetiliselt tekkima samuti 0,625 mol. Leiame selle teoreetilise massi, arvestades, et M(FeS)= 88 g/mol:
m(FeS) = n × M = 0,625 mol × 88 g/mol = 55 g
Teame aga, et 55 g asemel tekkis 20 g, seega on reaktsiooni saagis:
\(P ={ 20g \over 55g}*100=36.36≈36.4\)%
1.6. Meditsiinis kasutatakse 10% väävlisalvi. Väävlisalv on vaseliini ja väävli segu. Mitu grammi väävlit peab lisama 250 g vaseliinile, et saada 10%-lise väävlisisaldusega salv? Vastus anna üks koht peale koma.
Vastus: 27,8 g väävlit on 250 g vaseliiniga segatud
Lahendus: Kuna vaseliinile lisatakse väävlit, mis moodustab väävlisalvi massist 10%, on vaseliini mass (250 g) seega 90% väävlisalvist. Seda teades saame leida väävlisalvi massi:
250 g –90%
x g –100%
\(m(salv) ={ 250g*100 \over 90}={ 250g\over 0.9}=277.78≈277.8g\)
Väävli massi saab nüüd leida, lahutades salvi massist vaseliini massi:
m(S)=277,8 - 250 = 27,8 g
1.7. 0,08 mooli gaasilist vesinikkloriidi juhiti naatriumsulfiidi lahusesse. Arvuta, mitu mooli ja mitu dm3 gaasilist divesiniksulfiidi eraldus normaaltingimustel (Vm=22,4 dm3/mol), kui reatsiooni saagis oli 75%. Vastus anna kaks kohta peale koma.
Vastus: 0,03 mooli; 0,67 dm3
Lahendus: kirjutame ja tasakaalustame reaktsioonivõrrandi:
Na2S + 2HCl → 2NaCl + H2S
Reaktsioonivõrrandist näeme, et HCl ja H2S moolsuhe on 2:1. HCl moolide arv on 0,08 mol, seega tekib H2S 0,08/2=0,04 mol. Kuna aga reaktsiooni saagis on 75%, on tegelik moolide arv 0,75×0,04=0,03 mol. Selle ruumala on:
V = n × Vm = 0,03 mol × 22,4 dm3/mol = 0,672 ≈ 0,67 dm3

