5.8. Lämmastik ja lämmastikuühendid
Lämmastik on tüüpiline mittemetalliline element elektronvalemiga 1s22s22p3. Mittemetalliliste omaduste poolest jääb lämmastik alla eelkõige fluorile ja hapnikule. Elektronvalemist on näha, et väliskihis on viis elektroni: kaks neist paardunud ja kolm üksikut. Ühendites moodustab tavaliselt kolm sidet, maksimaalselt saab lämmastik moodustada neli sidet (nt NH4+-ioonis). Kõige iseloomulikumad oksüdatsiooniastmed on III, 0 ning V. Lämmastik lihtainena on õhu põhikomponent (≈ 78%). Looduslikest mineraalidest on olulisemad Tšiili salpeeter (NaNO3), India salpeeter (KNO3) ning Norra salpeeter (Ca(NO3)2. Leidub nitraatidena enamasti mäestike jalamitel, kus on vähe sademeid ning kuhu mägedest sademetega kandub nitraate. Lämmastik kuulub elusorganismide valkude koostisse.
Loodust ja elukvaliteeti mõjutab olulisel määral lämmastikuringe. Loodusesse satuvad lämmastikühendid kas looduslikult või tehislikult väetiste kasutamise tõttu. Looduslikult tekib lämmastikoksiid (NO) äikese ajal õhuhapnikuga (O2) reageerides. Lämmastikdioksiid (NO2) reageerib veega ning tekib lämmastikhape (HNO3), mis satub vihmadega mulda.
Taimed ei ole võimelised omastama lämmastikku N2 molekulidest. Seda suudavad teha mügarbakterid (asotobakterid), mis muudavad õhus oleva lämmastiku taimedele kättesaadavaks. Taimed omastavad lämmastikku põhiliselt NH4+- või NO3--ioonidena. Kuna looduses peab esinema tasakaal, siis denitrifitseerivate bakterite toimel tekib nitraatidest uuesti N2. Lämmastikväetiste liigtarbimise korral on tasakaal rikutud: tõuseb mulla ning looduslike veekogude nitraatide jt lämmastikühendite sisaldus, mis põhjustab veekogude eutrofeerumist ja mürgiste nitritite ning nitraatide liigset kuhjumist taimedes.
Lämmastiku keemilised omadused
Lämmastik (N2) on värvustetu ja lõhnatu gaas, mis lahustub halvasti vees ning orgaanilistes lahustites. Lämmastiku molekul (N2) on suhteliselt suure püsivusega. Põhiosa lämmastikust esinebki lihtainena atmosfääris. Toatemperatuuril lämmastik praktiliselt teiste ainetega ei reageeri. Madala keemilise aktiivsuse tõttu kasutatakse lämmastikku inertse keskkonnana, näiteks elektripirnides, et hõõgniit kiirelt läbi ei põleks. Pirnides võiks kasutada ka väärisgaase (mida ka tehakse), kuid lämmastik on võrreldes väärisgaasidega palju odavam. Paljud reaktsioonid lämmastikuga toimuvad väga kõrgel temperatuuril, sageli üle 3000 oC, sest kolmiksideme lõhkumiseks lämmastikumolekulis tuleb kulutada palju energiat.
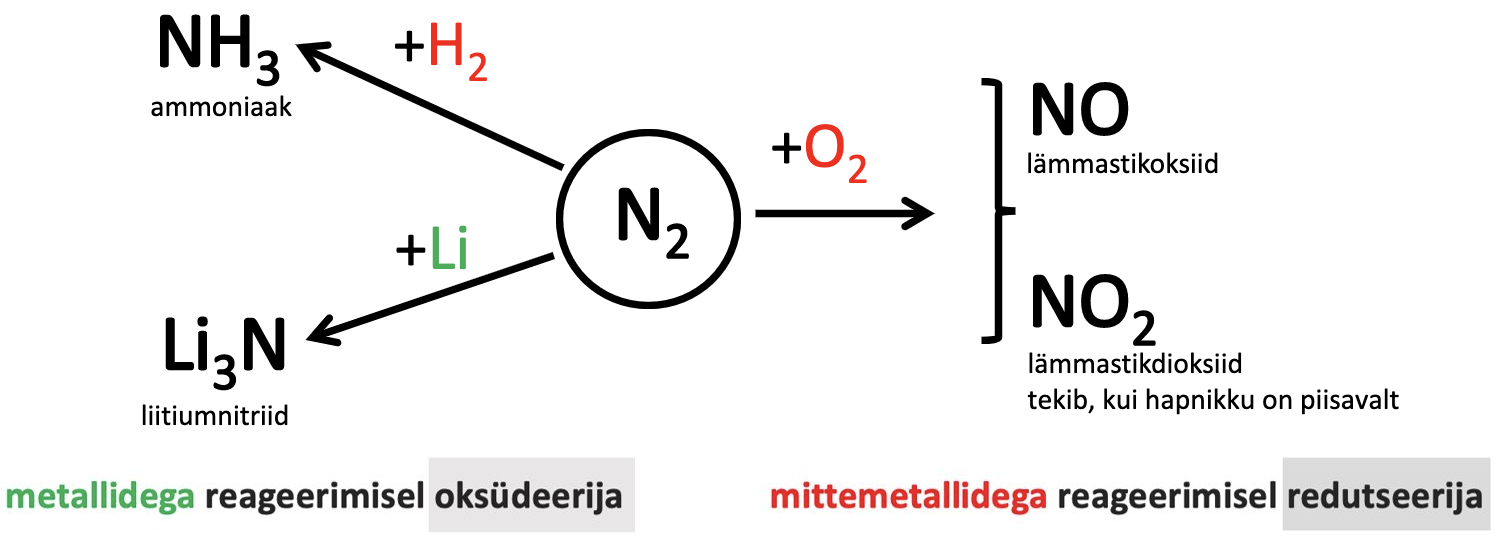
Joonis 1. lämmastiku keemilised omadused
Lämmastik on keemiliselt tavatingimustel väga inertne – lämmastiku püsivaim olek on N2 molekul. Toatemperatuuril reageerib lämmastik vaid liitiumiga, tekib liitiumnitriid.
6 Li +N2 → 2 Li3N.
Õhus kattubki Li pind oksiidi ning nitriidi segakihiga.
Vesinikuga reageerib lämmastik kõrgel temepratuuril ja katalüsaatorite juuresolekul.
N2 +3H2 $\xrightarrow[]{temp}$ 2NH3 ΔH = - 92 kJ/mol
Hapnikuga reageerimisel tekivad erinevad oksiidid:
N2 + O2 $\xrightarrow[]{temp}$ 2NO lämmastikmonooksiid - neutraalne oksiid
2O2 + N2 $\xrightarrow[]{temp}$ 2NO2 lämmastikdioksiid - happeline oksiid
 Loe lisaks: Lämmastiku laboratoorne saamine
Loe lisaks: Lämmastiku laboratoorne saamine
Laboratoorselt on võimalik lämmastikku toota (NH4)2Cr2O7 termilisel lagundamisel, saadustena tekivad N2, H2O ja rohekas Cr2O3.

Vulkaani katse. Ammooniumdikromaadi termilisel lagundamisel tekib värvustetu lämmastik, värvusetu veeaur ja roheks kroom(III)oksiid: (NH4)2Cr2O7 = N2 + 4H2O + Cr2O3.
Kasutada saab ka teiste soolade, nt NH4NO2 termilist lagundamist.
Vaatame üle lämmastiku tähtsamad ühendid.
Ammoniaak
Ammoniaak on üks tähtsamaid lämmastikuühendeid. Tavatingimustes on ammoniaak (NH3) värvusetu terava hingematva lõhnaga gaas. Õhust on ta ligi kaks korda kergem gaas. Vesiniksidemete tõttu, mis tekivad ammoniaagi ja veemolekuli vahel, lahustub ammoniaak hästi vees. Suuremate kontsentratsioonide korral on ta mürgine, kahjustab silmi ja tekitab hingamislihaste krampe. Väikeste koguste sissehingamisel mõjub ergutavalt. 10%-list ammoniaagi vesilahust nimetatakse nuuskpiirituseks ja kasutatakse minestuse korral. Limaskestale sattudes lahustub ja tekitab aluselise keskkonna.
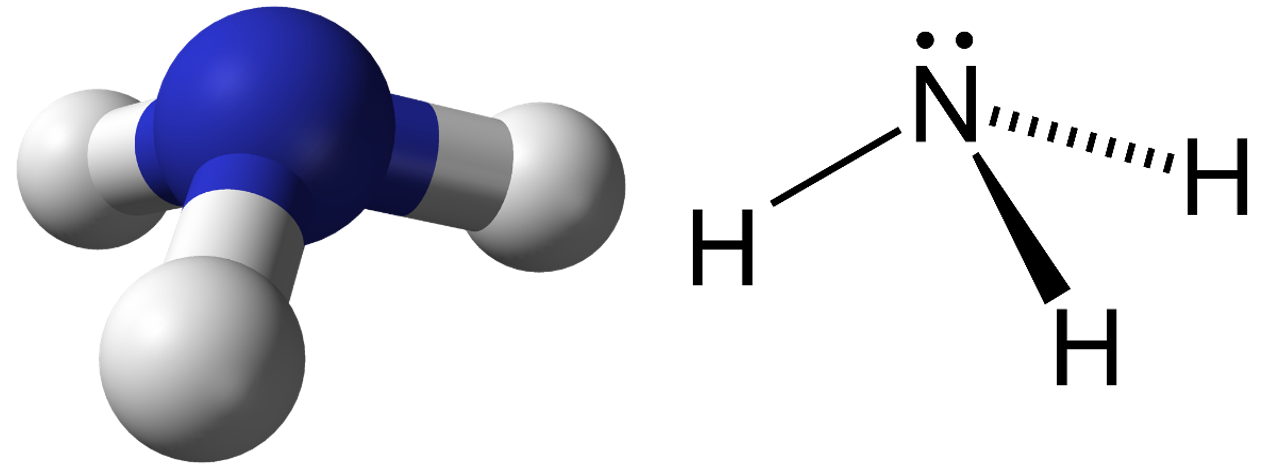
Ammoniaagi molekul. Allikas: https://en.wikipedia.org/wiki/Ammonia
NH3(g) + H2O(v) ↔ NH3×H2O (l)
NH3×H2O(l) ↔ NH4+(l) + OH-(l)
Tööstuslikult saadakse NH3 vesiniku ning lämmastiku reageerimisel kindlates tingimustes.
N2 + 3H2 $\xrightarrow[]{temp}$ 2 NH3↑
Laboratoorselt saadakse ammoniaaki nitriidide reageerimisel veega või ammooniumsooladele leelise lisamisel ning segu kuumutamisel.
NH4Cl(t) + KOH(l) $\xrightarrow[]{temp}$ KCl(l)+ NH3(g)+ H2O(v)
Ammoniaaki kasutatakse väetiste tootmiseks (ammooniumsoolad), karbamiidi sünteesiks, lämmastikhappe tootmiseks. Ammoniaagi vesilahus reageerib hapetega, selle tulemusena tekivad ammooniumsoolad, näiteks ammooniumsulfaat:
Alus + hape → sool + vesi
2NH3×H2O(l) + H2SO4(l) → (NH4)2SO4(l) + 2H2O(v)
Ammoniaak ja ammooniumsoolad on redutseerivate omadustega, redoksreaktsioonis tekib tavaliselt molekulaarne lämmastik (N2).
4NH3(g) + 3 O2(g) → 2N2(g) + 6H2O(g)
Ammooniumsoolad
Üldiselt on ammooniumsoolad värvusetud kristallilised ained, mis vees hästi lahustuvad. Tuntuimad esindajad on ammooniumkloriid (NH4Cl) – salmiaak, kasutatakse jootepastas redutseerijana või metallipindade puhastamiseks oksiidikihist enne jootmist. Ammooniumvesinikkarbonaat (NH4HCO3) ja ammooniumkarbonaat (NH4)2CO3 ehk põdrasarvesool leiab kasutust kergitusvahendina kondiitritööstuses küpsetuspulbrites. Küpsetuspulbri kasutamisel tekivad gaasilised ained, mis kergitavad tainast:
NH4HCO3 $\xrightarrow[]{temp}$ NH3 + H2O + CO2
Ammooniumsoolad nõrga aluse soolana vesilahuses mõnevõrra hüdrolüüsuvad, andes nõrgalt happelise keskkonna:
NH4+ + Cl- + H2O ⇄ NH3×H2O + H+ + Cl- (pН ligikaudu 4.5 – happeline keskkond)
Ammooniumsooladele leelise lisamisel ning kuumutamisel eraldub ammoniaak NH3.
NH4Cl + NaOH $\xrightarrow[]{temp}$ NaCl + NH3 ↑ + H2O
Seda reaktsiooni kasutatakse ka ammooniumioonide kindlakstegemiseks. Lenduv NH3 lahustub fenoolftaleiiniga immutatud paberis ja annab roosa värvuse.
Lämmastikoksiidid
Lämmastik moodustab hapnikuga mitmeid erinevaid oksiide. Tuntumad neist on lämmastikoksiid (NO) ja lämmastikdioksiid (NO2). NO on värvusetu ja lõhnatu mürgine gaas, mis vees praktiliselt ei lahustu ja veega ei reageeri, kuulub neutraalsete oksiidide hulka.
Ainsa lämmastikoksiidina võib tekkida vastavate lihtainete omavahelisel reaktsiooni kõrgel temperatuuril:
N2 + O2 $\xrightarrow[]{temp}$ 2NO
Lämmasikoksiidi tekib looduses äikese ajal, mõnevõrra ka automootoris jm. Looduses tekkival NO-l põhineb lämmastikuringe (NO → NO2 → HNO3).
Lämmastikoksiid oksüdeerub kergesti, kuid võib olla ka oksüdeerija.
NO2 on punakaspruun mürgine gaas. NO2 on keemiliselt aktiivne ja reageerib külma veega, moodustades kaks hapet.
2NO2 + H2O → HNO3 + HNO2 (lämmastikhape + lämmastikushape).
Happelise oksiidina reageerib NO2 nii aluste kui aluseliste ühenditega.
2KOH + 2NO2 → KNO3 + KNO2 + H2O
Lämmastikdioksiidi saadakse lämmastikoksiidi oksüdeerumisel: 2NO + O2 → 2NO2.
Lämmastikhape ja nitraadid
 Lämmastikhappe kohta loe lisaks siit.
Lämmastikhappe kohta loe lisaks siit.
HNO3 on värvusetu suitsev vedelik, väga tugev oksüdeerija ja tugev hape, mis reageerib paljude ainetega: metallid, aluselised oksiidid, alused jne.
Lämmastikhape on tugev hape, lahjas lahuses täielikult lagunenud ioonideks: HNO3 → H+ + NO3-.
Lämmastikhape reageerib aluste ja aluseliste oksiididega:
NaOH + HNO3 → NaNO3 + H2O
CaO + 2HNO3 → Ca(NO3)2 + H2O
Nitraadid on reeglina vees hästi lahustuvad soolad. Kuumutamisel käituvad aga tugevate oksüdeerijatena, seetõttu on plahvatusohtlikud ja kuuluvad paljude lõhkesegude koostisse. Näiteks NH4NO3 mõõdukal (200 oC) kuumutamisel tekivad N2O ning H2O. Kõrgemal temperatuuril võib laguneda plahvatusega (N2O on ebapüsiv).
 Loe lisaks: Nitraatide keemilised omadused
Loe lisaks: Nitraatide keemilised omadused
Kuumutamisel lagunevad erinevalt, olenevalt metalli aktiivsusest. Aktiivsemate metallide (leelismetallid, metallid metallide pingereas magneesiumist vasakul) nitraatide lagunemisel tekib nitrit, eraldub hapnik, vahesaadusena tekib atomaarne hapnik.
2 KNO3 $\xrightarrow[]{temp}$ 2 KNO2 + O2
Enamiku metallide (metallid metallide pingereas magneesiumist vaseni) nitraatide lagunemisel tekib metallioksiid, NO2, O2.
2Cu(NO3)2 $\xrightarrow[]{temp}$ 2CuO + 4NO2 + O2
2Zn(NO3)2 $\xrightarrow[]{temp}$ 2ZnO + 4NO2 + O2
4Fe(NO3)2 $\xrightarrow[]{temp}$ 2Fe2O3 + 8NO2 + O2
Mitteaktiivsete metallide (metallid metallide pingereas pärast vaske) nitraatide lagunemisel ei teki metallioksiidi, sest see on ebapüsiv, vaid tekib puhas metall.
2AgNO3 $\xrightarrow[]{temp}$ 2Ag + 2NO2 + O2
Hg(NO3)2 $\xrightarrow[]{temp}$ Hg + 2NO2 + O2
Ülesande 1 lahendused
1.1. Arvuta lämmastiku aatomite hulk (moolide arv) 5,6 dm3 lämmastikdioksiidis normaaltingimustel.
Vastus: Lämmastiku aatomeid on 0,25 mol.
Lahendus: Teades lämmastikdioksiidi ruumala normaaltingimustel, saame molaarruumala abil leida selle moolide arvu:
\(n(NO_2) = {V \over V_m}={5.6dm^3 \over 22.4dm^3/mol}=0.25mol\)
Lämmastikdioksiidi valemi NO2 põhjal teame, et ühes moolis NO2-s on üks mool lämmastiku aatomeid (PS! Mitte molekule, mille esituskuju on N2). Seega on 0,25 moolis lämmastikdioksiidis sama arv ehk 0,25 mooli lämmastikuaatomeid.
1.3. Nii ammooniumnitraati kui karbamiidi kasutatakse lämmastikväetisena. Arvuta mõlema aine lämmastikusisaldus massiprotsentides. Mitu korda erineb nende ainete lämmastikusisaldus?
Vastused: Lämmastikusisaldus protsentides ammooniumnitraadis on (vastus anda täisarvuna): 35%. Lämmastikusisaldus protsentides karbamiidis on (vastus anda täisarvuna): 47%. Karbamiidi lämmastikusisaldus erineb ammooniumnitraadis sisalduvast lämmastikusisaldusest (vastus anda kaks kohta peale koma): 1,34 korda.
Lahendus: lihtsuse mõttes teeme arvutused eeldusega, et meil on kumbagi ainet 1 mool.
Ammooniumnitraadi (NH4NO3) molaarmass on 80 g/mol, seega on ühe mooli aine mass 80 g. Lämmastiku aatomite massi leidmiseks tuleb lämmastiku molaarmass korrutada aatomite arvuga ühes molekulis. Valemi järgi näeme, et igas molekulis ammooniumnitraadis on kaks lämmastiku aatomit ja lämmastiku molaarmass on 14 g/mol. Seega on lämmastikuaatomite mass ühes moolis ammooniumnitraadis 2 × 14 g/mol × 1 mol = 28 g. Leiame nüüd massiprotsendi:
\(P(N) = {28g \over 80g}*100=35\)%
Karbamiidi (NH2CONH2) molaarmass on 60 g/mol, seega on ühe mooli aine mass 60 g. Analoogselt eelmise punkti arvutustega on ühes molekulis karbamiidis kaks lämmastiku aatomit, seega on lämmastikuaatomite mass ühes moolis karbamiidis 2 × 14 g/mol × 1 mol = 28 g. Leiame nüüd massiprotsendi:
\(P(N) = {28g \over 60g}*100=46.66...≈47 \)%
Karbamiidi lämmastikusisaldus erineb ammooniumnitraadis sisalduvast lämmastikusisaldusest 47% / 35% = 1,34 korda.
1.4. 5 mooli lämmastiku reageerimisel vesinikuga tekkis 2.5 mol ammoniaaki (NH3). Arvuta reaktasiooni saagise protsent.
Vastus: Reaktsiooni saagis on 25%
Lahendus: kirjutame ja tasakaalustame reaktsioonivõrrandi:
N2 + 3H2 → 2NH3
Reaktsioonivõrrandist näeme, et lämmastiku ja ammoniaagi moolsuhe on 1:2. Seega, kui reageeris 5 mooli lämmastiku, pidanuks tekkima 5×2=10 mooli ammoniaaki. Tekkis aga 2,5 mooli, seega on saagise protsent:
\(P = {2.5mol \over 10mol}*100=25\)%
1.5. Oled vanaisaga aiatarvete poes lämmastikväetist ostmas. Müügil on karbamiid (NH2CONH2) ühekilostes kottides, hinnaga 15 krooni kott ja ammooniumnitraat 2,5-kilostes kottides, hinnaga 25 krooni kott. Aita vanaisal otsustada, kumba väetist on kasulikum osta (näita arvutustega, kummas väetises sisalduv lämmastik tule odavam).
Lahendus: kasutame üle-eelmises ülesandes leitud lämmastikusisaldusi (karbamiid sisaldab 47% lämmastikku ja ammooniumnitraat 35%).
Ammooniumnitraati müüakse 2,5-kilostes kottides. Lämmastikusisaldus selles kotis on seega 0,35×2,5 kg = 0,875 kg = 875 g. Kui 875 g lämmastikku sisaldav ammooniumnitraat maksab 25 EEK, siis 1 g lämmastikku maksab:
\( {25EEK\over 875g}=0.0285≈0.029 EEK\)
Karbamiidi müüakse ühekilostes kottides. Lämmastikusisaldus selles kotis on seega 0,47×1 kg = 0,47 kg = 470 g. Kui 470 g lämmastikku sisaldav karbamiid maksab 15 EEK, siis 1 g lämmastikku maksab:
\( {15EEK\over470g}=0.0319≈0.032 EEK\)
Seega on lämmastiku grammihinna järgi odavam osta ammooniumnitraati.
1.6. 300g vees lahustati 40,3 L NH3 normaaltingimustel. Milline oli ammoniaagi massiprotsent lahuses? Vastus anna kaks kohta peale koma.
Vastus: Ammoniaagi massiprotsent lahuses on: 9,25%
Lahendus: Massiprotsendi leidmiseks on meil vaja leida ammoniaagi mass. Kuna ammoniaak juhitakse gaasina vette ja teame selle ruumala, saame molaarruumala kaudu leida selle moolide arvu:
\(n(NH_3) = {V \over V_m}={40.3l \over 22.4l/mol}=1.799mol\)
Nüüd saame lahuses sisalduva ammoniaagi massi leida, arvestades, et M(NH3) = 17 g/mol:
m(NH3) = n × M = 1,799 mol × 17 g/mol = 30,58 g
Lahuse kogumass on seega 300 + 30,58 = 330,58 g. Saame nüüd leida ammoniaagi massiprotsendi:
\(P(NH_3) = {30.58g \over330.58g}*100=9.25\)%

