3.4. Lahuste keskkond
Aluste ja hapete vesilahused on enamasti läbipaistvad. Kuidas saame neid siis üksteisest eristada? Siinkohal tulevad meile appi indikaatorid ning lahuste keskkond.
Allikas: https://youtu.be/YGIzUrZKzGQ
Lahus on ühtlane segu, mis koosneb lahustist ja vähemalt ühest seal lahustunud ainest, aga seda Sa juba teadsid. Lahuse keskkond võib olla happeline, aluseline või nende vahepealne ehk neutraalne. Happelist keskkonda põhjustavad vesilahuses olevad vesinikioonid (H+) ning aluselist keskkonda hüdroksiidioonid (OH−). Lahuse happelisuse või aluselisuse iseloomustamiseks kasutatakse suurust, mida nimetatakse pH. Lahuse pH väljendab vesinikioonide sisaldust lahuses. Vesilahuste korral jäävad pH väärtused vahemikku
0…14 ning pH-d saab kujutada skaalana, kus otspunktideks ongi 0 ja 14 ning keskkohaks 7.
Neutraalses lahuses on vesinikioone ja hüdroksiidioone sama palju ning neutraalse lahuse pH = 7. Neutraalne lahus on näiteks puhas vesi.
Happelises lahuses on vesinikioone rohkem kui hüdroksiidioone ning happelise lahuse pH < 7. Happeline lahus on näiteks söögiäädikas.
Aluselises lahuses on rohkem hüdroksiidioone kui vesinikioone ning aluselise lahuse pH > 7. Aluseline lahus on näiteks kanalisatsiooni puhastusvahend Torusiil.
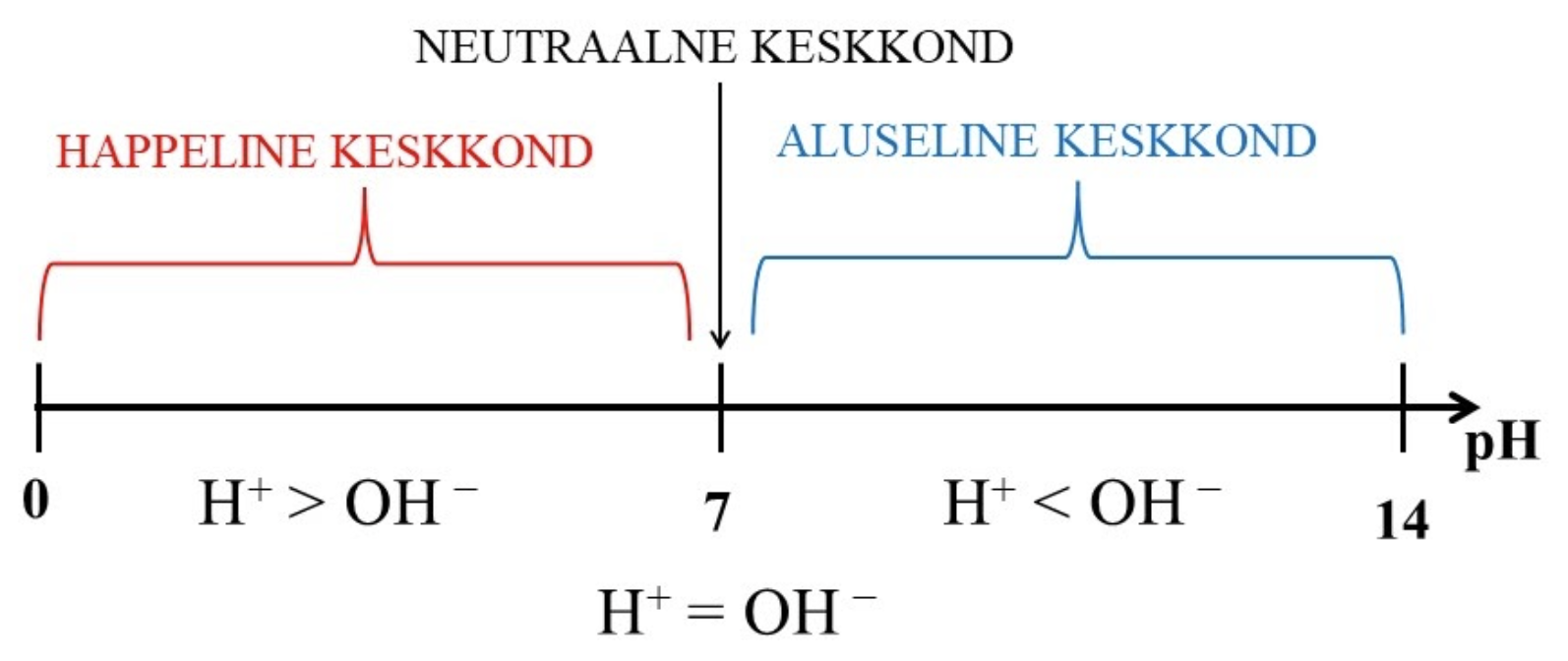
Siinkohal on oluline mõista, et mida väiksem on lahuse pH väärtus, seda happelisema lahusega on tegemist ja mida suurem on lahuse pH väärtus, seda aluselisem on lahus.
Kuidas määrata pH-d?
Lahuse pH määramiseks kasutatakse indikaatoreid. Indikaator on selline aine, mille värvus sõltub lahuse keskkonnast. Koolikeemias kõige kasutatavamad indikaatorid on metüüloranž, fenoolftaleiin ja universaalindikaator. Joonisel näed, millised on indikaatorite värvused erinevates keskkondades.
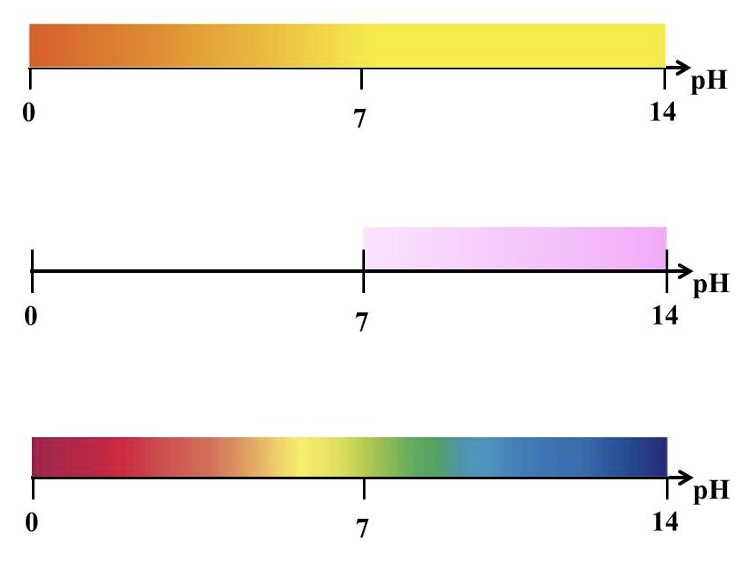
Üleval metüüloranž, keskel fenoolftaleiin ja all universaalindikaator
Universaalindikaatorit kasutades saad määrata lahuse ligikaudse pH, kuid pH täpsemaks määramiseks kasutatakse pH-meetrit – digitaalset seadet, mis mõõdab lahuse pH väärtuse.

