
3.2. Happed
Selles peatükis käsitleme järgmist anorgaanilise keemia aineklassi – happeid. mängivad meie igapäevaelus väga suurt rolli. Happeid leiad Sa nii puuviljadest, köögikapist kui ka majapidamisruumist.
Allolevast videost saad teada, kuidas happeid nimetada, kuidas happeid saada ning millised on hapete .
Allikas: https://youtu.be/aYWA4Od8nhU

Happed on aineid, mis annavad vesilahusesse vesinikioone (H+). Üks tuntuim hape on vesinikkloriidhape (HCl). HCl rahvapäraseks nimetuseks on soolhape. Vesinikkloriidhapet leidub maohappe koostises, kus tal on oluline roll toidu ja joogi keemilisel lagundamisel. HCl kasutatakse ka basseinivee puhastamisel ja erinevates puhastustoodetes.
Hapete juures tuleb silmas pidada, et mõned neist on väga söövitava toimega. Näiteks juba väike tilk väävelhapet söövitab riidesse suure augu.
Nimetamine ja valemite koostamine
Happed koosnevad vesinikust ja happejääkioonist. Selleks, et hapete valemite kirjutamine läheks ladusamalt, õpi selgeks tabelis 1 toodud happejääkioonid ja nende nimed.
Tabel 1. Mõningate anorgaaniliste hapete ning vastavate happejääkioonide (happeanioonide) valemid ja nimetused
|
Hape |
Happejääkioon |
||
|
Valem |
Nimetus |
Valem |
Nimetus |
|
HCl |
vesinikkloriidhape (kasutatakse ka nimetust soolhape) |
Cl– |
kloriid |
|
H2S |
divesiniksulfiidhape |
S2- |
sulfiid |
|
H2SO3 |
väävlishape |
SO32- |
sulfit |
|
H2SO4 |
väävelhape |
SO42- |
sulfaat |
|
HNO3 |
lämmastikhape |
NO3– |
nitraat |
|
H2CO3 |
süsihape |
CO32- |
karbonaat |
|
H3PO4 |
fosforhape |
PO43- |
fosfaat |
|
H2SiO3 |
ränihape |
SiO32- |
silikaat |
Liigitamine
1. Tugevuse järgi
- 1) Tugevad happed on vesilahuses täielikult ioonideks jagunenud, nt HCl, HNO3, H2SO4.
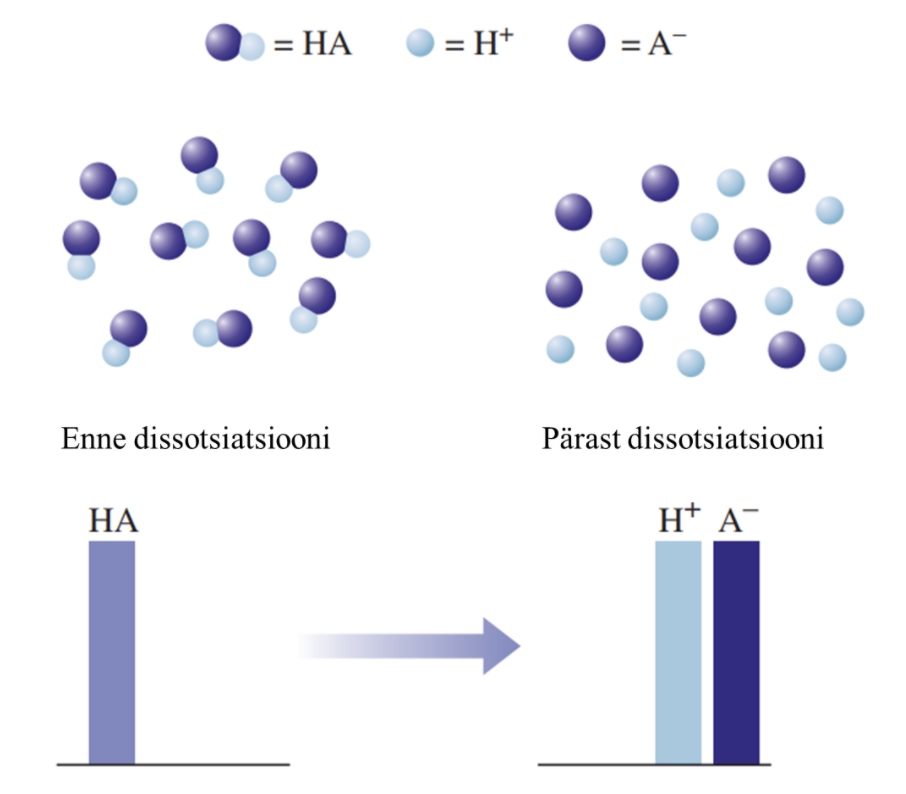
Graafiline esitus tugeva happe käitumise kohta vees: HA tähistab hapet, H+ vesinikioone, ja A– happejääkioone. Tugeva happe korral on näha, et hape on täielikult jagunenud ioonideks.
- 2) Nõrgad happed on vesilahuses vaid osaliselt ioonideks jagunenud (kõik happed, välja arvatud tugevad happed), nt H3PO4, H2SO3, H2S, H2CO3, H2SiO3.
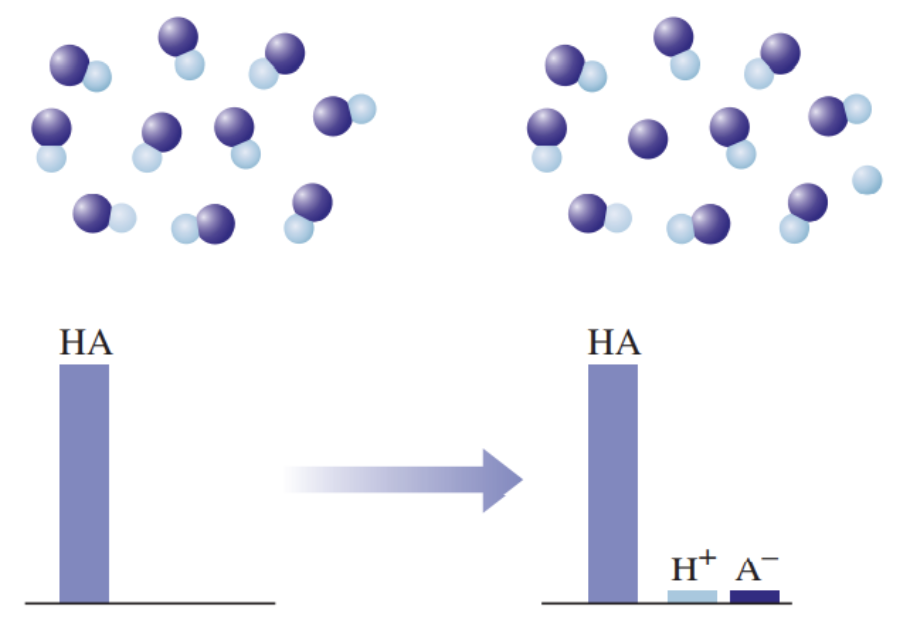
Graafiline esitus nõrga happe käitumise kohta vees: HA tähistab hapet, H+ vesinikioone, ja A– happejääkioone. Nõrga happe korral on näha, et ainult väga väike osa happest on jagunenud ioonideks.
Joonisel on välja toodud tugeva ja nõrga happe vesilahuste erinevuse mudel. Nõrga happe vesilahuses on olemas nii negatiivse laenguga happeanioonid, positiivse laenguga vesinikioonid kui ka happe molekulid, st happe molekulid on vaid osaliselt ioonideks jagunenud. Seevastu tugeva happe vesilahuses happemolekule ei ole, lahuses on vaid negatiivse laenguga happeanioonid ja positiivse laenguga vesinikioonid.
2. Prootonite arvu järgi
- 1) Üheprootonilised happed sisaldavad ühte vesinikiooni, nt HCl, HNO3.
- 2) Mitmeprootonilised happed sisaldavad mitut vesinikiooni, nt H2SO4, H3PO4.
3. Hapniku sisalduse järgi
- 1) Hapnikhapped sisaldavad hapniku aatomeid, nt H2SO4, H2SiO3.
- 2) Hapnikuta happed ei sisalda hapniku aatomeid, nt H2S, HCl.
Hapete keemilised omadused
HAPE + ALUS → SOOL + H2O
1. Hape reageerib alusega, tekivad sool ja vesi.
HCl + NaOH → NaCl + H2O
H2SO4 + 2LiOH → Li2SO4 + 2H2O
HAPE + METALL → SOOL + H2↑
2. Hape reageerib metalliga, tekivad sool ja vesinik.
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Zn + 2HCl → ZnCl2 + H2 ↑

Tsingi, magneesiumi, raua ja alumiiniumi reaktsioon 18%-lise HCl-lahusega
Kõik ei reageeri hapetega ühtmoodi. Metallide võimet hapete lahustest vesinikku välja tõrjuda iseloomustab metallide pingerida:

Lahjendatud hapete lahustega reageerivad vesinikust aktiivsemad metallid (metallid, mis asuvad pingereas vesinikust vasakul pool).
HAPE + ALUSELINE OKSIID → SOOL + H2O
3. Hape reageerib aluselise oksiidiga, tekivad sool ja vesi.
See reaktsioon toimub alati.
2HCl + BaO → BaCl2 + H2O
CuO + H2SO4 → CuSO4 + H2O


