
3.1. Oksiidid
Oksiidide peatükis räägime, mis on , kuidas oksiide nimetatakse ning nende keemilisi valemeid koostatakse. Vaatame, kuidas oksiide saab liigitada ja kuidas tekivad oksiidid.
Kõige üldisemalt saame defineerida, et oksiidid on ained, mis koosnevad kahest elemendist, millest üks on hapnik. Oksiide leidub kõikjal meie ümber. Üks levinumaid oksiide on näiteks vesi ehk divesinikoksiid (H2O). Suur osa maakoorest koosneb tahketest oksiididest, mis tuleneb sellest, et elemendid on reageerinud õhuhapniku või veega. Samuti on enamik metalle, mis puutuvad kokku hapnikuga või veega, kaetud oksiidi või oksiidide kihiga.
Järgnev video võtab kokku kõik olulisemad oksiidide nimetamise, saamise ja keemiliste omaduste reeglid.
Allikas: https://www.youtube.com/watch?v=mPn6iPeGfwk&list=PLDWTb1SlW-s0UQDpn7rtAmyba3HoLd2xu
Nimetamine
Oksiidide nimetamisel tuleks esmalt teada, kas tegemist on metallioksiidiga või mittemetallioksiidiga. on oksiid, mis koosneb metallilisest elemendist ja hapnikust (nt CaO, Na2O). on oksiid, mis koosneb mittemetallilisest elemendist ja hapnikust (nt H2O, CO2).
 Korda videost üle, kuidas määrata oksüdatsiooniastet ja tasakaalustada ühendit.
Korda videost üle, kuidas määrata oksüdatsiooniastet ja tasakaalustada ühendit.
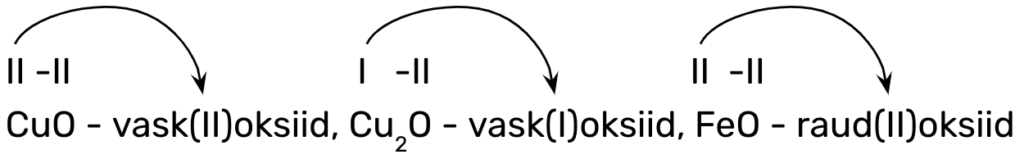
Metallioksiidide nimetamisel tuleb eelnevalt teada, kas metall on püsiva või muutuva oksüdatsiooniastmega. Sellest tulenevalt on kaks metallioksiidide nimetamise reeglit:
1. metalli nimi + oksiid, kui oksiidi koostises oleval metallilisel elemendil on püsiv (IA, IIA ja IIIA rühma metallilised elemendid):
nt CaO – kaltsiumoksiid, Na2O – naatriumoksiid, Al2O3 – alumiiniumoksiid;
2. metalli nimi + (o.a) + oksiid, kui oksiidi koostises oleval metallilisel elemendil on muutuv oksüdatsiooniaste (ülejäänud metallillised elemendid), mis tuleb kõigepealt valemis määrata ning siis ka nimetamisel kasutada, nt
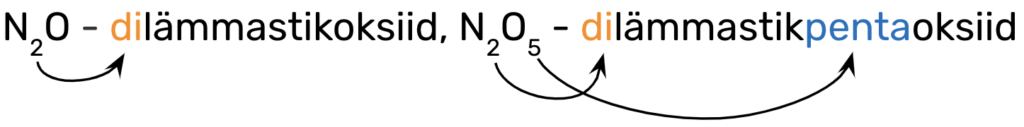
Mittemetallioksiidide nimetamisel kasutatakse kreekakeelseid eesliiteid:
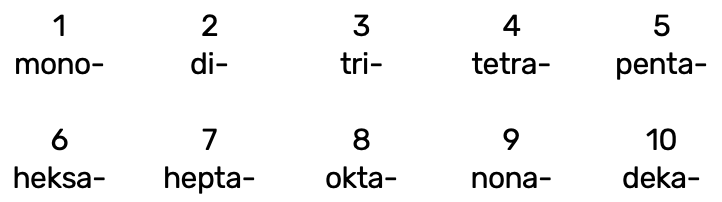
Eesliide käib selle mittemetallilise elemendi nimetuse ette, mille aatomite arvu ta näitab, nt
Vali oksiidi õige nimetus.
Valemite koostamine
Oksiidide valemite koostamisel tuleks lähtuda järgmistest reeglitest:
- kirjuta kõrvuti oksiidi moodustava metallilise või mittemetallilise elemendi ja hapniku sümbolid;
- kui on tegemist mittemetallilise elemendiga, jälgi eesliiteid ja kirjuta need vastava elemendi sümboli järele indeksiks;
- kui on tegemist metallilise elemendiga, märgi elementide sümbolite kohale oksüdatsiooniastmed ja tasakaalusta vajadusel valem.
Näide 1. Koostame divesinikoksiidi valemi.
- Kõigepealt märgi kõrvuti vesiniku ja hapniku sümbolid: HO.
- Kuna tegemist on mittemetallioksiidiga arvesta eesliiteid.
- Kuna eesliide on vesiniku ees ja “di” tähendab kahte, siis on molekulis 2 vesiniku aatomit ning molekuli valemi saame kirjutada: H2O.
Näide 2. Koostame liitiumoksiidi valemi.
- Kõigepealt märgi kõrvuti liitiumi ja hapniku sümbolid: LiO.
- Tegemist on metallioksiidiga, märgi elementide kohale oksüdatsiooniastmed:
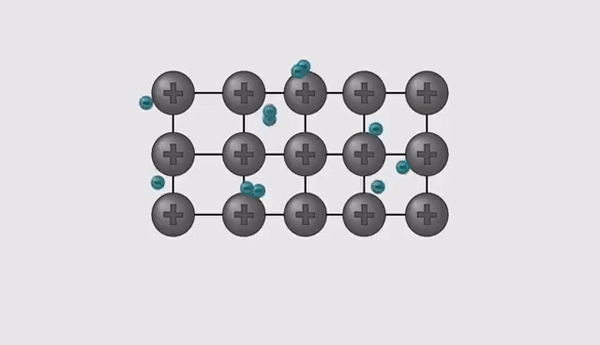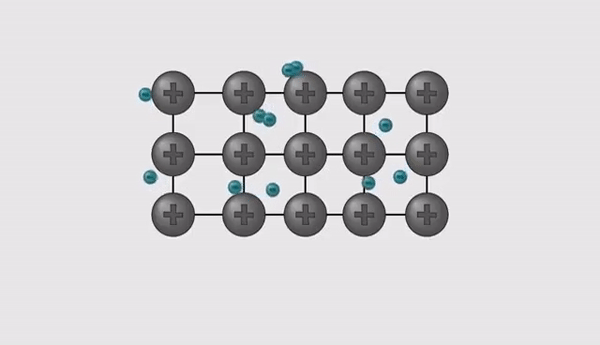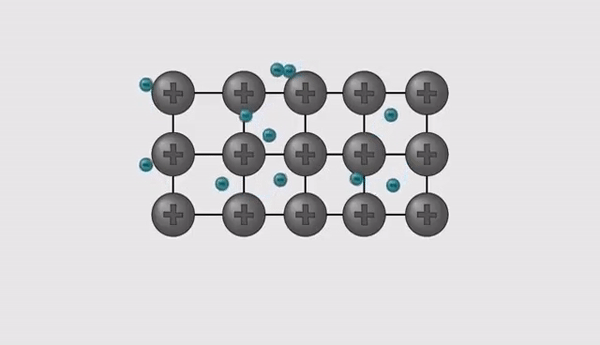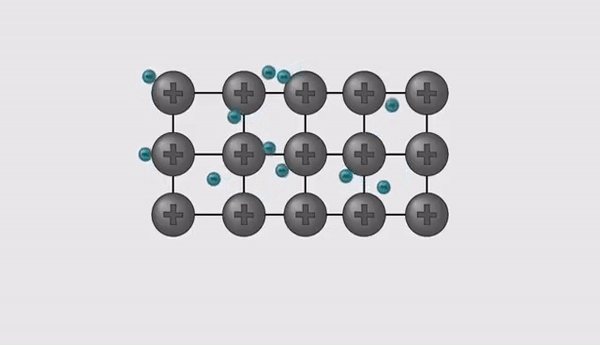
- Kuna oksüdatsiooniastmed on erineva väärtusega, tuleb valem tasakaalustada.
- Hetkel on molekulis üks positiivne osa ja kaks negatiivset osa, et molekuli laeng oleks tervikuna null, peab võtma ka positiivseid osasid 2 tükki, seega tuleb võtta 2 liitiumi aatomit ja see kirjutatakse alla indeksiks.
- Sellest tulenevalt kujuneb liitiumoksiid valemiks: Li2O.
Milline on oksiidi õige valem?
Liigitamine
Oksiide jaotatakse metallioksiididideks ja mittemetallioksiidideks. Samas on võimalik neid liigitada ka happelisteks ja aluselisteks oksiidideks.
Happelised oksiidid on hapetele vastavad oksiidid. Tuntuimad happelised oksiidid on mittemetallioksiidid, nt SO2, CO2.
Aluselised oksiidid on alustele vastavad oksiidid. Tavaliselt on aluselised oksiidid metallioksiidid, nt CaO, Li2O. Aluselisi oksiide liigitatakse omakorda tugevalt aluselisteks oksiidideks ja nõrgalt aluselisteks oksiidideks. Tugevalt aluselised oksiidid on need oksiidid (IA ja IIA alates Ca-st metalliliste elementide oksiidid), mille reageerimisel veega moodustub leelis.
|
ALUSELISED |
HAPPELISED |
|
Li2O liitiumoksiid |
SO2 vääveldioksiid |
|
Na2O naatriumoksiid |
SO3 vääveltrioksiid |
|
CaO kaltsiumoksiid |
NO2 lämmastikdioksiid |
|
FeO raud(II)oksiid |
P4O10 tetrafosfordekaoksiid |
Ühinemisreaktsioon
Sa tead juba, et oksiidid on ained, mis koosnevad kahest elemendist, millest üks on hapnik. Kuidas oksiidid tekivad? Selle jaoks, et saaksime õige pea minna oksiidide tekkimise juurde, vaata läbi video, mis aitab Sul mõista, kuidas kirjutatakse reaktsioonivõrrandeid ning kuidas tekivad oksiidid.
Allikas: https://youtu.be/BvZQu-lJuCQ
on reaktsiooni üleskirjutus valemite abil ning annab informatsiooni reageerivatest ja tekkivatest ainetest ehk lähteainetest ja saadustest. Lähteained on reaktsioonis omavahel reageerivad ained ning saadused reaktsiooni käigus tekkivad ained. Reaktsioonivõrrandis kirjutatakse lähteained reaktsioonivõrrandi vasakule poole ning nende vahele pannakse „+“ märk näitamaks, et need ained reageerivad omavahel. Saadused kirjutatakse reaktsioonivõrrandi paremale poole ning lähteainete muundumist saadusteks näidatakse noolega.
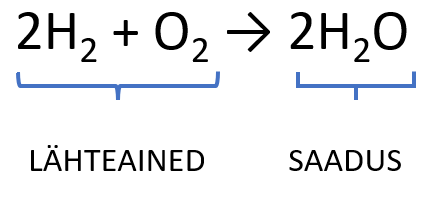
Nagu Sa ülaltoodud jooniselt näed, siis vesiniku ja hapniku omavahelisel ühinemisel tekib vesi. Ilmselt panid ka tähele, et ainete üleskirjutamisel kasutatakse alaindekseid. paigutatakse vastava elemendi sümboli alla paremale ning see väljendab molekulis olevate aatomite arvu.
Kuidas tähistatakse …
Eelmisel joonisel näed veel, et vesiniku ja vee valemi ees on numbrid. Need on olulised, kuna reaktsioonivõrrand peab olema tasakaalus ehk ühe ja sama elemendi aatomite arv reaktsioonivõrrandi vasakul ja paremal pool peab olema sama. Kui see nii ei ole, tuleb võrrandit tasakaalustada. Tasakaalustamise juures võid Sa reaktsioonivõrrandis aine valemite ette kirjutada kordajaid ehk koefitsiente. näitab reaktsioonis osalevate osakeste arvu.
Proovime kirjutada naatriumi ja hapniku omavahelise keemilise reaktsiooni võrrandi.
1. Paneme kirja lähteainete valemid ning nende vahele „+“ märgi:
Na + O2
2. Kuna naatrium ja hapnik reageerivad omavahel, andes uue aine, kirjutame võrrandisse vastava sümbolina “→”:
Na + O2 →
3. Selle reaktsiooni käigus tekib naatriumoksiid. Naatriumoksiidi valemi koostamisel kasutame oksüdatsiooniastmeid (kuna tegu on metallioksiidiga):
I -II
Na + O2 → Na2O
4. Nüüd kontrollime, kas reaktsioonivõrrand on tasakaalus ning näeme, et antud hetkel see nii ei ole. Võrrandi vasakul pool on 1 naatriumi ning 2 hapniku aatomit, kuid reaktsioonivõrrandi paremal pool on 2 naatriumi aatomit ja 1 hapniku aatom. Reaktsioonivõrrandi tasakaalustamiseks proovime kõigepealt mõlemale poole saada kaks hapniku aatomit, seega kirjutame naatriumoksiidi ette kordajaks 2:
Na + O2 → 2Na2O
5. Nüüd on paremal pool neli naatriumi aatomit (kordaja ja indeks korrutatakse) ning selle jaoks, et ka vasakul pool oleks neli naatriumi aatomit, tuleb naatriumi ette kirjutada kordajaks 4:
4Na + O2 → 2Na2O
Sellega ongi naatriumi ja hapniku omavahelise reaktsiooni võrrand kirjutatud ja tasakaalustatud.
Tasakaalusta reaktsioonivõrrandid.
Oksiidide saamine
Oleme käsitlenud juba vesiniku ja hapniku ning naatriumi ja hapniku omavahelist reaktsiooni. Mõlemad on ühinemisreaktsioonid. on reaktsioon, mille käigus ained ühinevad, moodustades uue aine. Üks võimalus oksiidide saamiseks ongi just ühinemisreaktsioonil.
Oksiidid tekivad reageerimisel hapnikuga. Reaktsiooni hapnikuga nimetatakse ka põlemisreaktsiooniks. Näiteks baariumi reageerimist hapnikuga, mille tulemusel tekib baariumoksiid, kirjeldab järgnev reaktsioonivõrrand:
2Ba + O2 → 2BaO
Alumiiniumi ja hapniku ühinemise reaktsioonivõrrand näeb aga välja selline:
4Al + 3O2 → 2Al2O3
Veel on oluline mõista, et metallide põlemisel tekivad metallioksiidid ning mittemetallide põlemisel tekivad mittemetallioksiidid. Seega näiteks süsiniku ja hapniku omavahelisel reaktsioonil tekib süsinikdioksiid:
C + O2 → CO2
Oksiidid ei ole aga ainsad ained, mis tekivad lihtainete ühinemisel. Niimoodi tekivad ka sulfiidid ja kloriidid (soolade aineklassi kuuluvad ained).
Näiteks kaltsiumi ja kloori vahelisel reaktsioonil tekib kaltsiumkloriid:
Ca + Cl2 → CaCl2
Liitiumi ja väävli vahelisel reaktsioonil tekib aga liitiumsulfiid:
2Li + S → Li2S
Oksiidide keemilised omadused
Sõltuvalt sellest, kas tegemist on happelise või aluselise oksiidiga, on neil erinevad .
1. Happelise oksiidi reageerimisel veega moodustub hape.
HAPPELINE OKSIID + H2O → HAPE
SO3 + H2O → H2SO4
CO2 + H2O  H2CO3
H2CO3
P4O10 + 6H2O → 4H3PO4
N2O5 + H2O → 2HNO3
Jäta meelde, et SiO2 ei reageeri veega! (SiO2 on liiva põhikomponent.)
Oluline on meeles pidada, et oksiidis ja talle vastavas happes peab mittemetallilisel elemendil olema sama oksüdatsiooniaste (o.a). Happelised oksiidid ja neile vastavad on toodud tabelis 1:
Tabel 1. Happelistele oksiididele vastavad happed
|
HAPPELINE OKSIID |
VASTAV HAPE |
HAPPE NIMETUS |
|
SO2 |
H2SO3 |
väävlishape |
|
SO3 |
H2SO4 |
väävelhape |
|
CO2 |
H2CO3 |
süsihape |
|
P4O10 |
H3PO4 |
fosforhape |
|
N2O5 |
HNO3 |
lämmastikhape |
2. Aluselise oksiidi reageerimisel veega moodustub tugev alus ehk leelis.
ALUSELINE OKSIID + H2O → TUGEV ALUS
CaO + H2O → Ca(OH)2
Na2O+ H2O → 2NaOH
Veega reageerivad ainult IA rühma ja alates kaltsiumist (alates Ca-st) IIA rühma metallide oksiidid.
3. Aluselise oksiidi reageerimisel happelise oksiidiga moodustub sool.
ALUSELINE OKSIID + HAPPELINE OKSIID → SOOL
CaO + CO2 → CaCO3
6Li2O + P4O10 → 4Li3PO4
See reaktsioon toimub alati ning tekib happelisele oksiidile vastava happe sool. Happelisele oksiidile vastava happe leiad tabelist 1.
4. Happeline oksiid reageerib alusega, moodustub sool ja vesi.
HAPPELINE OKSIID + ALUS → SOOL + H2O
SO2 + 2NaOH → Na2SO3 + H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
See reaktsioon toimub alati.
5. Aluseline oksiid reageerib happega, moodustub sool ja vesi.
ALUSELINE OKSIID + HAPE → SOOL + H2O
2 HNO3 + CaO → Ca(NO3)2 + H2O
2HCl + Na2O → 2NaCl + H2O
See reaktsioon toimub alati.


