6.7. Aromaatsed ühendid
Aromaatsed ühendid sisaldavad küll kordseid süsinik-süsiniksidemeid, kuid on keemiliselt stabiilsemad kui alkeenid või alküünid. Aromaatsete ühenditega võid tutvuda järgmises videos.
Allikas: https://youtu.be/hmmGmz5CszU
Kõige tuntum aromaatne ühend on benseen C6H6, mis on magusa lõhnaga värvitu mürgine vedelik. Benseenimolekulil on kuusnurkne tasapinnaline struktuur, mille tippudes paiknevad süsinikuaatomid. Benseenitsükli struktuuri (ja ka teiste aromaatsete süsivesinike struktuuri) on klassikaliselt kujutatud vaheldumisi paiknevate süsinikevaheliste üksik- ja kaksiksidemete abil. Tegelikult on benseenis aga kõik süsinik-süsiniksidemed üksik- ja kaksiksidemete vahepealsed, n-ö pooleteistkordsed sidemed. Seda sidemete paiknemist võib märkida ka benseeni kuusnurga sisse joonistatud ringi või punktiirjoonega. Kõik need erinevad kujutamisviisid tähistavad aga muidugi ühte ja sama molekuli. Benseeni ja teiste aromaatsete ühendite tsükleid nimetatakse ka aromaatseteks tuumadeks või ringideks.
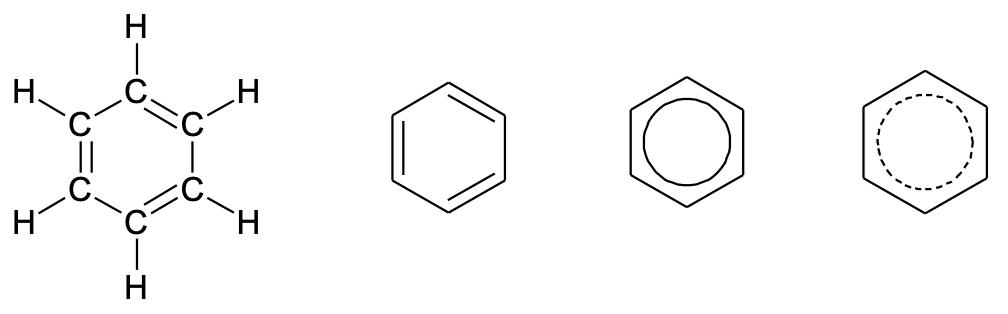
Joonis 1. Benseeni kujutamise viise
Aromaatsetes ainetes võib olla ka mitu tsüklit. Näiteks on aromaatsed naftaleen ja antratseen. Kõigile aromaatsetele tsüklitele on omane tasapinnaline kuju ja seetõttu ei ole aromaatsetes tsüklites tetraeedrilisi (nelja üksiksidemega) süsinikke. Ka grafeen (leht grafiidi struktuuris) on aromaatne struktuur. Kuna aromaatsus muudab aineid stabiilsemaks, on aromaatset tuuma sisaldavad ained looduses üsna levinud. Samuti sisaldavad aromaatset tuuma mitmed ravimid (nt aspiriin, paratsetamool ja ibuprofeen). Süsiniku asemel võib aromaatses tuumas olla ka teisi elemente nagu näiteks lämmastik (nt püridiinis).
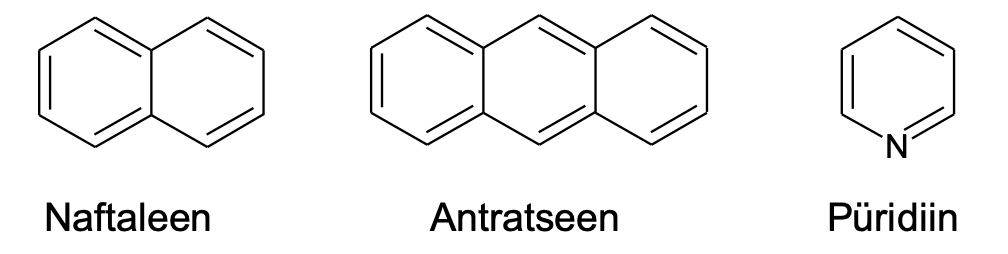
Joonis 2. Näiteid tsüklitest aromaatsetes ainetes
Aromaatsete ühendite nimetamine
Benseeni derivaatide korral võetakse tavaliselt benseen tüviühendiks ning sellega seotud rühmad nimetatakse eesliidete abil. Kui rühmi on mitu, siis üks neist märgitakse numbriga 1 ning teised nummerdatakse vastavalt oma asukohale asendi number 1 suhtes nii, et numbrid oleksid võimalikult väikesed.
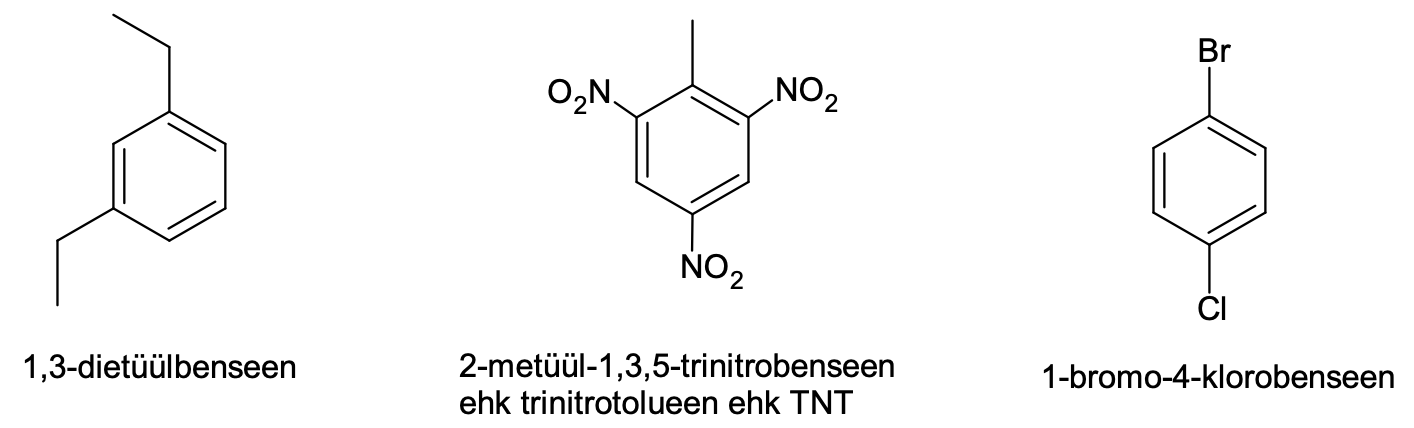
Joonis 3. Näiteid asendatud aromaatsetest ühenditest koos nende süstemaatiliste nimetustega
Aromaatsete ühendite keemilised omadused
Aromaatsetele ühenditele on iseloomulikud asendusreaktsioonid.
Erinevalt tüüpilistest küllastumata ühenditest (alkeenid ja alküünid) on aromaatsetele ühenditele iseloomulikud asendusreaktsioonid. Liitumisreaktsioone aromaatsed ühendid kergesti ei anna. Tüüpilises asendusreaktsioonis asendatakse üks aromaatse tuuma vesinikuaatom halogeeni või nitrorühmaga (-NO2). Reaktsioone nimetakse vastavalt aromaatse tuuma halogeenimiseks või nitreerimiseks. Nende reaktsioonide jaoks läheb vaja katalüsaatoreid, milleks on halogeenimisel teatud soolad (nt AlCl3, FeBr3) ja nitreerimisel kontsentreeritud väävelhape. Asendusreaktsioon võib toimuda ka mitmes etapis, nt saadakse kolme metüülbenseeni (tolueeni) vesiniku asendamisel nitrorühmaga tuntud lõhkeainet trinitrotolueeni (TNT).
C6H6 + Br2 $\xrightarrow[]{FeBr_{3}}$ C6H5Br + HBr
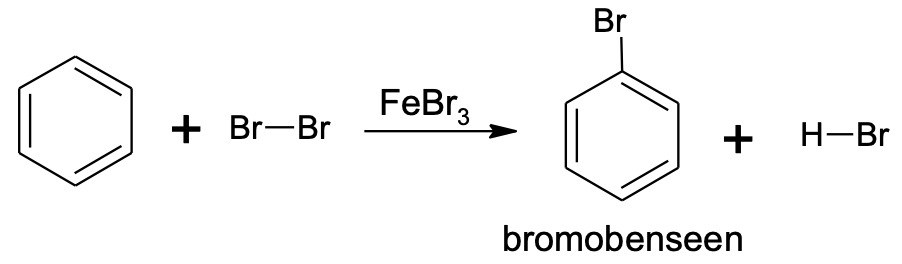
Joonis 4. Benseeni broomimine
C6H6 + HNO3$\xrightarrow[]{FeBr_{3}}$ C6H5NO2 + H2O
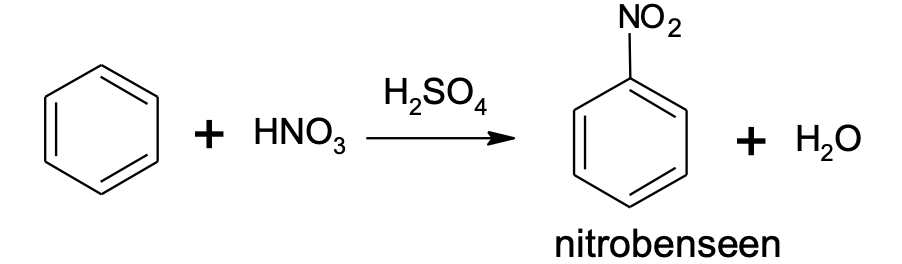
Joonis 5. Benseeni nitreerimine
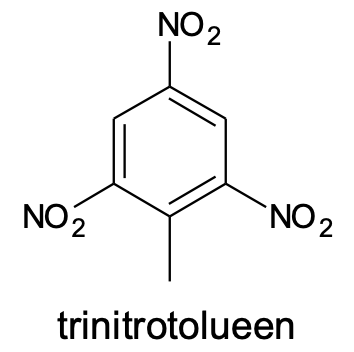
Joonis 6. Trinitrotolueen on saadud metüülbenseeni kolmeetapilisel nitreerimisel

