6.5. Halogeeniühendid
Halogeeniühendid on ained, kus orgaanilise molekuli üks või mitu C–H vesinikku on asendatud halogeeniaatomiga. Alkaanidest lähtuvad halogeeniühendid on asendatud alkaanid. Neis ainetes esineb halogeeni ja süsiniku aatomite vahel side C–Hal. Halogeeniühendis võib sisalduda nii fluor (F), kloor (Cl), broom (Br) kui ka jood (I). Halogeeniühendite kohta vaata lähemalt järgmisest videost.
Allikas: https://youtu.be/ng1t_qpFhWA
Halogeeniühendite nimetamine
Halogeeniühendite nimetamine meenutab hargnenud alkaanide nimetamist, kus halogeenile vastavat rühma nimetatakse nagu külgrühma. Halogeeniühendite korral kasutatakse enamasti nendele vastavaid eesliiteid:
- F – fluoro
- Cl – kloro
- Br – bromo
- I – jodo
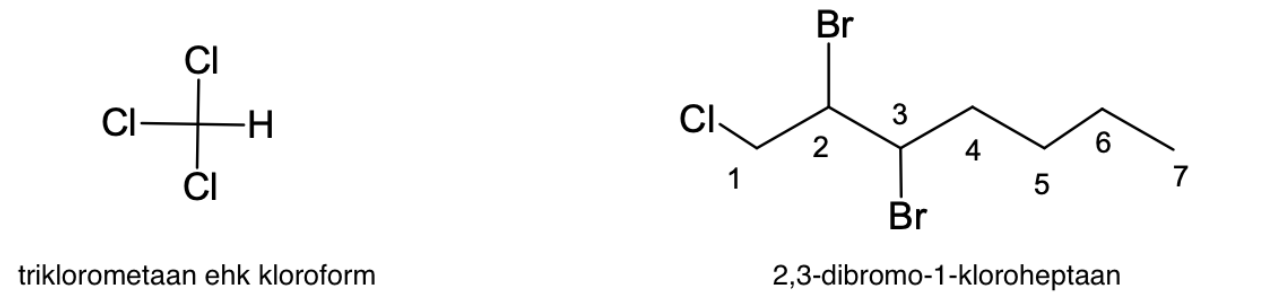
Joonis 1. Näiteid alküülhalogeniididest
Kasutusel on ka teine nimetamise viis, kus halogeenile vastavat rühma kasutatakse järelliitena (fluoriid, kloriid, bromiid, jodiid) ja alkaanile vastavat rühma eesliitena. Näiteks CH3–Cl võib nimetada nii klorometaaniks (eelistatud nimetus) kui ka metüülkloriidiks.
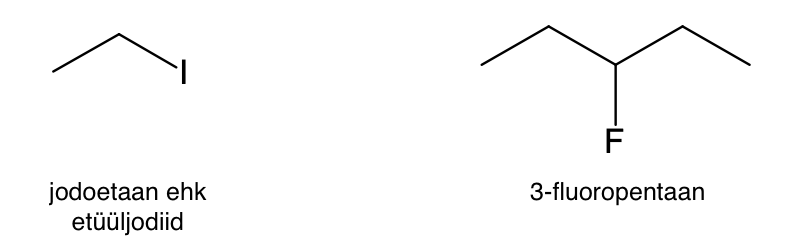
Joonis 2. Lihtsa struktuuriga jodoetaani võib nimetada ka etüüljodiidiks (halogeen märgitud järelliitena), kuid keerukama struktuuriga 3-fluoropentaani puhul ei ole halogeeni märkimine järelliitena mõttekas
Halogeeniühendite omadused ja kasutamine
Halogeeniühendid on hüdrofoobsed.
Kuigi halogeeniühendid on alkaanidest polaarsemad, ei anna halogeeniühendid üldiselt vesiniksidemeid, on hüdrofoobsed ning lahustuvad vees väga vähe. Halogeeniühendite keemistemperatuurid sarnanevad sama suurte molekulidega alkaanide keemistemperatuuridele, kuid on neist veidi kõrgemad, sest halogeeniühendite molekulide vahel mõjuvad veidi tugevamad molekulidevahelised jõud. Halogeeniühendid on keemiliselt reaktsioonivõimelisemad kui alkaanid ning neid kasutatakse laialdaselt orgaanilises sünteesis.
Tabel 2. Halogeeniühendite keemistemperatuurid
|
Aine |
CH3Cl |
CH3CH2Cl |
CH3CH2CH2Cl |
CH3CH2CH2CH2Cl |
|
Keemistemperatuur, °C |
–24 |
12 |
47 |
78 |
Alates 19. saj on halogeeniühendeid tuntud anesteetikumidena, külmikutes on kasutatud freoone (kloori ja fluori aatomeid sisaldavad ühendid). Tänapäeval on halogeeniühendid ka näiteks mitmete ravimite ja taimekaitsevahendite koostises. Laialdaselt on kasutusel polüvinüülkloriid ehk PVC, millest valmistatakse pakkekilesid, torusid ja muid tooteid. Halogeeniühendite kasutamisega on seotud ka mitmed keskkonnaprobleemid (osoonikihi hõrenemine freoonide tõttu, bioakumuleeruvad orgaanilised saasteained) ning sageli püütakse halogeeniühendeid asendada teiste, keskkonnasõbralikumate ühenditega.
 Loe lisaks: Nukleofiilne asendusreaktsioon
Loe lisaks: Nukleofiilne asendusreaktsioon
Halogeeniühenditega toimuvad nukleofiilsed asendusreaktsioonid, kus halogeeniaatom asendatakse mõne teise rühmaga. Need reaktsioonid muudavad halogeeniühendid olulisteks lähteaineteks paljude ainete saamisel.

Näide halogeeniühendi reaktsioonist
Nukleofiil on negatiivse laengu (või osalaengu) ja kõrge energiaga elektronipaariga osake. Nukleofiilil on elektrone n-ö üle ja ta tahab keemilises reaktsioonis oma elektronid uude sidemesse loovutada. Nukleofiil võib olla hüdroksiidioon, halogeniidioon, happeanioon vms. Nukleofiilne tsenter on üldiselt negatiivse laengu (või osalaenguga) aatom nukleofiilis.
Elektrofiil on positiivse laengu või osalaenguga osake, millel on n-ö elektronide puudujääk. Elektrofiilne tsenter on positiivse laengu või osalaenguga aatom elektrofiilis.
Näites toodud asendusreaktsioonis on nukleofiil OH–. C–Br sideme juures on süsinikul väike positiivne osalaeng, mistõttu on see elektrofiilne tsenter ja bromopropaan käitub elektrofiilina. Reaktsiooni käigus asendab OH– broomi aatomi, mis eraldub bromiidioonina. Naatriumioonid tegelikult reaktsioonist osa ei võta. Nukleofiilses asendusreaktsioonis on ründav osake alati nukleofiil ja reaktsioon toimub elektrofiilse tsentri juures.
Põhjalikumalt võid nukleofiilse asendusreaktsiooni kohta vaadata järgmisest videost: https://youtu.be/e4dQvJMiTQI

