Terapeutilised antikehad
3.1. Terapeutiliste antikehade tüübid
Terapeutiliste antikehade arenduses on kolm arengusuunda lähtudes antikehade struktuurist (ja sellega seotud funktsioonidest).
- täispikad antikehad
- konjugeeritud antikehad
- antikeha fragmendid
Täispikad antikehad on valdav terapeutiliste antikehade tüüp (24 antikeha 31-st FDA/EMA registreeritud antikehadest 26.04.2013 seisuga; Reichert 2013). Valdavas enamuses on antikehad IgG1 alaklassist, mis omab kõige tugevamaid efektorfunktsioone ja on pika poolväärtusajaga, teistest IgG alaklassidest on esindatud IgG2 (4 antikeha) ja IgG4 (2 antikeha).
Ebatüüpilise ehitusega on bispetsiifiline antikeha Catumaxomab (Removab), mis ühe seondumiskoha kaudu tunneb ära antigeeni kasvajaraku pinnal (EpCAM), teise seondumiskohaga aga T-raku pinnaretseptorit (CD3). Antikehaga seotud T-rakud viivad kasvajaraku lüüsile, lisaks osaleb antikeha Fc regioona teiste immuunmehhanismide aktivatsioonis. Tegemist on hübriidse antikehaga mille üks kerge ja raske ahela paar pärineb hiirelt, teine rotilt.
Konjugeeritud antikehad (ADC-antibody-drug conjugates) koosnevad antikehast või antikeha fragmendist ja sellega kovalentselt seotud biomolekulist, ravimainest või radionukliidist, mis koos toimivad soovitud efekti saavutamiseks. Konjugeeritud antikehad on arendamist leidnud eelkõige kasvajate ravis, eesmärgiga tagada antikeha vahendusel kasvajavastaste ainete spetsiifiline mõju kasvajakoele ja vältida normaalse koe kahjustamist. FDA poolt registreeritud ravimina on kasutusel kaks radionukliidiga konjugeeritud CD20 vastast hiire monokloonset antikeha Mitte-Hodgkini lümfoomi raviks: Tositumomab-I131 (jood-131) ja Ibritumomab tiuxetan (ütrium-90). Prekliinilistes ja kliinilistes uuringutes testitakse antikehi/fragmente, mis on konjugeeritud nii kasvajavastaste ravimainetega (auristatiinid, maitansinoidid jt) kui ka looduslike toksiinidega. Aastatel 2011 ja 2013 on FDA andnud loa kahe tsütotoksilise ravimiga konjugeeritud antikeha kasutamiseks vastavalt Hodgkini lümfoomi raviks (Brentuximab vedotin; auristatiin E konjugeeritud anti-CD30) ja rinnavähi raviks (Trastuzumab emtansine; mertansiiniga konjugeeritud anti-HER2).
Aktiivne uurimissuund on antikehade konjugeerimine ensüümidega, mis muudaksid mitteaktiivse eellasravimi aktiivseks kasvajaraku pinnal (ADEPT – Antibody-directed enzyme prodrug therapy). Enamasti on kasutatud bakteriaalseid ensüüme (karboksüpeptidaas, beeta-laktamaas) ja ravimainetena väiksemolekulaarseid kemoterapeutikume. Selliste antikeha-konjugaatide immunogeensus on olnud üheks põhjuseks, et ADEPT ei ole veel jõudnud kliinilisse kasutusse. Üheks perspektiivseks suunaks terapeutiliste antikehade disainis on tsütokiinidega konjugeeritud antikehade ja antikeha fragmentide e. immunotsütokiinide arendamine, võimaldadades tsütokiinide lokaalset toimet sihtmärkrakkudele. Antikeha-sarnasteks bioloogilisteks ravimiteks on ka antikeha Fc-regiooni sisaldavad liitvalgud – immunoadhesiinid. Immunoadhesiinide seondumise sihtmärgiga määrab ligandi või retseptori ekstratsellulaarne osa, Fc-regioon tagab molekuli kõrgema poolväärtusaja.
Antikeha fragmendid on alternatiiviks täispikale antikehale, omades antigeeniga seonduvat varieeruvat antikeha osa, kuid mitte Fc regiooni. Alati ei ole antikeha Fc regiooni vahendatud efektormehhanismid vajalikud antikeha toimeks või võivad olla isegi kahjulikud. Samuti võib kasvajate ravis antikeha molekuli suurus olla takistuseks kasvajakoesse tungimisel. Seetõttu on ravimiarenduses olulist tähelepanu pööratud antikeha fragmentide arendamisele.
Seni on ravimitena registreeritud kolm Fab fragmenti, üks neist on konjugeeritud polüetüleenglükooliga (PEG) suurema stabiilsuse saavutamiseks. Antikeha fragmentidele on omane lühem poolväärtusaeg võrreldes täispikkade antikehadega. Teisalt on antikeha fragmentide tootmiskulud madalamad kui täispikkadel antikehadel. Prekliinilistes ja kliinilistes uuringutes on märkimisväärne hulk antikeha fragmentidel põhinevaid ravimkandidaate, peamiselt Fab ja scFv. Lisaks on antikehade modulaarne ehitus võimaldanud insenergeneetiliselt luua erinevaid nn. kolmanda põlvkonna antikeha fragmente, mis on disainitud vastavalt soovitud toimemehhanismile.
Perspektiivseks lähenemiseks on bispetsiifiliste või multispetsiifiliste fragmentide loomine (kovalentselt ja mittekovalentselt seotud erinevad scFv-d), mis omavad kahte või enamat erinevat seondumiskohta.
Bispetsiifilised antikehad/fragmendid laiendavad antikehade võimalikke toimemehhanisme ja annavad seeläbi võimaluse uute efektiivsete ravimite loomiseks.
Lisaks hiire ja inimese antikehadele on diagnostilist ja terapeutilist huvi pakkunud kaamelitel ja laamadel esinev Ig klass -VhH, millel esineb vaid üks V-sarnane domeen ilma kerge ahelata ja on seetõttu lihtsalt produtseeritav (nanokeha).
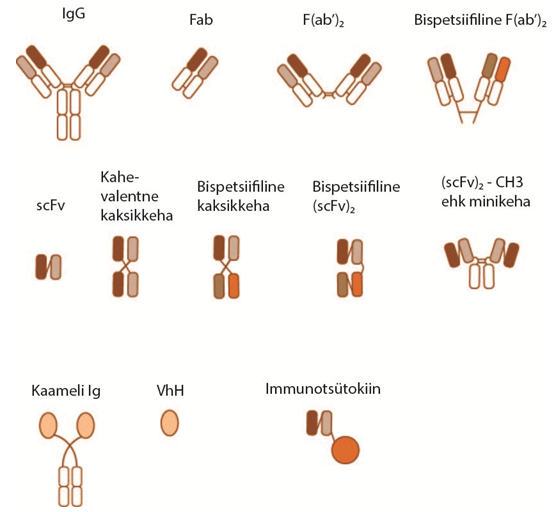
Joonis: Terapeutiliste antikehade ja antikeha fragmentide erinevad vormid.

