
Terapeutilised antikehad
1. Antikehade struktuur ja funktsioon
Antikehad on immuunsüsteemi efektiivsed tööriistad kahjustavate haigustekitajate ja võõrühendite spetsiifiliste struktuuride äratundmisel ja eemaldamisel. Et mõista paremini antikehade kasutusvõimalusi ravimitena, kordame üle nende ehituslikud ja funktsionaalsed iseärasused.
Antikehad on B-lümfotsüütide ehk B-rakkude poolt produtseeritud glükoproteiinid, mis tunnevad ära antigeene – mitmekesise struktuuriga makromolekule (peamiselt valke, polüsahhariide, vähem lipiide), mis enamasti on kehavõõrad. Küpsel (naiivsel) B-rakul esinevad antikehad e. immunoglobuliinid (Ig) rakupinnal B-raku retseptori (BCR) koosseisus. Peale kokkupuutumist antigeeniga ja lisasignaalide saamist T-abistajarakkudelt diferentseeruvad B-rakkudest plasmarakud, mis produtseerivad sama spetsiifikaga sekreteeritavaid antikehi. Iga B-rakk ja tema järglaskond (kloon) produtseerib täpselt ühesuguseid antikehi.
Antikeha molekul (molekulmass ca 150 kDa) koosneb kahest identsest raskest (H) ja kergest (L) polüpeptiidahelast, mis on omavahel seotud disulfiidsidemetega, nii et tekib kaks H-L paari. Antikeha ahelad koosnevad sarnase struktuuriga korduvatest regioonidest e. Ig domeenidest. Ig domeenid on umbes 110 aminohapet pikad ja moodustavad iseloomuliku globulaarse β-silindri struktuuri. Nii raskel kui kergel ahelal on üks varieeruv domeen (VH,VL); konstantseid domeene on kergel ahelal üks (CL) ja raskel ahelal kolm või neli (CH3-4), moodustades antikeha konstantse osa.
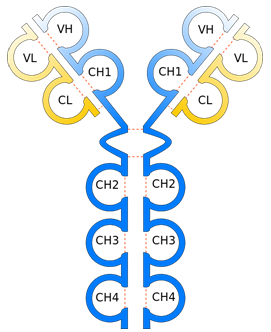
Joonis. IgM klassi antikeha skemaatiline struktuur. http://commons.wikimedia.org/wiki/File%3AAntibody_structure.svg, By Dan1gia2 (Own work) [CC-BY-SA-3.0 (http://creativecommons.org/licenses/by-sa/3.0)], via Wikimedia Commons
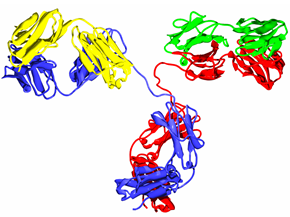
Joonis. IgG antikeha struktuurne mudel. Rasked ahelad on värvitud sinise ja punasega, kerged ahelad rohelise ja kollasega. http://commons.wikimedia.org/wiki/File%3ABesilesomab.png, By http://www.protevobio.com/?page=details.html&designate=Antibody [see page for license], via Wikimedia Commons
VH ja VL domeen osalevad seondumisel antigeeniga, seal paiknevad hüpervarieeruvad alad e. alad mille aminohappeline järjestus erineb kõige enam erinevate antikehade vahel. Raskel ja kergel ahelal on selliseid alasid kolm ning neid nimetatakse ka komplementaarsust määravateks regioonideks (CDR – complementarity determining regions). Vastavad regioonid asetsevad lähestikku VH ja VL domeenide välimistes polüpeptiidahela lingudes ning koos moodustavad antigeeni seondumiskoha (kokku kaks ühe antikeha molekuli kohta) ehk paratoobi. Antigeeni piirkonda, millega antikeha seondub nimetatakse epitoobiks ehk determinandiks. Epitoobid võivad olla lineaarsed (6-15 aminohapet pikad) või konformatsioonilised, kus polüpeptiidahelas eemalpaiknevad järjestused satuvad ruumilises struktuuris lähestikku. Antikehade mitmekesisuse peamiseks geneetiliseks aluseks on VH ja VL domeeni kodeerivate geenisegmentide (V-variable, D-diversity, J-joining) somaatiline rekombinatsioon B-rakkude küpsemisel ning sellele järgnev somaatiliste hüpermutatsioonide teke peale B-raku aktiveerimist antigeeniga. Teoreetiliselt võib inimesel tekkida kuni 1011 erineva seondumiskohaga antikeha, mis kokku moodustavad võimaliku antikehade repertuaari.
Antikehade raske ahela konstantsed domeenid osalevad antikehade efektorfunktsioonides. Raske ahela konstantse osa alusel eristatakse antikehade klasse e. isotüüpe. Inimesel on viis antikehade klassi: IgM, IgD, IgG (alaklassid 1–4), IgA (alaklassid 1–2) ja IgE. Vastavaid raske ahela tüüpe tähistatakse kreeka tähtedega (μ, δ, γ, α, ε). Eri tüüpi rasketel ahelatel on erinev C-domeenide arv, aminohappeline järjestus ja glükosüülituse tase ning ka erinevad immuunefektorfunktsioonid (Tabel 1). Ka kerge ahel võib-olla kahte tüüpi (κ või λ), kuid funktsionaalset erinevust nende vahel ei ole leitud. Üks antikeha molekul koosneb vaid ühte tüüpi kergest ja ühte tüüpi raskest ahelast.
Antikeha molekuli lõikamisel CH1 ja CH2 vahelt proteaas papaiiniga tekivad erinevate funktsionaalsete omadustega antikeha fragmendid: kaks Fab (Fragment antigen binding) ja üks Fc (Fragment crystallizable). Fab on antigeeniga seonduv antikeha osa, mis sisaldab lisaks V-domeenile mõlema ahela üht konstantset domeeni, mis on omavahel seotud disulfiidsidemega. Fc seevastu koosneb antikeha raske ahela konstantsetest domeenidest, mis seonduvad komplemendiga ja Fc-retseptoritega immuunrakkudel.
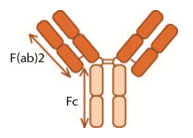
Joonis: Fab ja Fc fragmentidele vastavad alad IgG antikeha skeemil.
Antikehade efektorfunktsioonidest
Antikehade peamiseks bioloogiliseks rolliks on osaleda haigustekitajate eemaldamisel organismist, kasutades selleks erinevaid mehhanisme.
- Neutraliseerimine – antikeha seondumisel viiruste, bakterite ja toksiinide külge Fab osa kaudu takistatakse nende seondumist oma retseptoritega ja kahjustava toime avaldamist.
- Opsoniseerimine ja fagotsütoos – antikehad katavad haigustekitaja ja seondudes Fc osa kaudu Fc retseptoritega fagotsüütidel, võimendavad fagotsütoosi.
- Antikehast sõltuv rakuline tsütotoksilisus (ADCC – Antibody-Dependent Cell-Mediated Cytotoxicity) – antikehade poolt kaetud rakud (mikroobid) hävitatakse NK-rakkude poolt teatud Fc retseptori vahendusel (FcRγRIII). Eosinofiilid kahjustavad sarnase mehhanismiga ussparasiite (FcRεRI vahendusel).
- Komplemendist sõltuv tsütotoksilisus (CDC – Complement-Dependent Cytotoxicity )– antikehade seondumisel haigustekitajatega aktiveeritakse komplemendivalkude klassikaline rada, mis kahjustab haigustekitajat ja soodustab fagotsütoosi.
Tabel 1. Antikeha klasside e. isotüüpide iseloomustus (levik ja efektorfunktsioonid)
| Ak klass/ alaklass |
Monomeer/ multimeer |
Keskm konts. seerumis (mg/ml) |
Poolestusaeg (päevades) |
Efektorfunktsioonid |
| IgG1 | Monomeer | 9 | 21 | Opsonisatsioon, komplement, ADCC |
| IgG2 | Monomeer | 3 | 21 | Komplement |
| IgG3 | Monomeer | 1 | 7 | Komplement, opsonisatsioon, ADCC |
| IgG4 | Monomeer | 0,5 | 21 | Opsonisatsioon |
| IgA1-2 | Dimeer/ monomeer | 2 | 6 | sIgA limaskestadel, opsonisatsioon |
| IgM | Pentameer/ monomeer | 1,5 | 5 | Komplement, opsonisatsioon |
| IgD |
Monomeer |
0,04 | 3 | – |
| IgE | Monomeer | 3×10-5 | 2 | Nuumrakkude/eosinofiilide aktivatsioon |


