
4.3. Ainete lahustuvus vees
Lahused on kõikjal meie ümber, näiteks looduslik vesi, kohv, tee, söögiäädikas jne. Mõned ained lahustuvad vees paremini ja mõned halvemini. Lahustuvuse teemaga tutvumiseks vaata läbi alljärgnev video.
Allikas: https://youtu.be/qX48GTpOo-A
koosneb kahest komponendist: lahustist ja lahustunud ainest. Kõige tuntum on vesi. Kui lahustada vees kristalset ainet (ainet, mille kristallvõre koosneb ioonidest või molekulidest), ümbritsevad vee molekulid lahustuva aine osakesi ning need lähevad lahusesse.
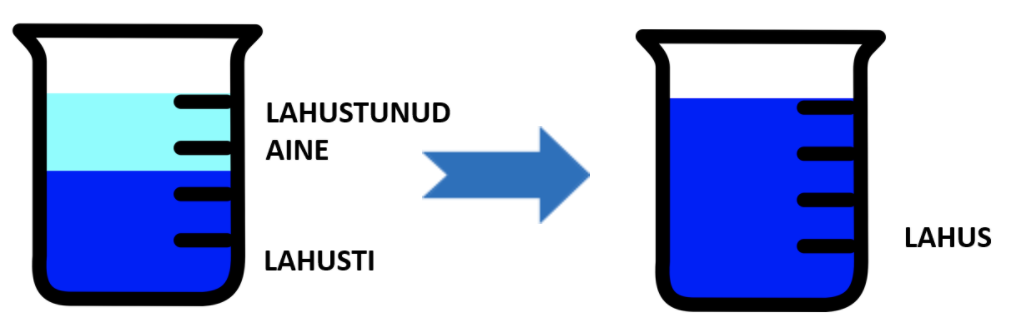
Lahuse tekkimine
Seda, kui palju ainet on võimalik antud tingimustel vees lahustada, iseloomustab . Lahustuvus näitab maksimaalset aine kogust grammides, mida on võimalik lahustada antud temperatuuril 100 grammis lahustis. Lahustuvusest arusaamine muutub oluliseks eelkõige lahuste valmistamisel, kui tuleb ise võtta sobivad ainekogused või valida mõne aine lahustamiseks parim lahusti. Oluline on mõista, et aine lahustuvus esitatakse kindlal temperatuuril ning tahkete ainete lahustuvus vees temperatuuri kasvades suureneb. Kui leida erinevatel temperatuuridel lahustuva aine maksimaalne kogus, saab koostada lahustuvuskõvera. Lahustuvuskõveralt on näha kui palju ainet 100 grammis lahustis maksimaalselt lahustub. Lahustuvus esitataksegi alati kindlal temperatuuril ja 100 grammi lahusti kohta, näiteks suhkru lahustuvus 20 ºC juures on 200 g/ 100 g vees (andmed: http://chestofbooks.com/food/science/Experimental-Cookery/The-Solubility-Of-The-Sugars.html).
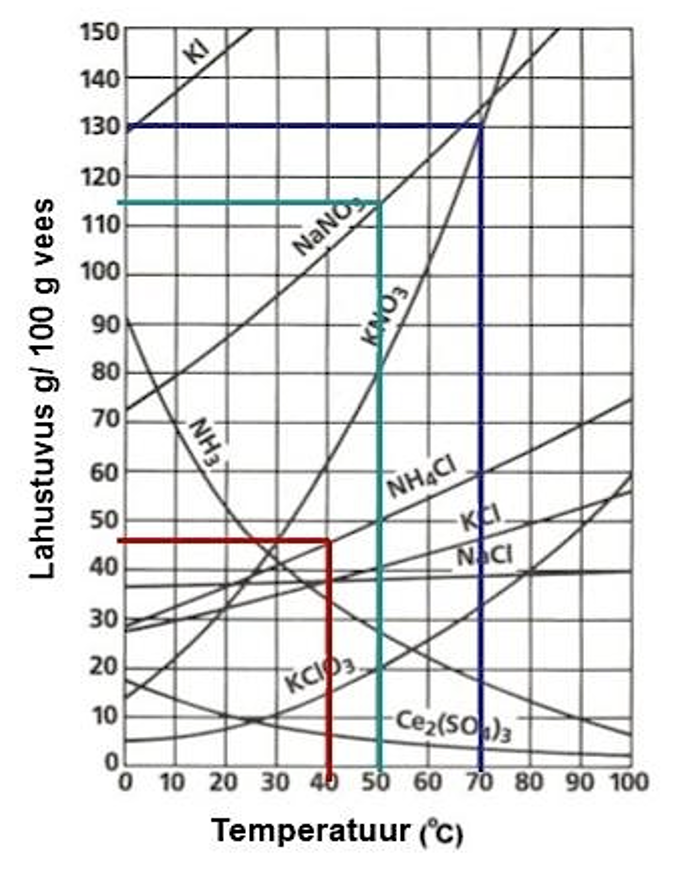
Erinevate ainete lahustuvuse sõltuvus temperatuurist. Allikas: https://www.slideshare.net/mrtangextrahelp/19-solutions-and-solubility
Uurime joonisel toodud lahustuvuskõveraid lähemalt. Kui me soovime teada, kui palju lahustub kaaliumnitraati 70 ºC juures 100 grammis vees, tuleb kõigepealt leida üles lahustuvuskõver, mis kirjeldab KNO3 lahustuvust vees. Seejärel leida temperatuuri teljelt 70 ºC, liikuda KNO3 lahustuvuskõverani ning sinna jõudes liikuda vastava punktini lahustuvuse teljelt. Seejärel saamegi graafikult lugeda, et 70 ºC juures lahustub KNO3 130 g/ 100 g vees (joonisel sinine joon).
Leidmaks naatriumnitraadi lahustuvust 50 grammis vees 50 ºC, käitume alguses samamoodi. Leiame üles NaNO3 lahustuvuskõvera ning 50 ºC puutepunkti ja loeme lahustuvuse teljelt näidu, milleks tuleb ~ 116 g/ 100 g vees (joonisel roheline joon). Meie käest küsiti aga naatriumnitraadi lahustuvust 50 grammis vees 50 ºC juures, seega kui 100 grammis lahustub 116 grammi naatriumnitraati, siis 50 grammis vees lahustub poole vähem. Vastuseks saamegi, et NaNO3-e lahustuvus 50 ºC 50 grammi vee kohta on 58 g.
Lahuseid saab jaotada kaheks: ja . Küllastumata lahuses saab antud tingimustel (temperatuur ja lahusti hulk) sama ainet veel lahustada. Küllastunud lahuse korral antud tingimustel ainet enam rohkem ei lahustu, vaid see jääb anuma põhja sademena.
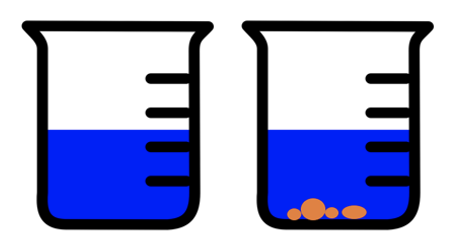
Küllastumata lahus (vasakul) ja küllastunud lahus sademega (paremal)
Ainete lahustuvus sõltub temperatuurist. Tahkete ainete lahustuvus tavaliselt suureneb temperatuuri tõustes. Gaaside lahustuvus aga väheneb temperatuuri tõustes. Siin saab mõelda veekogude peale suvel. Hapniku lahustuvus vees väheneb seoses vee temperatuuri tõusuga ning paljud kalad surevad hapniku puudumise tõttu. Gaaside lahustuvust mõjutab lisaks temperatuurile ka rõhk. Rõhu suurenedes gaaside lahustuvus suureneb. Siin saab analoogiat tuua gaseeritud jookidega. Kui joogid on veel avamata, on süsihappegaas lahustunud vedelikus, kuna rõhk pudelis on suurem. Korgi avamisel väheneb rõhk pudelis ja seetõttu ka süsihappegaasi lahustuvus vedelikus ning gaas proovib pudelist välja pääseda.
Ilmselt oled märganud, et vahel lahustub suhkur tees kiiremini ja vahel aeglasemalt. Kristallilise aine lahustumise kiirus sõltub mitmetest teguritest, näiteks aine peenestusastmest, temperatuurist, lahuse segamisest.


