
7.5. Karboksüülhapped
Igapäevaselt oled Sa endale seda teadvustamata kokku puutunud nii mõnegi karboksüülhapete aineklassi kuuluva ühendiga: söögiäädikaga köögis kokates, piimhappega keefiris, sidrunhappega sidruniga teed nautides või oblikhappega rabarbereid või jänesekapsaid süües. Mida aga endast täpsemalt kujutavad, sellest saad ülevaate videost.
Allikas: https://youtu.be/GWiNuLIFDuk
Karboksüülhapete mõiste, struktuur ja nimetamine
Karboksüülhapped on orgaanilised ühendid, mis sisaldavad oma struktuuris karboksüülrühma (-COOH).
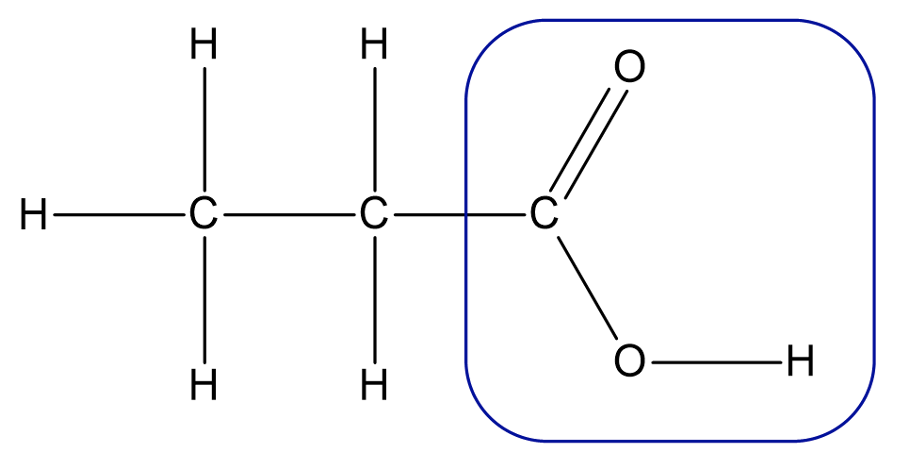
Karboksüülrühm karboksüülhappes
Karboksüülrühm on alati seotud süsinikahela otsmise süsinikuga ja neid võib olla molekulis ainult üks, nagu on näiteks etaan- ehk äädikhappes
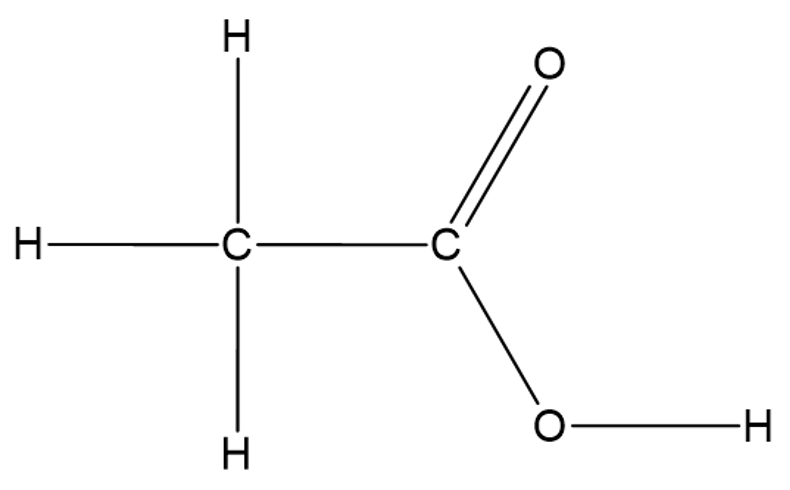
Etaanhape ehk äädikape
või mitu, nagu näiteks etaandihappes ehk oblikhappes
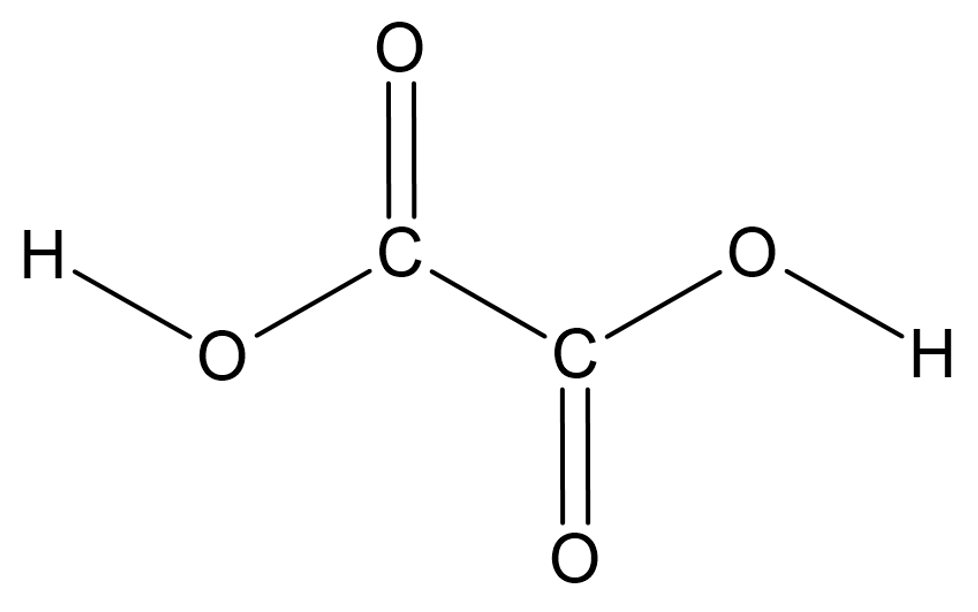
Etaandihape ehk oblikhape
Karboksüülhapete korral on samuti võimalik koostada nende tasapinnalisi, lihtsustatud ja summaarseid valemeid. Näiteks butaanhappe (sisaldab 4 C aatomit) tasapinnaline struktuurivalem on selline:
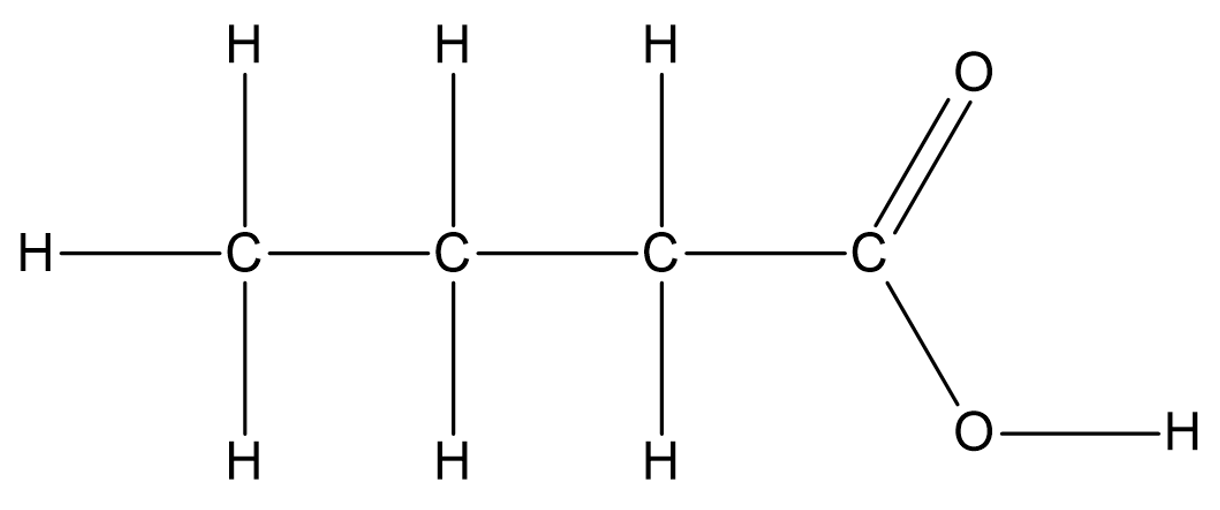
Butaanhape
lihtsustatud struktuurivalem on CH3-CH2-CH2-COOH
ja summaarne struktuurivalem C4H8O2.
Karboksüülhapete nimetamisel lähtutakse vastava süsinike aatomite arvuga süsivesinike nimetusest, lisades sellele lõppliite -hape.
Näiteks: metaan → metaanhape, propaan → propaanhape.
Karboksüülhapete happelisus ja keemilised omadused
Anorgaanilises keemias oled Sa juba õppinud, et on ained, mis annavad vesilahusesse vesinikioone ehk prootoneid (H+). Karboksüülhapped annavad samuti vesilahusesse vesinikioone ning on oluline meeles pidada, et karboksüülhapete korral asub happeline vesinik karboksüülrühmas. Näiteks etaanhape jaguneb vees etaanhappe happejääkiooniks ja vesinikiooniks:
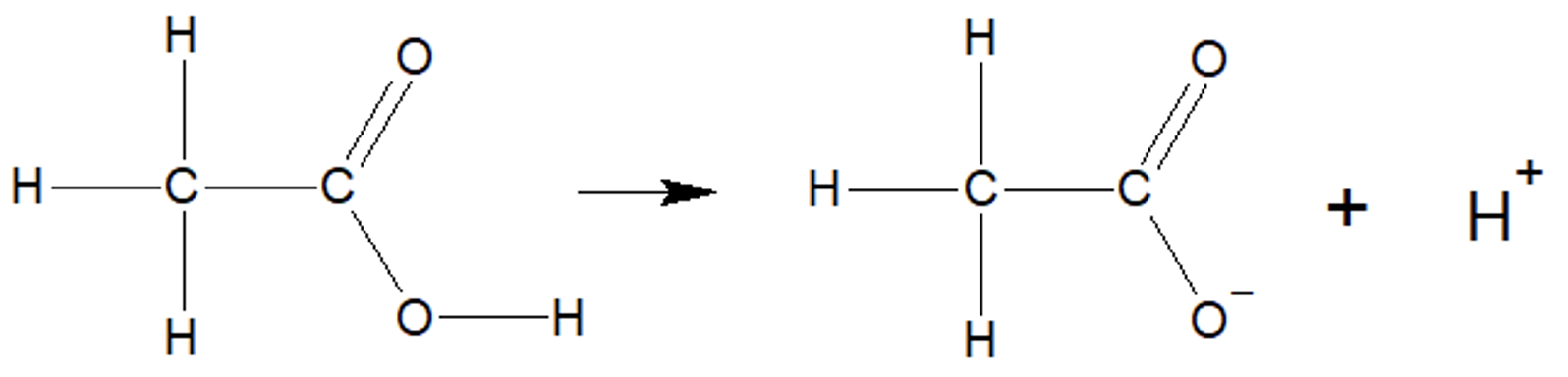
Etaanhappe jagunemine vees etaanhappe happejääkiooniks ja vesinikiooniks
Kuigi karboksüülhapped annavad vesilahusesse vesinikioone ja neil on olemas kõik hapetele iseloomulikud omadused, on nad nõrgad happed.
Karboksüülhapped reageerivad alustega, aluseliste oksiididega ning aktiivsete ja keskmise aktiivsusega metallidega.
KARBOKSÜÜLHAPE + ALUS → SOOL + H2O
1. Karboksüülhappe reaktsioonil alustega tekivad sool ja vesi.
CH3CH2COOH + NaOH → CH3CH2COONa + H2O
2CH3COOH + Ca(OH)2 → (CH3COO)2Ca + 2H2O
See reaktsioon toimub alati ning seda nimetatakse ka neutralisatsioonireaktsiooniks.
KARBOKSÜÜLHAPE + ALUSELINE OKSIID → SOOL + H2O
2. Karboksüülhappe reaktsioonil aluseliste oksiididega tekivad sool ja vesi.
2CH3CH2COOH + CaO → (CH3CH2COO)2Ca + H2O
2CH3COOH + Na2O → 2CH3COONa + H2O
See reaktsioon toimub samuti alati.
KARBOKSÜÜLHAPE + METALL → SOOL + H2↑
3. Karboksüülhape reaktsioonil aktiivsete ja keskmise aktiivsusega metallidega tekivad sool ja vesinik.
2CH3CH2COOH + Zn → (CH3CH2COO)2Zn + H2↑
2CH3COOH + 2Na → 2CH3COONa + H2↑
See reaktsioon ei toimu alati – täpselt nagu anorgaaniliste hapetega, reageerivad ka karboksüülhapetega ainult vesinikust aktiivsemad ehk need metallid, mis asuvad metallide elektrokeemilises aktiivsusreas vesinikust vasakul ehk vesinikust eespool.

Tähtsamad karboksüülhapped
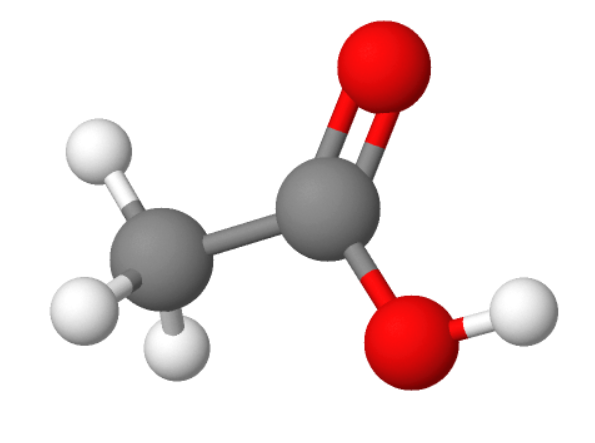
1. Metaanhape ehk sipelghape HCOOH
Metaanhape on terava lõhna ja maitsega, söövitav hape. Metaanhapet leidub sipelgate eritistes, nõgese kõrvekarvakestes ning vähesel määral ka kuuse- ja männiokastes.
Metaanhapet kasutatakse tekstiili- ja nahatööstuses, konservandina silo tegemisel ja desinfitseerimisvahendina toiduainetetööstuses.
2. Etaanhape ehk äädikhape CH3COOH
Kõige tuntum karboksüülhape igapäevaelus. Etaanhape on terava lõhna ja maitsega, vees hästi lahustuv ning kange lahuse korral söövitav vedelik.
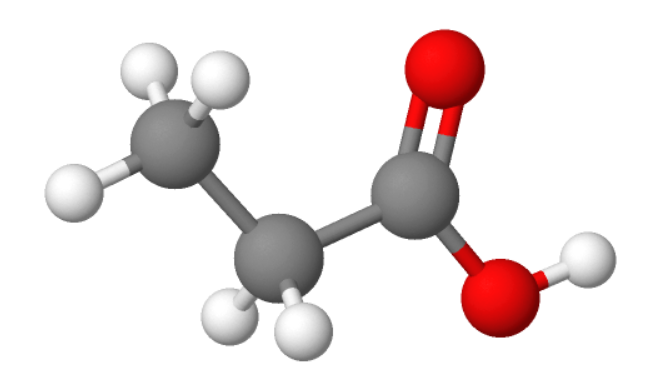
Puhast (99%-list) etaanhapet nimetatakse jää-äädikhappeks, sest alla 16 ºC moodustuvad vedeliku sisse jääsarnased kristallid.
Etaanhapet kasutatakse konservandina (nt seente või kurkide marineerimisel), samuti maitseainena (nt süldi kõrvale). Keemiatööstus kasutab etaanhapet lahustina. Igapäevaelus kasutatakse äädikhapet kõige rohkem katlakivi eemaldamiseks või küpsetiste kergitamiseks koos soodaga.
3. Piimhape CH3CH(OH)COOH
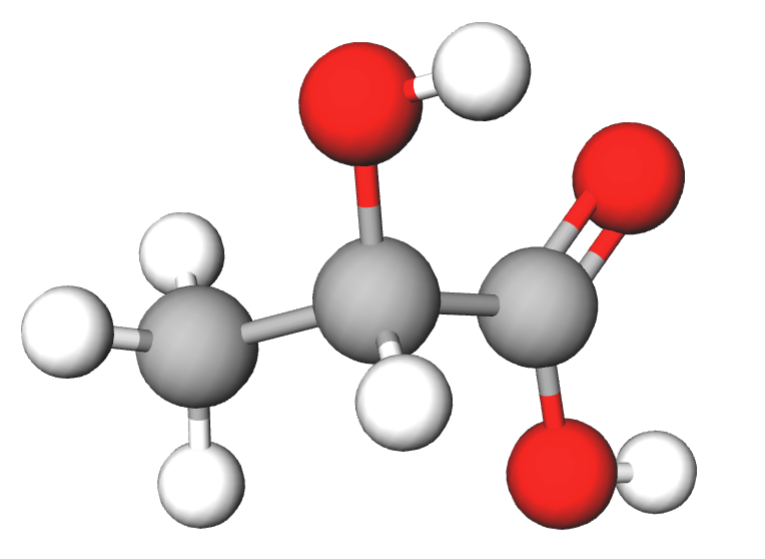
Piimhape tekib piimas oleva suhkru käärimisel piimhappebakterite juuresolekul.
Piimhapet leidub hapupiimas, keefiris ja teistes hapendatud piimatoodetes. Piimhape tekib ka kurkide, kapsaste ja juustu käärimisel hapniku juuresolekuta. Sportlane teab piimhappe mõju lihastele väga hästi: piimhape tekib lihastes veresuhkru lagunemisel ilma hapnikuta ja põhjustab valutunnet pärast pikaajalist intensiivset lihastreeningut.


