
6.2. Molaarmass ja selle seos massiga
Mool on küll keemikute seas väga laialt kasutatav ühik, aga otseselt ei saa kasutada ühtegi mõõteriista moolide mõõtmiseks. Samuti ei osta Sa tavapäraselt lahtiseid komme mitte moolides vaid grammides. Selleks, et aine hulgalt üle minna aine massile, kasutatakse molaarmassi. Milline on mooli ja massi seos ning kuidas leida molaarmassi ning molaarmassi kaudu aine massi, saad vaadata järgmisest videost.
Allikas: https://youtu.be/g1s_JY9rcJs
on ühe mooli aineosakeste mass.
Molaarmassi tähiseks on M ning keemias kõige kasutatavamaks molaarmassi ühikuks g/mol. Selleks, et leida konkreetse ühendi molaarmassi, tuleb liita aine koostises olevate elementide ümardatud aatommassid. Sealjuures tuleb arvestada ka aatomite arvusid ühendis.
Näide 1. Arvuta vee molaarmass.
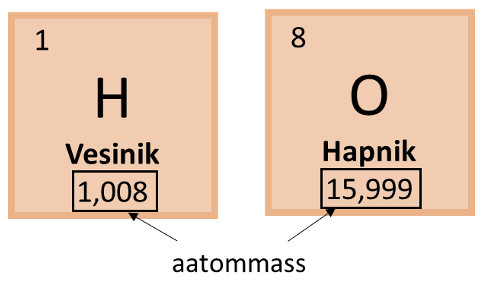 Vee keemiline valem on H2O. Molaarmassi leidmiseks kasutame perioodilisustabelis toodud aatommasse, kuid ümardame need täisarvuks. Vesiniku aatommass on 1,008 ehk ümardatuna täisarvuks 1 ning hapniku aatommass on 15,999 ehk ümardatuna täisarvuks 16. Kuna vee molekulis on 2 vesiniku aatomit, tuleb seda ka arvutuskäigu puhul jälgida ning vee molaarmassi leidmiseks oleks arvutuskäik järgmine:
Vee keemiline valem on H2O. Molaarmassi leidmiseks kasutame perioodilisustabelis toodud aatommasse, kuid ümardame need täisarvuks. Vesiniku aatommass on 1,008 ehk ümardatuna täisarvuks 1 ning hapniku aatommass on 15,999 ehk ümardatuna täisarvuks 16. Kuna vee molekulis on 2 vesiniku aatomit, tuleb seda ka arvutuskäigu puhul jälgida ning vee molaarmassi leidmiseks oleks arvutuskäik järgmine:
M(H2O) = 2 $\times $1 + 16 = 18 g/mol
Järgnevalt on välja toodud veel mõningate ühendite molaarmassid koos arvutuskäiguga. Kontrolli, kas said sama tulemuse.
M(K) = 39 g/mol
M(Al2O3) = 2 $\times $ 27 + 3 $\times $16 = 102 g/mol
M(H2SO3) = 2 $\times $ 1 + 32 + 3 $\times $ 16 = 82 g/mol
M(NaCl) = 23 + 35,5 = 58,5 g/mol
Nagu viimasest näitest selgub, on ka aatommasside ümardamisel erandid. Jäta meelde, et kloori aatommassi väärtus on 35,5 ning vase oma 63,5.
Vali õige molaarmass.
Molaarmassi seos ainehulgaga
$n=\frac{m}{M}$
n – (ühik mol)
m – aine mass (ühik g)
M – molaarmass (ühik g/mol)
Molaarmassi kasutades on võimalik arvutada aine hulka või massi. Ainehulk on avaldatav kui $n=\frac{m}{M}$
kus n tähistab ainehulka (ühik mool, lühend mol), m aine massi (ühik gramm) ning M on molaarmass (ühik g/mol).
Arvutusülesannete lahendamise käiguga oled Sa juba tuttav, kuid kordame selle üle.
Arvutusülesannete lihtsamaks lahendamiseks võid eeskujuks võtta järgnevad sammud:
- Loe ülesande tekst mõttega läbi.
- Jooni tekstis alla kõik arvud.
- Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel.
- Kirjuta välja andmed ning otsitav suurus.
- Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus.
- Asenda valemitesse arvud ning teosta arvutused.
Ole valmis, et mõnikord tuleb ühikuid teisendada.
Teeme koos läbi kaks ülesannet.
Näidisülesanne 1. Ainehulga leidmine
| 1. Loe ülesande tekst mõttega läbi. | Mitu mooli on 9,3 grammis naatriumoksiidis? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Mitu mooli on 9,3 grammis naatriumoksiidis? |
|
3. Omista arvule kindel füüsikaline suurus. |
9,3 grammi näitab aine massi. |
| 4. Kirjuta välja andmed. |
m = 9,3 g Samuti on hetkel teada, et aineks on naatriumoksiid, mille valem on Na2O. Igale ainele, mille valemit Sa tead, saab leida molaarmassi. M(Na2O) = 2 $\times $ 23 + 16 = 62 g/mol Otsitav suurus on hetkel moolide arv, järelikult n = ? |
| 5. Kirjuta välja valemid. | $n=\frac{m}{M}$Kuna antud juhul on vajalik ainehulk, siis valemist mõnda teist suurust avaldama ei pea. |
| 6. Asendame arvud ja teostame arvutused. | $n=\frac{m}{M}=\frac{9,3\ g}{62\ g/mol}=0,15\ mol$ |
Leia ainehulk.
Näidisülesanne 2. Aine massi leidmine
| 1. Loe ülesande tekst mõttega läbi. | Arvuta 3 mol kaaliumnitraadi mass. |
| 2. Jooni alla kõik arvud, mis on tekstis. | Arvuta 3 mol kaaliumnitraadi mass. |
| 3. Omista arvule kindel füüsikaline suurus. | 3 mol näitab ainehulka. |
| 4. Kirjuta välja andmed. |
n = 3 mol Samuti on hetkel teada, et aineks on kaaliumnitraat, mille valem on KNO3. Igale ainele, mille valemit Sa tead, saab leida molaarmassi. M(KNO3) = 39 + 14 + 3 $\times $ 16 = 101 g/mol Otsitav suurus on hetkel mass, järelikult m = ? |
| 5. Kirjuta välja valemid. | $n=\frac{m}{M}$Kuna antud juhul on vajalik mass, siis mass avaldub: m = n $\times $ M |
| 6. Asenda arvud ja teosta arvutused. |
m = 3 mol $\times $ 101 g/mol = 303 g Ka ühikutega saad siin sama tehte teha mol × g/mol, moolid taanduvad maha ning alles jääb massi ühik g. |
Lahenda ülesanded.


