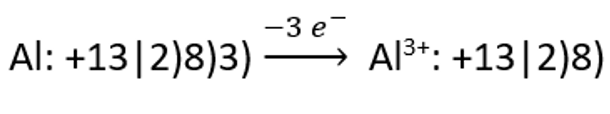2.1. Aatomitest aineteni
Keemia uurimisobjektiks on ained ja nendega toimuvad muundumised. Ained koosnevad aineosakestest ja just aineosakesed kujundavad ainete omadused ning põhjustavad nende muundumisi. Seetõttu tulebki õppida aineosakesi tundma ja selles aitab Sind allolev video.
Allikas: https://youtu.be/DTwdlVdi1pM
Ained koosnevad aineosakestest. Aineosakesed võivad olla aatomid, molekulid või ioonid. on väikseim aineosake, mis koosneb aatomituumast ja elektonkattest. Aatomituum omakorda koosneb prootonitest ja neutronitest, elektonkatte moodustavad aga elektronkihtidel paiknevad elektronid.
|
AATOM |
|
|
Aatomituum |
Elektronkate |
|
Prootonid (laeng +1, mass 1 amü) Neutronid (laeng 0, mass 1 amü) |
Elektronid (laeng -1, mass ≈ 0,0005 amü) |
Elektrone ja prootoneid on aatomis sama palju ja seetõttu on aatom tervikuna neutraalne.
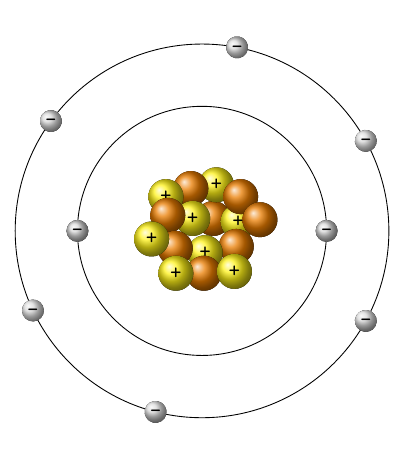
Näiteks hapniku aatomit kirjeldab kõrvalolev mudel. Sellelt saad näha, et hapniku aatomituumas paikneb 8 prootonit (joonisel kollased pallikesed) ja 8 neutronit (joonisel oranžid pallikesed) ning elektronkatte kahes kihis kokku 8 elektroni (joonisel hallid pallikesed): 1. elektronkihil 2 ja välimisel kihil 6 elektroni.
Aatomite massi väljendatakse aatommassiühikutes (amü). Üks aatommassiühik võrdub 1/12 süsiniku aatomi massist. Kuna elektronide mass on niivõrd väike, kuid prootonite ja neutronite mass on võrdne ühe aatommassiühikuga, saab öelda, et aatomi mass on koondunud tema tuuma.
Ühte liiki aatomitest moodustub keemiline element. Kõik keemilised elemendid on paigutatud keemiliste elementide perioodilisustabelisse. Perioodilisustabelis on liigitatud elemendid kahte gruppi, lähtuvalt nende lihtainete keemilistest omadustest: metallilised elemendid ja mittemetallilised elemendid. Tabeli vasakul pool on metallilised ja paremal mittemetallilised elemendid.
Metalliliste elementide lihtainetel on metallidele iseloomulikud omadused. Metallide kasutamine igapäevaelus lähtubki just nende omadustest. Näiteks
|
Füüsikaline omadus |
Kasutusvaldkond |
|
Hea elektrijuhtivus |
Elektrijuhtmete valmistamiseks (vask) |
|
Hea soojusjuhtivus |
Radiaatorite ja sööginõude valmistamiseks (malm) |
|
Metalne läige |
Peeglite valmistamiseks (alumiinium) |
|
Plastilisus ja hea töödeldavus |
Alumiiniumfooliumi, traadi (nikkel), masinaosade (teras) valmistamiseks |
Mittemetallidel puuduvad metallidele iseloomulikud omadused ja omavahel on nad vähem sarnased kui , aga siiski saab välja tuua, et mittemetallid reeglina ei juhi elektrit, on halvad soojusjuhid ning neil puudub metalne läige. Argielus kasutatakse mittemetalle metallidest vähem. Mõned näited: hapnik – hingamiseks ja põlemisprotsessides; vesinik – kütusena; kloor – basseinivee desinfitseerimiseks.
 Korda videost enam kasutatavate elementide nimetusi ja sümboleid.
Korda videost enam kasutatavate elementide nimetusi ja sümboleid.
Selle jaoks, et keemia maailmas paremini hakkama saada, tuleb teada enam kasutatavate elementide nimetusi ja sümboleid.
Aatomi ehituse kohta leiad vajalikku informatsiooni perioodilisustabelist, kui tead järgmisi seoseid:
- elemendi aatomnumber (Z) = tuumalaeng (+) = prootonite arv (p) tuumas = elektronide arv (e–) elektronkattes;
- elemendi massiarv = täisarvuks ümardatud aatommass = prootonite arv + elektronide arv;
- eelmisest seosest tuleneb: neutronite arv = massiarv – prootonite arv;
- perioodi number = elektronkihtide arv elektronkattes;
- rühma number (A-rühmades) = väliskihi elektronide arv. B-rühmade elementide väliskihil on reeglina 2 elektroni.
Aatomite elektronkatte ehituse kirjeldamiseks kasutatakse elektronskeeme. Selleks, et elektronskeemi koostada, pead teadma järgmist:
- 1. elektronkihis saab olla kuni 2 elektroni.
- 2. elektronkihis saab olla kuni 8 elektroni.
- 3. elektronkihis saab olla kuni 18 elektroni.
- 4. elektronkihis saab olla kuni 32 elektroni.
- väliskihis saab olla alati kuni 8 elektroni.
Näiteks magneesiumi elektronskeem on järgmine:
Mg:+12|2)8)2)
Arseenil: As:+33|2)8)18)5)
Molekulid on aineosakesed, mis koosnevad aatomitest. Molekuli koostist kirjeldab molekulivalem, mis näitab, milliste elementide aatomitest (väljendab elemendi sümbol valemis) ja kui paljudest (väljendab ) koosneb.
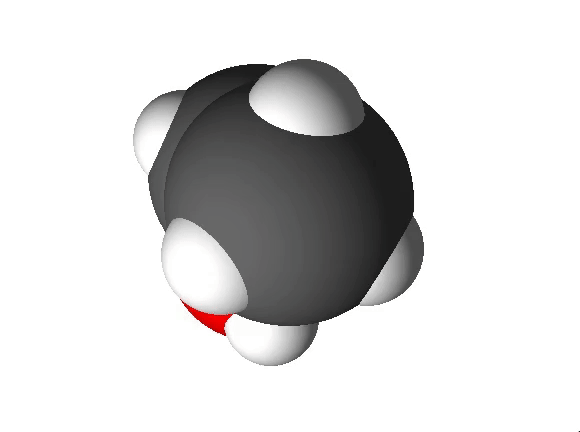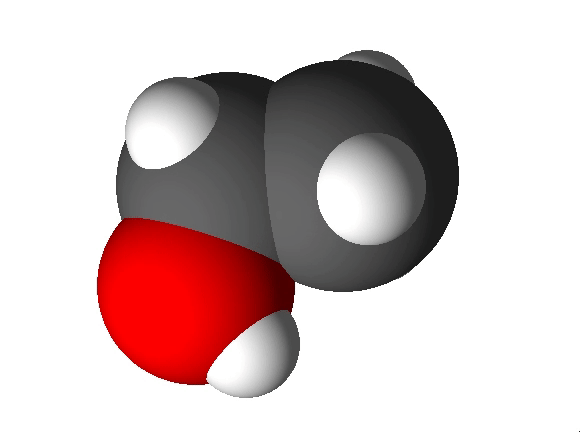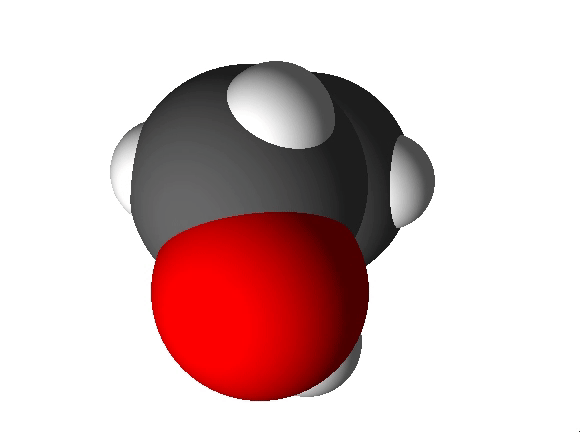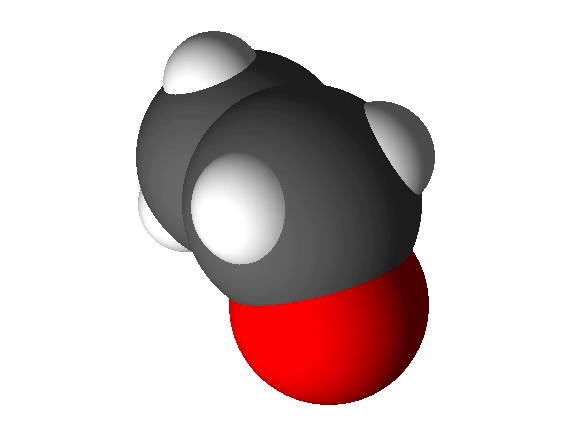
Näiteks näitab etanooli molekulivalem (C2H5OH), et molekul koosneb kolme erineva elemendi aatomitest: 2 süsiniku aatomist, 6 vesiniku aatomist ja 1 hapniku aatomist.
Aatomite ja molekulide kõrval esineb ka kolmas liik aineosakesi – ioonid. on laetud (laenguga) aineosake. Ioonid tekivad aatomitest elektronide liitmise või loovutamise teel. Liidetakse või loovutatakse nii mitu elektroni, et välises elektronkihis oleks 8 elektroni (maksimaalselt täidetud välimine elektronkiht). Need elemendid, mille välimises elektronkihis on vähe elektrone (1-3 e–), loovutavad need ja nii tekib positiivse laenguga ioon ehk . Elemendid, mille välises elektronkihis on aga palju elektrone (5-7 e–), liidavad elektrone, omandades seejuures negatiivse laengu ja tekib .
Kirjeldame näiteks aniooni teket väävli aatomist:
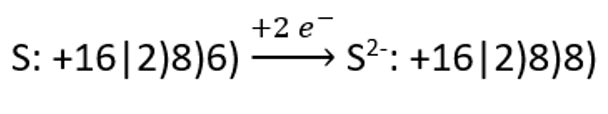
ja katiooni teket alumiiniumi aatomist: