5.6. Hapnik ja hapnikuühendid
Nii maakoores kui elavates organismides leidub hapnikku kõigist elementidest kõige rohkem. Hapnikku esineb looduses mitme allotroopse teisendina. Lisaks tavalisele hapnikule ehk dihapnikule on olemas ka trihapnik ehk osoon. Hapnikku on atmosfääris 21 mahuprotsenti – tekkinud sellesse fotosünteesi tulemusena. Arvatakse, et praktiliselt kogu O2 on tekkinud eluslooduse tõttu. Hingamiseks on hapnik liiga tugev oksüdeerija, seetõttu mürgine. Kogu organismide elutegevuseks vajalik energia saadakse toitainete oksüdeerimisreaktsioonidest, et protsess hapniku redutseerumisel kulgeks kiiresti ega tekiks mürgiseid vaheprodukte. Puhkeolekus on inimese hapnikutarvidus 264 cm3/min.
 Vaata videot hapniku ja gaaside kogumise kohta siit.
Vaata videot hapniku ja gaaside kogumise kohta siit.
Hapnikku leidub ka osoonina O3 atmosfääri ülemises kihis (stratosfääris u 20 km paksuses kihis, maksimaalne tihedus 20–30 km kõrgusel). Osooni kaitsekiht kaitseb ultraviolettkiirguse eest. Osoon on iseloomuliku terava lõhnaga sinaka värvusega mürgine gaas. Väikese osoonisisaldusega õhk on kasulik, sest tapab baktereid. Osoon on ebapüsiv ja laguneb kergesti, eraldades atomaarset hapnikku. Seetõttu on osoon väga tugev oksüdeerija – tugevam kui dihapnik.
Hapniku elektronvalemi on O Z=8| 1s22s22p4. Allpool on toodud ka hapniku aatomi ruutskeem.
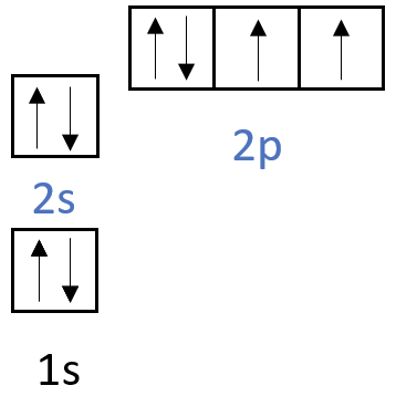
Hapniku viimasel elektronkihil on kokku 6 elektroni, seetõttu on hapniku kõige sagedam o.a -II. Joonisel 1 on toodud hapniku keemilised omadused.
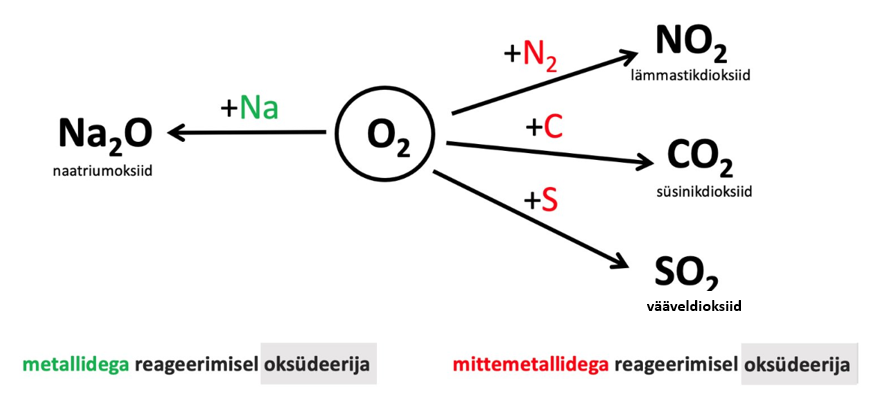
Joonis 1. Hapniku keemilised omadused
Edasi vaatame hapniku tähtsamaid ühendeid.
Oksiidid
 Oksiididest loe täpsemalt siit.
Oksiididest loe täpsemalt siit.
Hapniku tähtsamad ühendid on oksiidid. Need on binaarsed ühendid, mis sisaldavad kahe keemilise elemendi aatomeid, kusjuures üks neist on hapnik. Tavalistes oksiidides on hapniku oksüdatsiooniaste -II ning oksiidid tekivad lihtainete reageerimisel hapnikuga (O2).
Oksiidide saamine:
Metall + O2 → metallioksiid
2Mg + O2 → 2 MgO
Mittemetall + O2→mittemetallioksiid
S + O2 → SO2
Oksiidide üldised omadused ja nende omaduste muutumise peroodilisustabelis võtab kokku tabel 1, kust on näha, et metallioksiidid on ioonsed ained ja aluseliste omadustega. Mittemetallioksiididest on enamik molekulaarsed ained ja happeliste omadustega. Mittemetallioksiidide molekulides on kovalentsed polaarsed sidemed. Aluselised oksiidid on valdavalt ioonilise sidemega tahked kristallilised ained.
Perioodis vasakult paremale aluselised omadused vähenevad ja happelised omadused kasvavad. Üksikutel oksiididel esineb aatomvõre (nt SiO2 – liiva põhikomponent), kus on aatomite vahel tugevad kovalentsed sidemed, mistõttu on need väga püsivad ning kõrge sulamis- ja keemistemperatuuriga. Ioonvõrega metallioksiidid on ka suhteliselt kõrgete sulamis- ja keemistempertuuridega.
Väga aluselised oksiidid reageerivad veega, moodustades vees lahustuva hüdroksiidi:
Na2O + H2O → 2 NaOH
Amfoteersed oksiidid ja neutraalsed oksiidid veega ei reageeri (NO, N2O, CO jt – need on madalama oksüdatsiooniastmega mittemetallide oksiidid).
Enamik happelisi oksiide reageerib veega, moodustades happe (v.a SiO2, mis ei reageeri veega):
SO3 + H2O → H2SO4
CO2 + H2O ↔ H2CO3
Tabel 1. Erinevad oksiidid ja nende omaduste muutus perioodis
|
III periood Perioodis vasakult paremale aluselised omadused muutuvad happelisteks |
|||||||
|
Oksiid |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
|
Omadus |
tugevalt aluseline |
nõrgalt aluseline |
amfoteerne |
nõrgalt |
keskmiselt happeline |
keskmiselt happeline |
tugevalt happeline |
|
Sidemetüüp |
iooniline side |
ioonilis-kovalentne |
kovalentne polaarne |
kovalentne polaarne |
kovalentne polaarne |
vähe kovalentne polaarne |
|
|
Võretüüp |
ioonvõre |
ioonvõre |
aatomvõre |
molekulvõre |
molekulvõre |
||
Hapnikhapped
 Hapete ja hapnikhapete kohta loe täpsemalt siit.
Hapete ja hapnikhapete kohta loe täpsemalt siit.
Hapnikhape on seda tugevam, mida elektronegatiivsem on vastav element ja mida suurem on elemendi oksüdatsiooniaste.
Hapnikhape on hapnikku sisaldav mineraalhape. Tugevaid hapnikhappeid moodustavad suure elektronegatiivsusega elemendid nagu kloor, väävel, lämmastik. Hapnikhape on seda tugevam, mida elektronegatiivsem on vastav element ja mida suurem on elemendi oksüdatsiooniaste. Elemendi oksüdatsiooniastme suurenedes kasvab üldreeglina happe tugevus, näiteks H2SO4 on tugevam hape kui H2SO3.
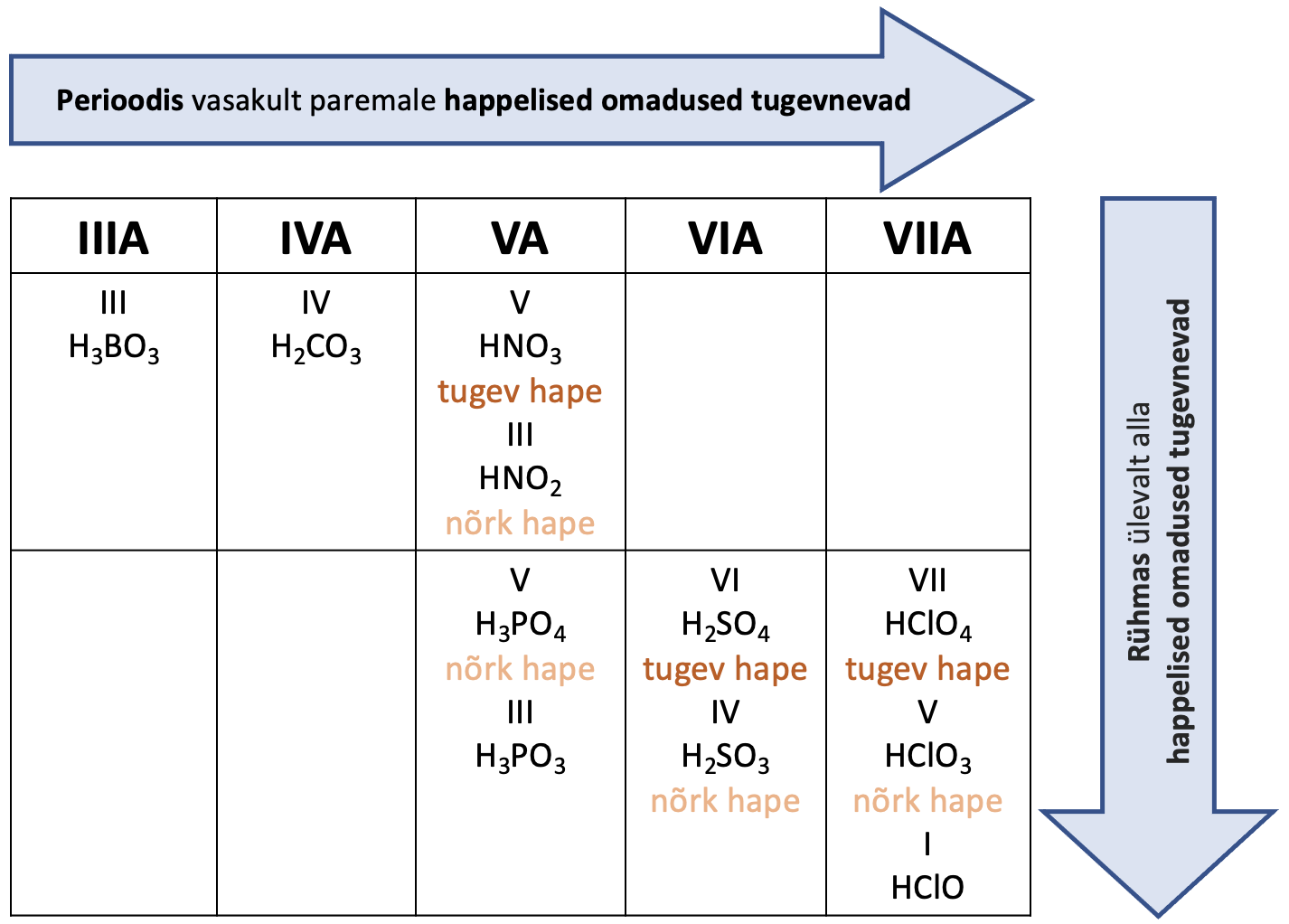
Joonis 2. Tuntumad hapnikhapped
Hapniku saamine
 Elektrolüüsi kohta loe täpsemalt siit.
Elektrolüüsi kohta loe täpsemalt siit.
Laboratoorselt on võimalik O2 saada mitmel erineval viisil. Sagedamini kasutatakse vesinikperoksiidi katalüütilist lagundamist või kaaliumpermanganaadi lagundamist kuumutamisel.
Vesinikperoksiidi katalüütiline lagundamine: 2 H2O2 $\xrightarrow[]{MnO_{2}}$ 2 H2O + O2.
Suuremates kogustes saadakse O2 peamiselt õhu fraktsioneerival destillatsioonil, puhtamat hapnikku aga vee elektrolüüsil – tavaliselt 30%-lisest KOH lahusest. Anoodil eraldub hapnik.
Katoodil: 2 H2O + 2e- → H2 + 2 OH-
Anoodil: 4 H2O- 4e- → O2 + 4 H+
Looduses tekib hapnik fotosünteesil päikesevalguse toimel klorofülli osavõtul:
6 CO2 + 6 H2O = C6H12O6 + 6 O2.
Ülesande 1 lahendused
1.2. Mitu grammi CO2 seob endaga 450 g CaO-i? Mitu grammi soola tekib?
Vastus anna täisarvuna.
Vastus: 354 g; 804 g
Lahendus: kirjutame ja tasakaalustame reaktsioonivõrrandi:
CaO + CO2 → CaCO3
Kuna teame kaltsiumoksiidi massi, saame arvutada esmalt selle molaarmassi M(CaO) = 56 g/mol ja leida seejärel moolide arvu:
\(n(CaO) = {m \over M}= {450g \over 56 g/mol}=8.04mol\)
Reaktsioonivõrrandist näeme, et CaO ja CO2 moolsuhe on 1:1. Seega kulub süsihappegaasi samuti 8,04 mol. Leiame selle massi, arvestades, et M(CO2)=44 g/mol:
m(CO2) = n × M = 8,04 mol × 44 g/mol = 353,76 ≈ 354 g
Reaktsioonivõrrandist näeme, et CaO ja CaCO3 moolsuhe on 1:1. Seega tekib kaltsiumkarbonaati ka 8,04 mol. Leiame selle massi, arvestades, et M(CaCO3)=100 g/mol:
m(CaCO3) = n × M = 8,04 mol × 100 g/mol = 804 g
1.3. Mitu mooli on hapniku aatomeid 112 L (nt) NO2?
Vastus: 10 mol
Lahendus: esmalt leiame NO2 moolide arvu:
\(n(NO_2) = {V \over V_m}= {112dm^3 \over 22.4dm^3/mol}=5mol\)
Brutovalemist näeme, et ühes moolis NO2-s on kaks mooli hapniku aatomeid. 5 moolis NO2-s on seega 2×5=10 mol hapniku aatomeid.
1.4. Looduses tekib hapnik fotosünteesil päikeseenergia arvel klorofülli osavõtul: 6CO2 + 6H2O → C6H12O6 + 6O2. Kui inimene hingab välja 134,4 dm3 CO2(nt), mitu mooli suudavad taimed sellest toota hapnikku, kui protsessi kadu on 30%.
Vastus: 4,2 mol
Lahendus: Esmalt leiame süsihappegaasi moolide arvu, kuna teame selle ruumala 134,4 dm3:
\(n(CO_2) = {V \over V_m}= {134.4dm^3 \over 22.4dm^3/mol}=6mol\)
Reaktsioonivõrrandist näeme, et CO2 ja O2 moolsuhe on 6:6=1:1. Seega tekib hapnikku ka 6 mol. Kuna aga kadu on 30%, tekib seega 70% eeldatavast ainehulgast ehk 0,7×6=4,2 mol.
1.5. Hermeetiliselt suletavasse reaktsioonianumasse juhiti 2 mooli metaani ja 7 mooli hapnikku toatemperatuuril. Toimus reaktsioon CH4 + 2O2 → CO2 + 2H2O
Leia plahvatusjärgse segu koostis - st mitu mooli ja milliseid aineid reaktsiooni segu peale reaktsiooni sisaldab.
Vastus: CO2: 2 mol, H2O: 4 mol, O2: 3 mol
Lahendus: Teame metaani ja hapniku ainehulki. Leiame kõigepealt, kas kumbagi neist on ülehulgas. Reaktsioonivõrrandist näeme, et metaani ja hapniku moolsuhe on 1:2, seega reageerib 2 mooli metaaniga 4 mooli hapnikku. Seega on hapnik ülehulgas ja 7–4=3 mooli jääb segusse alles.
Metaani ja CO2 moolsuhe on 1:1, seega tekib CO2 2 mooli. Metaani ja H2O moolsuhe on 1:2, seega tekib vett 2×2=4 mooli.

