3.4. Lahused ja lahustumise soojusefektid
Ainete lahustumise käigus tekib lahus või kolloidne süsteem.
Kui segad vette söögisoola või suhkrut, siis saad mõlemal juhul ühtlase läbipaistva vedeliku. Ütleme, et sool ja suhkur lahustuvad vees ehk moodustavad veega lahuse.
Lahus on ühtlane segu, mis koosneb vähemalt kahest ainest: lahustuvast ainest ja lahustist. Lahusti on aine, mis on lahuses liias ehk ülehulgas. Toodud näidetes on vesi lahustiks, sool ja suhkur aga lahustunud ained. Lahustunud aine on lahustis jaotunud üliväikeste osakeste – aatomite, molekulide või ioonidena.
 Lahustest ja pihustest saad lisaks lugeda ja vaadata siit.
Lahustest ja pihustest saad lisaks lugeda ja vaadata siit.
Merevesi on lahus, milles lahustunud aineteks on erinevad soolad (NaCl, NaI, KBr jne) ja lahustiks vesi.
Kolloidne süsteem koosneb samuti kahest või enamast ainest, aga ei ole ühtlane segu. Kolloidses süsteemis on üks aine teise sees mikroskoopiliste tilkade või tükkidena pihustunud. Näiteks piim, mis tundub ühtlane, on tegelikult kolloidne lahus, kus vees on pihustunud väikesed rasvatilgad.
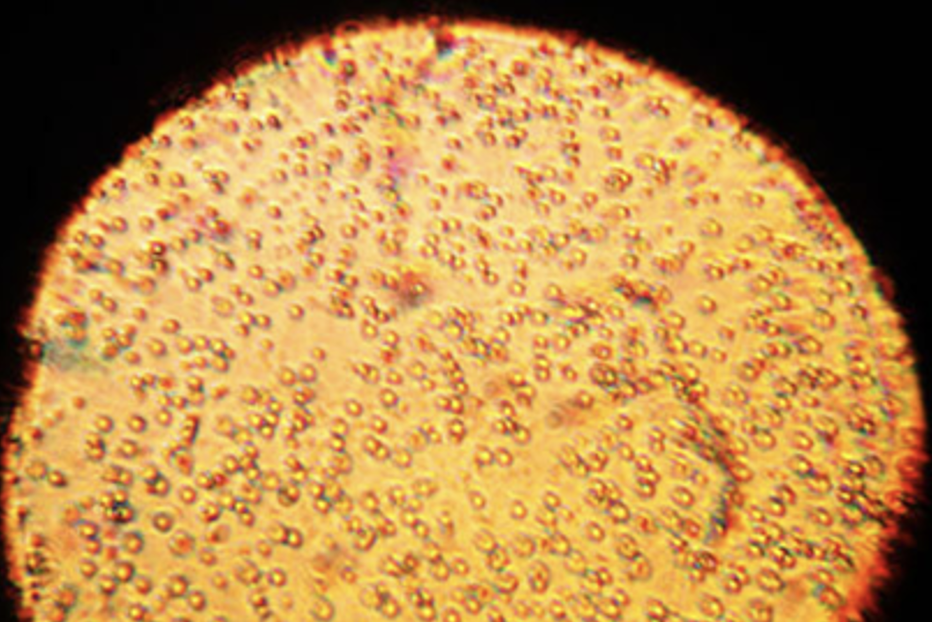
Joonis 1. Kui vaadata piima mikroskoobi all, on võimalik näha väikeseid rasvatilku. Allikas: https://goodscience.com.au/wp-content/uploads/2018/02/milk-under-microscope.jpg
Lahustumisel kehtib põhimõte, et sarnane lahustub sarnases.
Lahustumisel kehtib põhimõte, et sarnane lahustub sarnases. Vesi on polaarne lahusti, seega lahustuvad vees hästi polaarsed ained (etanool) ja/või ioonsed ained (happed, alused, erinevad soolad, nt NaCl, KCl), mille osakesed seonduvad tugevasti vee molekulidega.
Vees lahustuvad paremini polaarsed ained ja ained, mis moodutavad H-sidemeid.
Etanooli molekulid on polaarsed, seetõttu lahustub etanool vees hästi. Lahustumist soodustab lisaks molekulide polaarsusele veel ka H-sidemete teke.
Kui võrrelda erinevate alkoholide lahustuvust, siis selgub, et mida pikemaks lähevad alkoholi süsivesinkahelad, seda halvemini lahustub alkohol vees. Näiteks oktaan-1-ool ei ole vees lahustuv. Alkoholi OH- rühma ja vee molekulide vahel tekib küll H-side, aga samas alkoholi süsivesinikahela ja vee molekulide vahel on väga nõrk vastastiktoime.
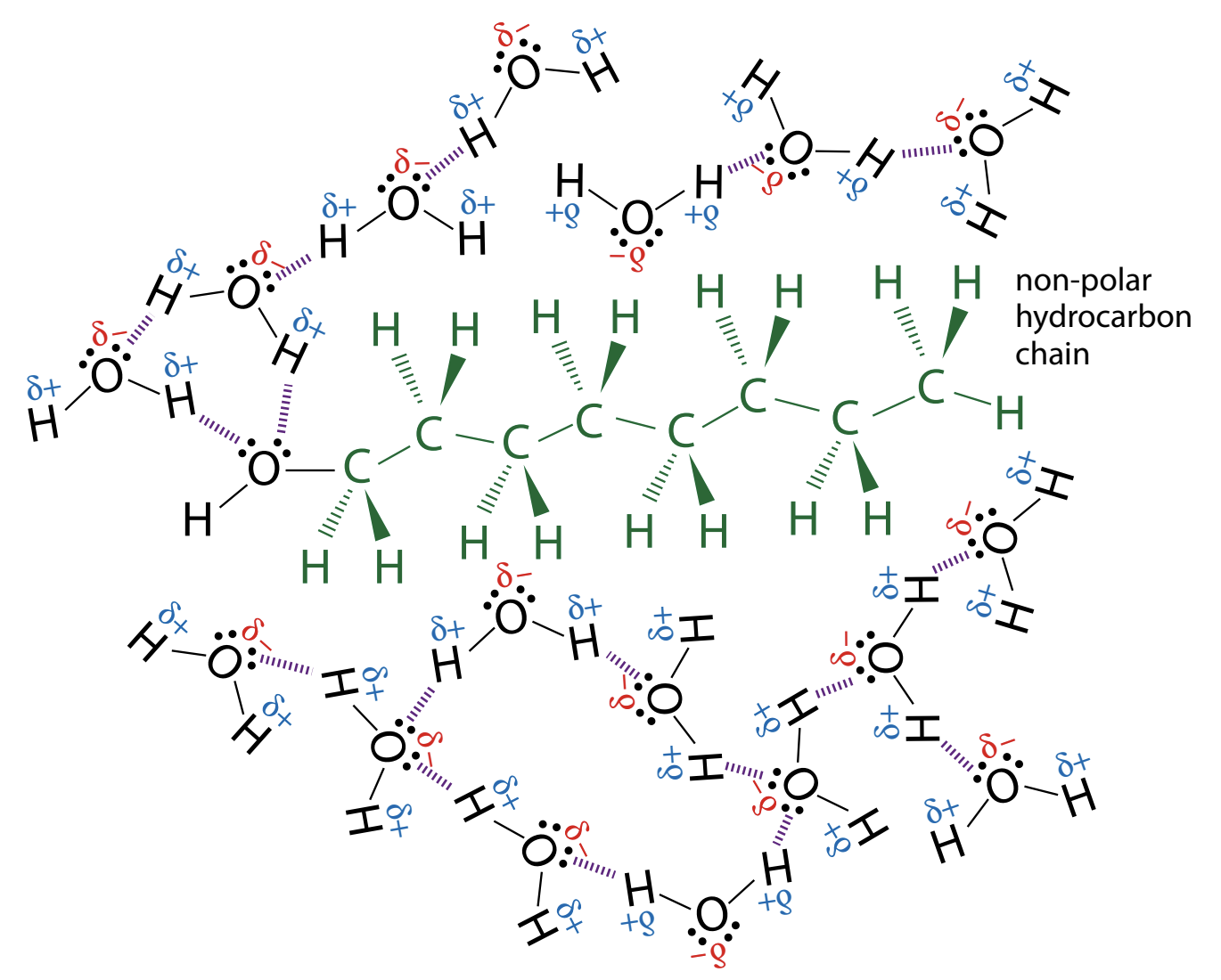
Joonis 2. Oktaan-1-ooli lahustumine vees. Jooniselt on näha, et H-sidemed tekivad ainult alkoholi OH-rühma juures. Süsivesinikahela ja vee molekulide vahel vastastiktoime on väga nõrk ja seetõttu tõrjutakse see osa veest välja. Allikas: https://bit.ly/3M8Hhi3
Mittepolaarsed ained lahustuvad paremini mittepolaarsetes lahustites.
Mittepolaarsed ained (alkaanid, rasvad jmt) lahustuvad paremini mittepolaarsetes lahustites (bensiinis, eetris). Näiteks selleks, et autolt pigiplekke puhastada, peab kasutama mittepolaarset lahustit (nt lakibensiini või spetsiaalset mittepolaarset pigiplekkide eemaldajat). Kuna pigi on mittepolaarne, siis veega puhastades pigiplekkidest lahti ei saa.
Teadmised lahustuvuse kohta on väga olulised näiteks vitamiinide manustamisel. Polaarsed vitamiinid lahustuvad kergesti ja samas väljutatakse organismist kergesti. Mitepolaarsed vitamiinid aga lahustuvad rasvades ning seetõttu ka ladestuvad rasvkoes. Seega on mittepolaarsete vitamiinide korral nende ületarbimine ohtlikum.
Kristallide lahustumine, ioonide teke lahustumisel
Tahkete ainete (nt soolade) lahustumisel kristallvõre lõhutakse ja tekivad ioonid – anioonid ja katioonid.
Ainte lahustumist saab vaadelda kahe järjestikuse etapina:
- Esialgsete sidemte katkemine. Tahkete ainete lahustumisel kristallvõre lõhutakse ja lahustuv aine läheb lahusesse kas molekulidena (näiteks suhkur) või tekivad ioonid – anioonid ja katioonid (näiteks söögisool).
- Uute sidemete teke aineosakeste ja lahusti molekulide vahel – solvatatsioon (kui lahustiks on vesi, siis nimetame seda nähtust hüdratatsiooniks).
Vaatame NaCl lahustumise näite põhjal, millised energeetilised efektid lahustumisega kaasnevad.
 Eksotermilise ja endotermilise protsessi kohta vaata täpsemalt siit.
Eksotermilise ja endotermilise protsessi kohta vaata täpsemalt siit.
- NaCl kristallvõre lagunemine: NaCl $\overset{H_{2}O}{\rightarrow}$ Na+ + Cl−.
- Kristallvõre lõhkumiseks on vaja kulutada energiat ehk tegemist on endotermilise protsessiga (ΔHkr > 0).
- Tekkinud ioonid Na+ ja Cl− hüdraatuvad. Hüdraatumine on ioonide või polaarsete molekulide seostumine lahuses vee molekulidega. Hüdraatumise protsess on kujutatud alloleval skeemil. Ühesuunaline nool tähendab, et protsess kulgeb lõpuni ja lahuses esinevad ainult ioonid. Uute sideme teke aineosakeste vahel on eksotermiline protsess ehk energiat eraldub.
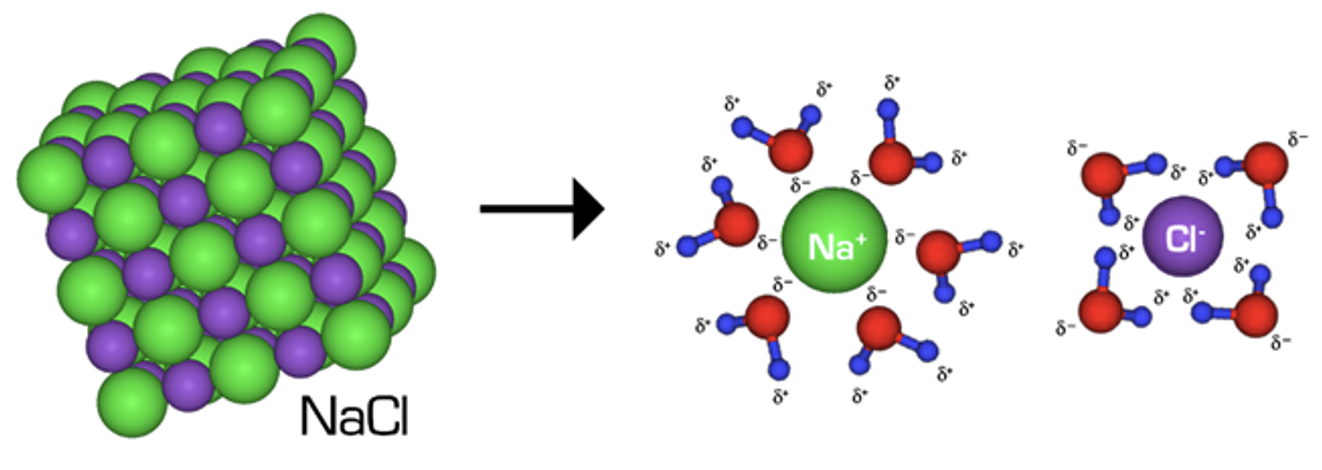
Joonis 3. Keedusoola ehk NaCl hüdraatumine, vee molekulid ümbritsevad lahustunud ioone – ioonid hüdraatuvad. Allikas: https://upload.wikimedia.org/wikipedia/commons/1/16/NaCl_dissolving.png
Kristallvõre lõhkumine on endotermiline protsess (ΔH > 0).
Uue sideme teke aineosakeste vahel on eksotermiline protsess ehk energiat eraldub (ΔH < 0).
- Kristallvõre lõhkumine on endotermiline reaktsioon.
- Hüdraatumisel tekivad uued sidemed ioonide ja vee molekulide vahel. Uute sidemete teke aineosakeste vahel on alati eksotermiline protsess ehk energiat edaldub (ΔHhüdraatumine < 0).
- NaCl lahustumise soojus on seega kahe protsessi soojuse summa: ΔHlahustumine = ΔHkr + ΔHhüdraatumine.
- NaCl lahustumine on summaarselt endotermiline protsess, sest kristallvõre lõhkumiseks kulub rohkem energiat, kui hüdraatumisel vabaneb eneriat, ΔHlahustumine > 0. NaCl lahustumise protsess on kujutatud ka alloleval energiadiagrammil.
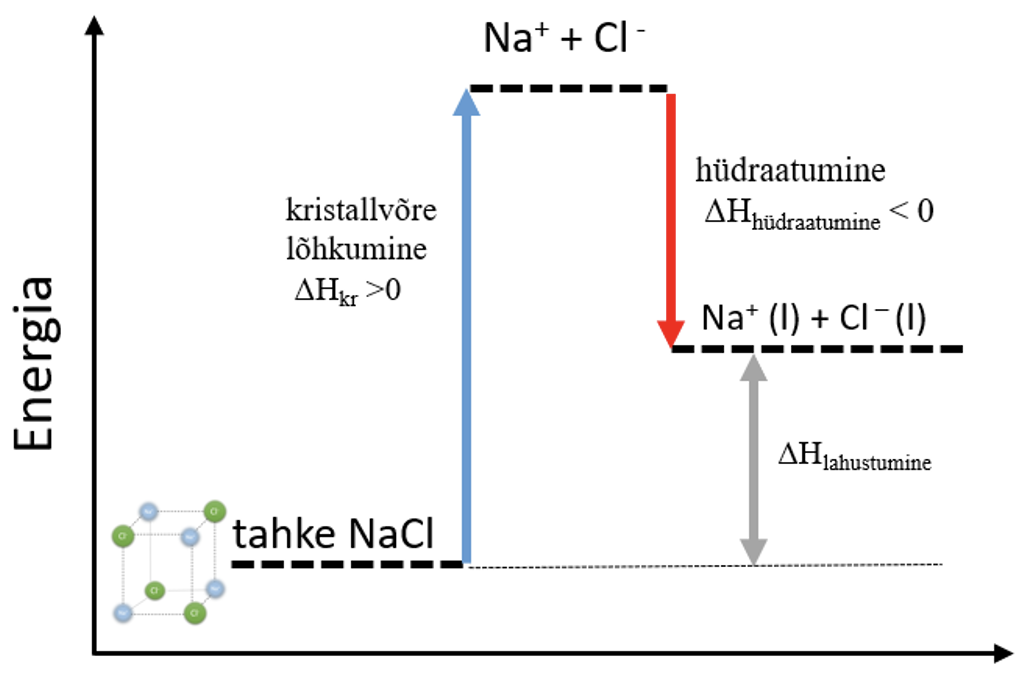
Joonis 4. NaCl lahustumine energiadiagramm
Soolade lahustumine on üldsiselt endotermiline protsess ja lahuse temperatuur langeb.
Hapete ja aluste lahustumine
Tugevate aluste ja hapete lahustumine on eksotermiline protsess ja lahus soojeneb.
Mõned leelised ja happed võivad vees väga tugevasti hüdraatuda. Eriti tugevasti hüdraatuvad ained, mis moodustavad veega vesiniksidemeid. Selliste ainete lahustumisel ületab hüdraatumine algsete sidemete katkemise energia ning protsess on tugevalt eksotermiline – ainete lahustumisel lahus soojeneb. Leeliste (NaOH, LiOH) ja hapete (HCl, H2SO4) lahustumisel tuleb olla väga ettevaatlik, sest nende lahustumisel lahus kuumeneb. Seetõttu tuleb kontsentreeritud hapet alati valada vette, mitte vastupidi. Kui lisada vett kontsentreeritud happele, siis vesi jääb esialgu kihina happe peale, sest hape on veest tihedam. Hape hakkab veekihis lahustuma ja eraldub nii palju soojust, et pealmine happeline veekiht hakkab keema. Kuum, tugevalt happeline ja seega söövitav vedelik hakkab pritsima ja see on väga ohtlik.
Vaatame NaOH vees lahustumist.
- NaOH kritallvõre lõhutakse: NaOH → Na+ + OH−.
- Kristallvõre lõhkumiseks on vaja kulutada energiat ehk tegemist on endotermilise protsessiga (ΔHkr > 0).
- Tekkinud Na+ ja OH− ioonid hüdraatuvad.
- NaOH lahustumise soojus on kahe protsessi soojuse summa: ΔHlahustumine = ΔHkr + ΔHhüdraatumine.
- NaOH (nagu ka teiste tugevate aluste ja ka hapete) lahustumine on eksotermiline protsess, sest hüdraatumise protsessi käigus eralduv energia on suurem kui kristallvõre lõhkumiseks kuluv energia.
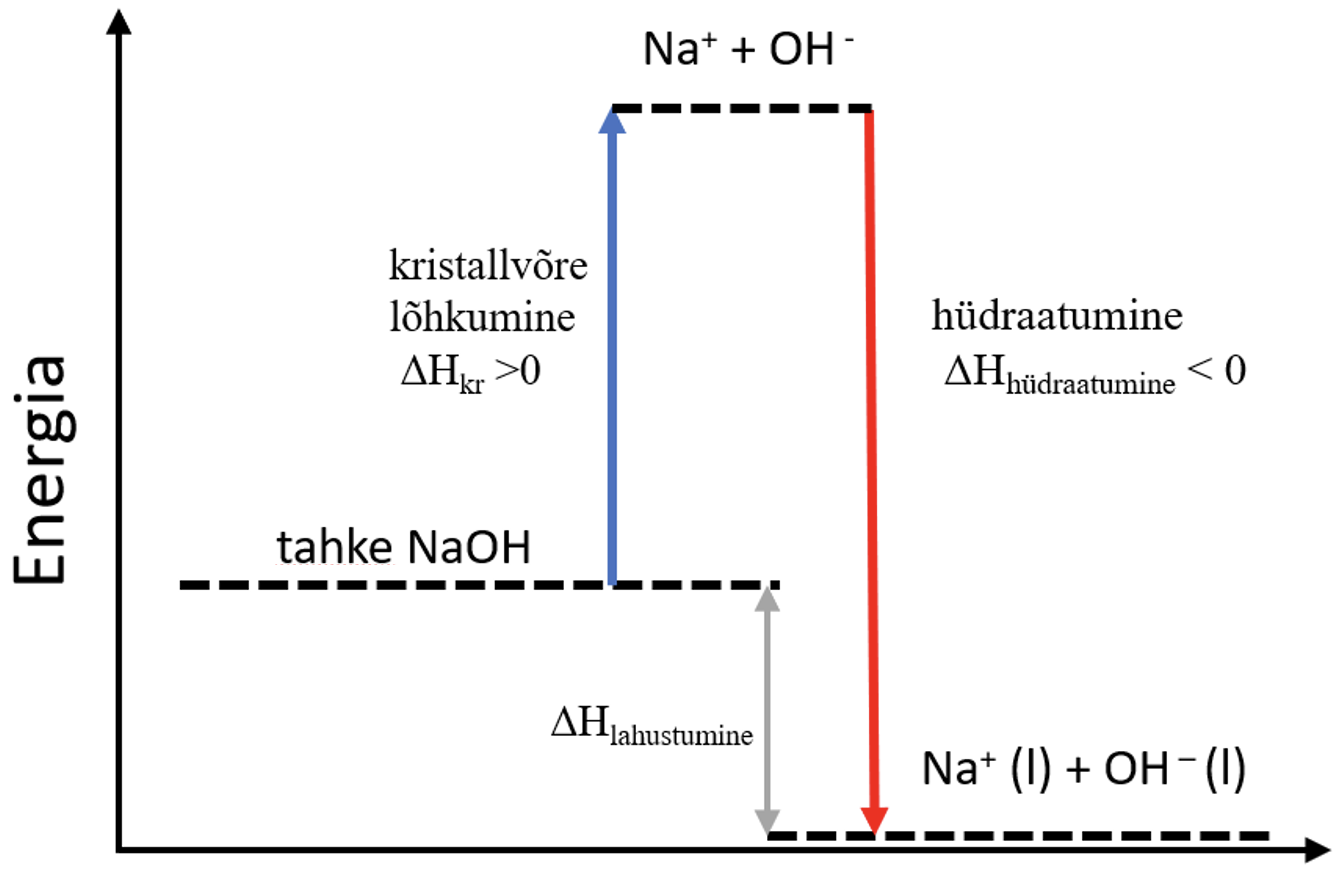
Joonis 5. NaOH lahustumine energiadiagramm
Näidisülesanded
1. Arvuta tabelis toodud andmete põhjal KI lahustumise soojusefekt:
|
KI kristallvõre lõhkumise energia |
629 kJ /mol |
|
K+ hüdraatumise energia |
-322 kJ/mol |
|
I- hüdraatumise enegia |
-293 kJ/mol |
Tabelist on näha, et KI kristallvõre lõhkumise energia on postiivne (endotermiline protsess) ja ioonide hüdraatumine on negatiivne (eksotermiline protsess). KI lahustumise soojusefekt on nende soojusefektide summa:
ΔHlahustumine = 629 kJ/mol + (-322 kJ/mol) + (-293 kJ/mol) = 14 kJ/mol, protsess on endotermiline ja lahuse temperatuur soola lahustumise käigus langeb.
2. Arvuta tabelis toodud andmete põhjal MgCl2 lahustumise soojusefekt:
|
MgCl2 kristallvõre lõhkumise energia |
2493 kJ /mol |
|
Mg2+ hüdraatumise energia |
-1920 kJ/mol |
|
Cl- hüdraatumise enegia |
-364 kJ/mol |
Magneesiumkloriidi lahustumisel tekib kloriidioone 2 korda rohkem kui magneesiumioone, sellepärast tuleb kloriidioonide hüdraatumise energia korrutada kahega.
ΔHlahustumine = 2493 kJ/mol + (-1920 kJ/mol) + 2 × (-364 kJ/mol) = -155 kJ/mol, protsess on eksotermiline ja lahuse temperatuur soola lahustumise käigus tõuseb.
Magneesium iooni laeng on 2+ ja seetõttu selle toime veega palju tugevam kui näiteks Na+ iooni korral. Magneesiumi iooni hüdraatumisel eralduv enegia on palju suurem kui Na+ või K+ iooni hüdraatumisel eralduv energia.

