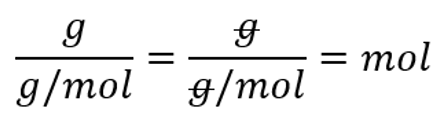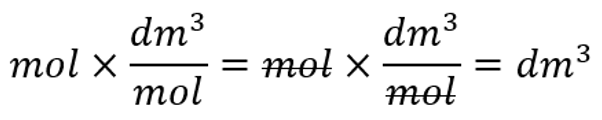6.3. Gaasi molaarruumala
Vedelike või tahkete ainete massi on mugav mõõta kaalumise teel. Gaasiliste ainete massi leidmine on aga küllaltki keeruline protseduur. Palju lihtsam on mõõta gaasiliste ainete ruumala ehk mahtu. Gaasilise aine hulga ja ruumala seob omavahel molaarruumala.
Molaarruumala on ühe mooli aineosakeste ruumala. Molaarruumala tähis on Vm ja ühik dm3/mol.
Eri gaasid sisaldavad ühesugustel tingimustel võrdse ruumala korral võrdse arvu molekule. Sellest tulenevalt on eri gaaside molaarruumalad ühesugustel tingimustel võrdsed. Normaaltingimustel on kõikide gaaside molaarruumala 22,4 dm3/mol. Kuidas molaarruumala leida ning seda erinevates arvutustes kasutada, saad vaadata videost.
Allikas: https://youtu.be/taWb_GV6NXM
Ainehulk on avaldatav ruumalade kaudu, kui $n=\frac{V}{V_{m}}$
Molaarruumala kasutades on võimalik arvutada gaasilise aine hulka või ruumala. Ainehulk on avaldatav ruumala kaudu, kui
$n=\frac{V}{V_{m}}$,
kus n on ainehulga tähis (ühik mool, lühend mol), V on aine ruumala (ühik dm3) ning Vm on molaarruumala (väärtus 22,4 dm3/mol).
Ülesanne 1
Normaaltingimustel on temperatuur 0ºC ja rõhk 1 atm.
Gaaside ruumala arvutamise korral, tuleb alati arvestada temperatuuri ja rõhku. Seetõttu kasutatakse keemias tihti väljendit normaaltingimused (lühendina nt).
Arvutusülesannete lahendamise käiguga oled Sa juba tuttav, kuid kordame selle üle.
Arvutusülesannete lihtsamaks lahendamiseks võid eeskujuks võtta järgnevad sammud:
- Loe ülesande tekst mõttega läbi.
- Jooni tekstis alla kõik arvud.
- Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel.
- Kirjuta välja andmed ning otsitav suurus.
- Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus.
- Asenda valemitesse arvud ning teosta arvutused.
Ole valmis, et mõnikord tuleb ühikuid teisendada.
Teeme koos läbi kolm ülesannet.
Näidisülesanne 1. Ainehulga leidmine
| 1. Loe ülesande tekst mõttega läbi. | Mitu mooli on 60 dm3 hapnikku (nt.)? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Mitu mooli on 60 dm3 hapnikku (nt.)? |
| 3. Omista arvule kindel füüsikaline suurus. | 60 dm3 näitab aine ruumala. |
| 4. Kirjuta välja andmed. |
V = 60 dm3 Samuti on teada gaasi molaarruumala. Vm = 22,4 dm3/mol Otsitav suurus on hetkel moolide arv, järelikult n = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{V}{V_{m}}$ Kuna antud juhul on vajalik leida ainehulk, siis valemist mõnda teist suurust avaldama ei pea. |
| 6. Asendame arvud ja teostame arvutused. | $n=\frac{V}{V_{m}}=\frac{60\ dm^{3}}{22,4\ dm^{3}/mol}\approx 2,7\ mol$ |
Ülesanne 2
Leia ainehulk.
Näidisülesanne 2. Aine ruumala leidmine
| 1. Loe ülesande tekst mõttega läbi. | Arvuta 8 mol süsihappegaasi ruumala. |
| 2. Jooni alla kõik arvud, mis on tekstis. | Arvuta 8 mol süsihappegaasi ruumala. |
| 3. Omista arvule kindel füüsikaline suurus. |
8 mol näitab ainehulka. |
| 4. Kirjuta välja andmed. |
n = 8 mol Samuti on teada gaasi molaarruumala. Vm = 22,4 dm3/mol Otsitav suurus on hetkel ruumala, järelikult V = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{V}{V_{m}}$ Kuna antud juhul on vajalik ruumala, siis see avaldub: V = n $\times $ Vm |
| 6. Asenda arvud ja teosta arvutused. | V = 8 mol $\times $ 22,4 dm3/mol = 179,2 dm3 |
Ülesanne 3
Näidisülesanne 3. Aine ruumala leidmine aine massi kaudu
| 1. Loe ülesande tekst mõttega läbi. | Kui suur ruumala on 23 grammil vesinikul (nt)? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Kui suur ruumala on 23 grammil vesinikul (nt)? |
| 3. Omista arvule kindel füüsikaline suurus. | 23 g on aine mass. |
| 4. Kirjuta välja andmed. |
m = 23g Samuti on teada gaasi molaarruumala. Vm = 22,4 dm3/mol Otsitav suurus on hetkel ruumala, järelikult V = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{V}{V_{m}}$ Kuna antud juhul on vajalik ruumala, siis see avaldub: V = n $\times $ Vm Ruumala leidmise valemis on ainehulk, mille saad leida valemist: $n=\frac{m}{M}$ Aine molaarmassi saad arvutada aatommasside kaudu, võttes appi perioodilisuse tabeli. |
| 6. Asenda arvud ja teosta arvutused. |
M(H2)=2 g/mol $n=\frac{m}{M} = \frac{23\ g}{2\ \frac{g}{mol}}=11,5\ mol$ V = n $\times $ Vm= 11,5 mol $\times $ 22,4 dm3/mol=257,6 dm3 Kontrolliks või ülesande läbi teha ka ühikutega. Ainehulga puhul pead vastuse saama moolides:
Ruumala arvutades peaksid vastuse saama ruumala ühikutes (cm3, dm3, m3):
|
Ülesanne 4
Vihjed:
Süsinikdioksiid ja süsinikoksiidi korral saad gaasi ruumala arvutada sama skeemi alusel. Aine massist arvuta ainehulk: $n=\frac{m}{M}$. Edasi saad leida gaasi ruumala: V = n$\times $Vm. Seejärel võrdle, kumma aine ruumala tuli suurem. Gaasi ruumala kaudu arvuta aine moolide arv $n=\frac{V}{V_{m}}$. Seejärel arvuta aine mass, m = n$\times $M. Jälgi ühikuid!