1. Aineklasside ABC
Üsna tõenäoliselt oskad juba vastata küsimustele, mis on happed, alused, oksiidid ja soolad. Aga aineklasse õppisid juba põhikoolis ning nii mõndagi võib olla meelest läinud. Aineklasside ABC aitab põhilise uuesti üle korrata. Selles peatükis tuletame meelde oksiidide, hapete, aluste ja soolade nimetamise ja valemite koostamise reeglid, aineklasside liigid, keemilised omadused ja saamise võimalused ning vaatame seoseid anorgaaniliste ainete põhiklasside vahel.
1.1. Oksiidid
Oksiidide peatükis räägime, mis on oksiidid, kuidas oksiide nimetatakse ning nende keemilisi valemeid koostatakse. Vaatame, kuidas oksiide liigitada, milliste reaktsioonidega erinevaid oksiide saab ning viimasena käsitleme oksiidide keemilisi omadusi.
Kõige üldisemalt saame defineerida, et oksiidid on ained, mis koosnevad kahest elemendist, millest üks on hapnik. Oksiide leidub kõikjal meie ümber. Üks enam levinud oksiide on näiteks vesi ehk divesinikoksiid (H2O). Suur osa maakoorest koosneb tahketest oksiididest, mis tuleneb sellest, et elemendid on reageerinud õhuhapniku või veega. Samuti on enamik metalle, mis puutuvad kokku hapniku või veega, kaetud oksiidi- või oksiidide kihiga.
Järgnev video võtab kokku olulisemad oksiidide nimetamise, saamise ja keemiliste omaduste reeglid.
Allikas: https://www.youtube.com/watch?v=mPn6iPeGfwk&list=PLDWTb1SlW-s0UQDpn7rtAmyba3HoLd2xu
Nimetamine
Oksiidide nimetamisel peab esmalt teadma, kas tegemist on metalli- või mittemetallioksiidiga. Metallioksiidid koosnevad metallilisest elemendist ja hapnikust (nt CaO, Na2O). Mittemetallioksiidid koosnevad mittemetallilisest elemendist ja hapnikust (nt H2O, CO2).
 Korda videost üle, kuidas määrata oksüdatsiooniastet ja tasakaalustada ühendit.
Korda videost üle, kuidas määrata oksüdatsiooniastet ja tasakaalustada ühendit.
Metallioksiidide nimetamine
Metallioksiidide nimetamisel tuleb eelnevalt teada, kas metall on püsiva oksüdatsiooniastmega või mitte. Sellest tulenevalt on kaks metallioksiidide nimetamise reeglit:
1. metalli nimi + oksiid, kui oksiidi koostises oleval metallilisel elemendil on püsiv oksüdatsiooniaste (I, II ja III A-rühma metallilised elemendid):
nt CaO - kaltsiumoksiid, Na2O - naatriumoksiid, Al2O3 - alumiiniumoksiid;
2. metalli nimi + (o.a) + oksiid, kui oksiidi koostises oleval metallilisel elemendil on muutuv oksüdatsiooniaste (ülejäänud metallillised elemendid), nt
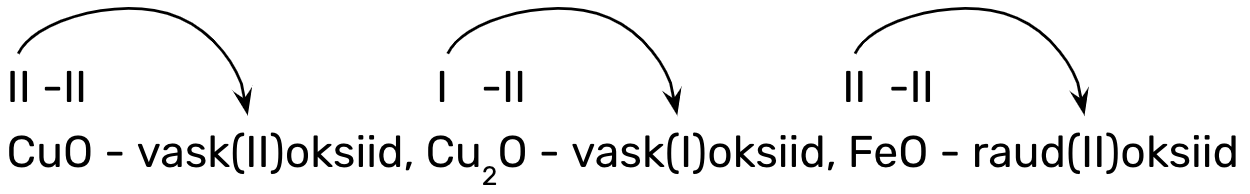
Mittemetallioksiidide nimetamine
Mittemetallioksiidide nimetamisel kasutatakse kreekakeelseid eesliiteid:
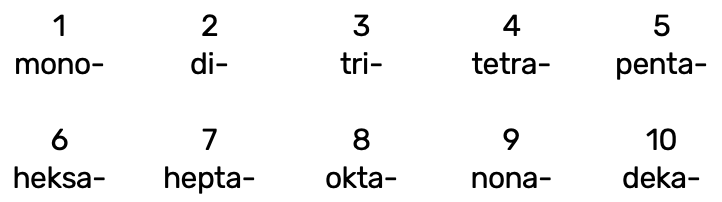
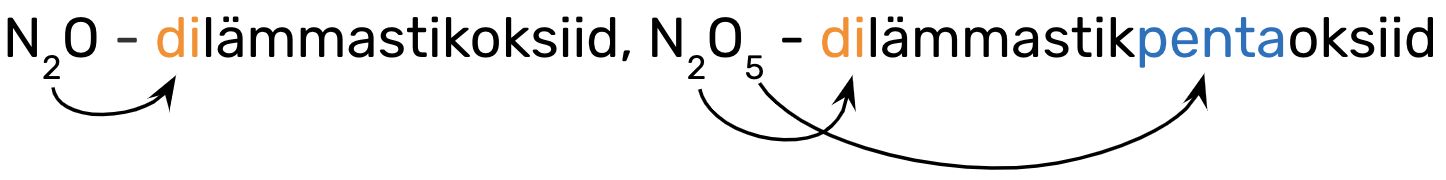
Eesliide käib selle mittemetallilise elemendi nimetuse ette, mille aatomite arvu ta näitab, nt
Ülesanne 1
Vali oksiidi õige nimi.
Valemite koostamine
Oksiidide valemite koostamisel tuleb lähtuda järgmistest reeglitest:
- kirjuta kõrvuti oksiidi moodustava metallilise või mittemetallilise elemendi ja hapniku sümbolid;
- kui on tegemist mittemetallilise elemendiga, siis jälgi eesliiteid ja kirjuta need vastava elemendi sümboli järele indeksisse;
- kui on tegemist metallilise elemendiga, märgi elementide sümbolite kohale oksüdatsiooniastmed ja tasakaalusta vajadusel valem.
Näide 1. Koostame divesinikoksiidi valemi.
- Kõigepealt märgi kõrvuti vesiniku ja hapniku sümbolid: HO.
- Kuna tegemist on mittemetallioksiidiga, arvesta eesliiteid.
- Kuna eesliide on vesiniku ees ja di- tähendab kahte, siis on molekulis 2 vesiniku aatomit ning molekuli valemi saame kirjutada H2O.
Näide 2. Koostame liitiumoksiidi valemi.
- Kõigepealt märgi kõrvuti liitiumi ja hapniku sümbolid: LiO.
-
Tegemist on metallioksiidiga, märgi elementide kohale oksüdatsiooniastmed:
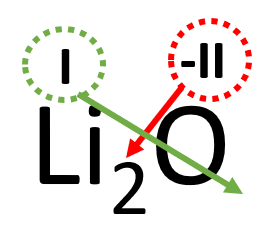
- Kuna oksüdatsiooniastmed on erineva väärtusega, tuleb valem tasakaalustada.
- Hetkel on liitiumi aatomil positiivne laeng ja hapniku aatomil kaks negatiivset laengut. Selleks, et ühendi laeng oleks tervikuna null, peab võtma kaks positiivselt laetud liitiumi aatomit, see kirjutatakse alla indeksisse.
- Sellest tulenevalt kujuneb liitiumoksiidi valemiks Li2O.
Ülesanne 2
Milline on oksiidi õige valem?
Oksiidide liigitamine
Oksiidid jaotatakse metallioksiididideks ja mittemetallioksiidideks. Samas on võimalik neid jaotada ka happelisteks, aluselisteks, neutraalseteks ja amfoteerseteks oksiidideks.
Happelised oksiidid on hapetele vastavad oksiidid, mis tuleneb sellest, et enamik happelisi oksiide reageerib veega ja moodustub hape. Tuntuimad happelised oksiidid on mittemetallioksiidid, nt SO2, CO2.
Aluselised oksiidid on alustele vastavad oksiidid, mis tuleneb sellest, et enamik aluselisi oksiide reageerib veega ja moodustub alus. Tavaliselt on aluselised oksiidid metallioksiidid, nt CaO, Li2O.
Neutraalsed oksiidid on oksiidid, millel puuduvad nii aluselised kui ka happelised omadused, nt CO, NO ja N2O. Need oksiidid ei reageeri aluste, hapete ega veega.
Amfoteersed oksiidid on oksiidid, millel on korraga nii aluselised kui ka happelised omadused ehk need oksiidid reageerivad nii aluste kui ka hapetega, nt Al2O3, ZnO, Cr2O3.
Eri liiki oksiidide näited leiad allolevast tabelist, kus ühendi all on ära toodud selle nimi:
|
ALUSELISED |
HAPPELISED |
NEUTRAALSED |
AMFOTEERSED |
|
Li2O |
SO2 |
H2O |
ZnO |
|
Na2O |
SO3 |
CO |
BeO |
|
CaO |
NO2 |
N2O |
Al2O3 |
|
MgO |
P4O10 |
NO |
PbO |
Oksiidide saamine
Nagu alguses juba mainitud, puutume igapäevaelus kokku väga paljude erinevate oksiididega (H2O - vesi, õhus leidub veel lisaks CO2, CO, NO, NO2 jne, maakoores SiO2, CaO, MgO jne). Üks peamisi põhjuseid, miks oksiide nii laialdaselt leidub, on see, et oksiidid tekivad väga kergesti liht- või liitaine kokkupuutel õhuhapnikuga.
1. Oksiidid tekivad liht- või liitainete reageerimisel hapnikuga.
2 Ca + O2 → 2 CaO
4 Al + 3 O2 → 2 Al2O3
CH4 + 2 O2 → CO2↑ + 2 H2O
Reageerimist hapnikuga nimetatakse ka põlemisreaktsiooniks. Metallide põlemisel tekivad aluselised oksiidid ning mittemetallide põlemisel happelised oksiidid.
Oksiide saab toota ka tööstuslikult, näiteks soolade kuumutamisel kõrgetel temperatuuridel.
2. Oksiidide teke soolade termilisel lagunemisel.
CaCO3 (t)  CaO(t) + CO2(g)
CaO(t) + CO2(g)
Lubjakivi (CaCO3) kuumutamisel põhineb kustutamata lubja (CaO) tootmine.
3. Oksiidide teke rasklahustuvate hüdroksiidide termilisel lagunemisel.
2 Al(OH)3 (t)  Al2O3(t)+ 3 H2O(g)
Al2O3(t)+ 3 H2O(g)
Cu(OH)2 (t)  CuO(t) + H2O(v) (Joonis 1)
CuO(t) + H2O(v) (Joonis 1)
Ca(OH)2(t) 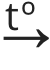 CaO(t) + H2O(g)
CaO(t) + H2O(g)
(Ca(OH)2 - kustutatud lubi; CaO - kustutamata lubi)

Joonis 1. Pildil on illustreeritud oksiidi teke rasklahustuvast hüdroksiidist, Cu(OH)2-st. Laborites saab sellist katset läbi viia, kuumutades sinist värvi tahket Cu(OH)2 piirituslambi kohal. Tekkinud must sade on CuO. Värvuse muutumine on üks keemilise reaktsiooni tunnuseid.
Oksiidide keemilised omadused
Sõltuvalt sellest, kas tegemist on happelise, aluselise, amfoteerse või neutraalse oksiidiga, on oksiididel erinevad keemilised omadused ehk võime reageerida teiste ainetega.
1. Happelise oksiidi reageerimisel veega moodustub hape.
HAPPELINE OKSIID + H2O = HAPE
SO3(t) + H2O(v) → H2SO4(l) väävelhape
SO2(g)+ H2O(v) 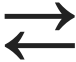 H2SO3(l) väävlishape
H2SO3(l) väävlishape
CO2(g)+ H2O(v)  H2CO3(l) süsihape
H2CO3(l) süsihape
P4O10(t) + H2O(v) → H3PO4(l) fosforhape
N2O5(g) + H2O(v) → HNO3(l) lämmastikhape
SiO2 ei reageeri veega. SiO2 on liiva põhikomponent.
Oluline on meeles pidada, et oksiidis ja talle vastavas happes peab mittemetallilisel elemendil olema sama oksüdatsiooniaste (o.a). Happelised oksiidid ja neile vastavad happed on toodud tabelis 1.
Tabel 1. Happelistele oksiididele vastavad happed
|
HAPPELINE OKSIID |
VASTAV HAPE |
HAPPE NIMETUS |
|
SO2 |
H2SO3 |
väävlishape |
|
SO3 |
H2SO4 |
väävelhape |
|
CO2 |
H2CO3 |
süsihape |
|
P4O10 |
H3PO4 |
fosforhape |
|
N2O5 |
HNO3 |
lämmastikhape |
2. Aluselise oksiidi reageerimisel veega moodustub tugev alus ehk leelis.
ALUSELINE OKSIID + H2O = TUGEV ALUS
CaO + H2O → Ca(OH)2
Na2O+ H2O → 2 NaOH
Veega reageerivad ainult I A rühma ja alates kaltsiumist II A rühma metallide oksiidid.
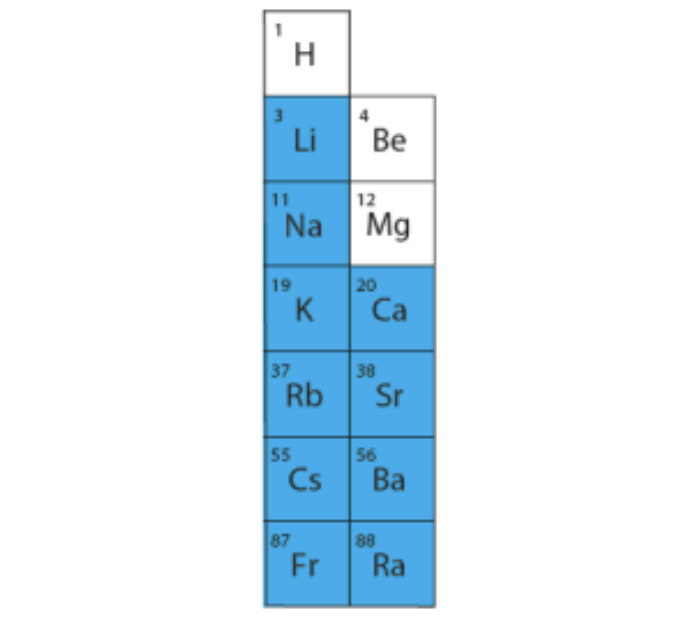
Joonis 2. Sinisega on märgitud metallid, mille oksiidid reageerivad veega ja tekib tugev alus ehk leelis.
Tabel 2. Aluselistele oksiididele vastavad alused
|
ALUSELINE OKSIID |
VASTAV ALUS |
ALUSE NIMETUS |
|
Li2O - liitiumioksiid |
LiOH |
liitiumhüdroksiid |
|
Na2O - naatriumoksiid |
NaOH |
naatriumhüdroksiid |
|
CaO - kaltsiumoksiid |
Ca(OH)2 |
kaltsiumhüdroksiid |
|
BaO - baariumoksiid |
Ba(OH)2 |
baariumhüdroksiid |
3. Aluselise oksiidi reageerimisel happelise oksiidiga moodustub sool.
ALUSELINE OKSIID + HAPPELINE OKSIID = SOOL
CaO + CO2  CaCO3
CaCO3
6 Li2O + P4O10 → 4 Li3PO4
See reaktsioon toimub alati ning tekib happelisele oksiidile vastava happe sool. Happelisele oksiidile vastava happe leiad tabelist 1.
4. Happeline oksiid reageerib alusega, moodustub sool ja vesi.
HAPPELINE OKSIID + ALUS = SOOL + H2O
SO2(g) + 2 NaOH(l) → Na2SO3(l) + H2O(v)
CO2(g) + Ca(OH)2(l) → CaCO3(t) + H2O(v)
See reaktsioon toimub alati.
5. Aluseline oksiid reageerib happega, moodustub sool ja vesi.
ALUSELINE OKSIID + HAPE = SOOL + H2O
2 HNO3 + CaO → Ca(NO3)2 + H2O
See reaktsioon toimub alati.
1.2. Happed
Selles peatükis käsitleme ühte väga olulist ühendite klassi, happeid. Happed mängivad meie igapäevaelus väga suurt rolli - nad on puhastusvahendite koostisosad ja kasutuses toitude konserveerimisel. Inimkehas on keerulised süsteemid, mis kontrollivad hoolikalt vere happelisust, sest isegi väikesed kõrvalekalded võivad põhjustada tõsiseid haigusi ja surma. Sama tundlikkus on olemas ka teistes eluvormides. Need, kellel on troopilised kalad või kuldkalad, teavad, kui oluline on jälgida akvaariumi vee happesust.
Ka tööstuslikult on happed väga olulised. Näiteks toodetakse igal aastal väga suures koguses väävelhapet, et toota väetisi, polümeere, terast ja paljusid muid materjale.
Allolevast videost saad teada, kuidas happeid nimetada, kuidas happeid saada ning millised on hapete keemilised omadused.
Allikas: https://youtu.be/aYWA4Od8nhU
Kõige lihtsama käsitluse järgi on happed ained, mis annavad vesilahusesse vesinikioone (H+). Üks tuntuim hape on vesinikkloriidhape, keemilise valemiga HCl. HCl triviaalnimetusteks on ka maohape ja soolhape. Maohappe roll ongi toidu ja joogi keemiline lagundamine. HCl kasutatakse ka basseinivee puhastamisel ja muudes puhastustoodetes.
Hapetega kokkupuutel peab meeles pidama, et nad on väga söövitava toimega. Juba väike tilk väävelhapet söövitab riidesse suure augu.

Joonis 1. Juba väike tilk väävelhapet söövitab riidesse suure augu.
 Loe lisaks: Arrheniuse hapete-aluste teooria.
Loe lisaks: Arrheniuse hapete-aluste teooria.
Happed on ained, mis loovutavad prootoneid. Arrheniuse hapete-aluste teooria järgi on happed ained, mis annavad vesilahusesse vesinikioone ehk prootoneid (H+): HCl → H+ + Cl-. Kuna vesinikioone vesilahuses üksikult ei eksisteeri, on nad alati seotud veemolekulidega – lahuses on hüdrooniumioonid (H3O+). Lisaks on H3O+-ioon seotud suure hulga vee molekulidega vesiniksidemete kaudu. Kineetiliselt on need assotsiaadid aga väga ebapüsivad – poolestusaeg τ ≈10-13 sekundit (eluiga). Üksikult olev prooton (H+) liitub alati läheduses oleva veemolekuliga ning hüppab ühe veemolekuli juurest teise juurde vesiniksidemete kaudu.
Nimetamine ja valemite koostamine
Happed koosnevad vesinikust ja happejääkioonist. Selleks, et hapete valemite kirjutamine läheks ladusamalt, õpi selgeks tabelis 1 toodud happejääkioonid ja nende nimetused.
Tabel 1. Mõningate anorgaaniliste hapete ning vastavate happejääkioonide (happeanioonide) valemid ja nimetused. Jäta meelde nii happe nimetus kui ka sellele vasta happejääkioon.
|
Hape |
Happejääkioon |
||
|
Valem |
Nimetus |
Valem |
Nimetus |
|
HCl |
vesinikkloriidhape (kasutatakse ka nimetust soolhape) |
Cl- |
kloriid |
|
HBr |
vesinikbromiidhape |
Br- |
bromiid |
|
HI |
vesinikjodiidhape |
I- |
jodiid |
|
HF |
vesinikfluoriidhape |
F- |
fluoriid |
|
H2S |
divesiniksulfiidhape |
S2- |
sulfiid |
|
H2SO3 |
väävlishape |
SO32- |
sulfit |
|
H2SO4 |
väävelhape |
SO42- |
sulfaat |
|
HNO3 |
lämmastikhape |
NO3- |
nitraat |
|
HNO2 |
lämmastikushape |
NO2- |
nitrit |
|
H2CO3 |
süsihape |
CO32- |
karbonaat |
|
H3PO4 |
fosforhape |
PO43- |
fosfaat |
|
H2SiO3 |
ränihape |
SiO32- |
silikaat |
Hapete liigitamine
1. Tugevuse järgi
- 1) Tugevad happed on vesilahuses täielikult ioonideks jagunenud, nt HCl, HBr, HI, HNO3, H2SO4.
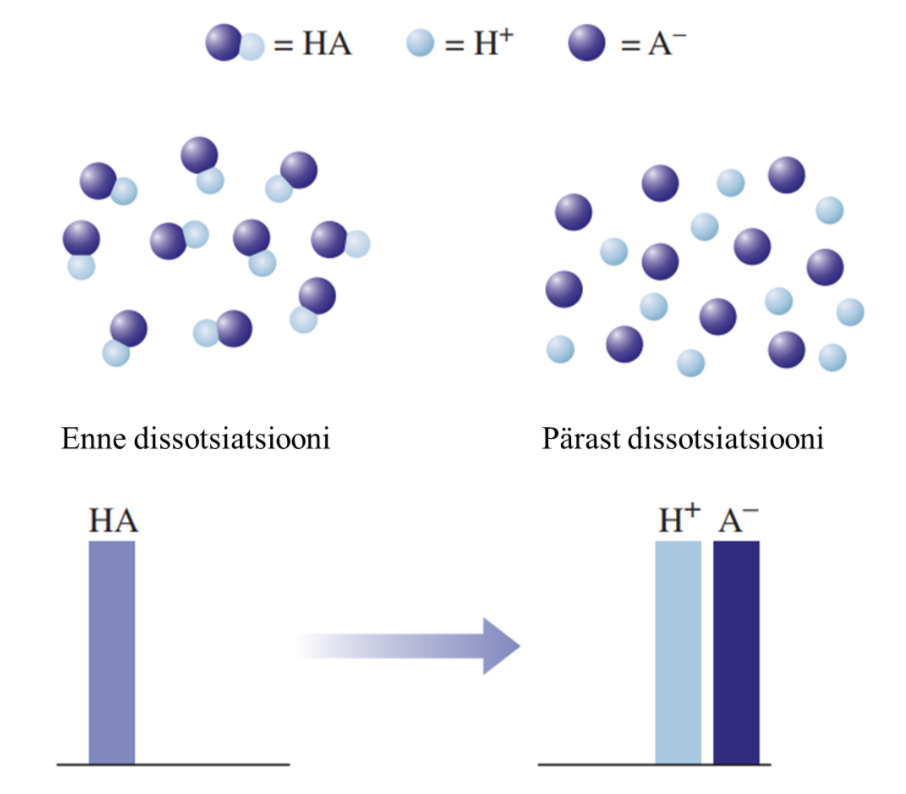
Joonis 2. Graafiline esitus tugeva happe käitumise kohta vees. Kus HA tähistab hapet, H+ vesinikioone, ja A- happejääkioone. Tugeva happe korral on näha, et hape on täielikult jagunenud ioonideks.
- 2) Nõrgad happed on vesilahuses vaid osaliselt ioonideks jagunenud (kõik happed, välja arvatud tugevad happed), nt H3PO4, H2SO3, H2S, H2CO3, H2SiO3, HF.
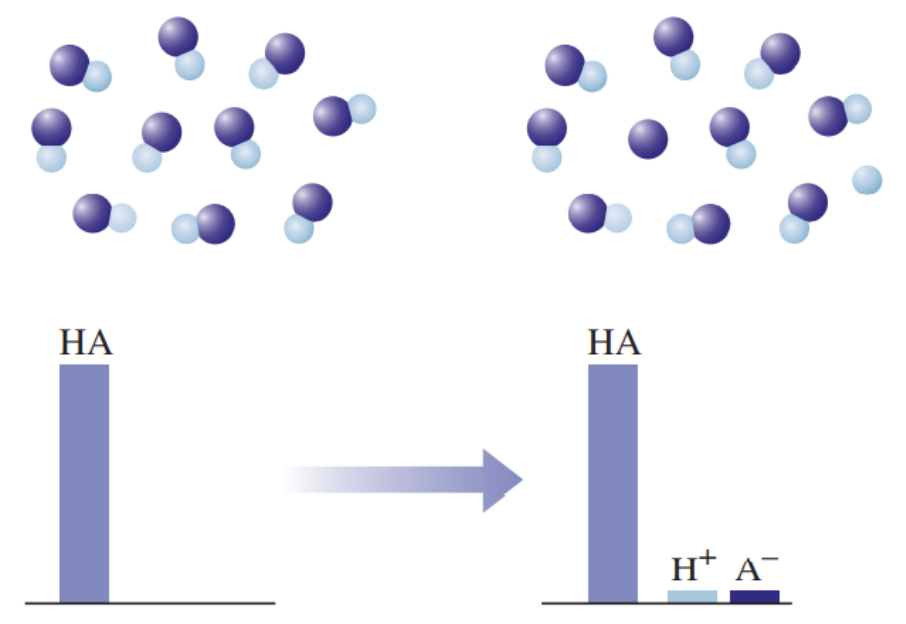
Joonis 3. Graafiline esitus nõrga happe käitumise kohta vees, kus HA tähistab hapet, H+ vesinikioone, ja A- happejääkioone. Ainult väga väike osa happest on jagunenud ioonideks.
Nõrga happe vesilahuses on olemas nii negatiivse laenguga happeanioonid, positiivse laenguga vesinikioonid kui ka happe molekulid, st happe molekulid on vaid osaliselt ioonideks jagunenud. Seevastu tugeva happe vesilahuses happemolekule ei ole, on vaid negatiivse laenguga happeanioonid ja positiivse laenguga vesinikioonid.
2. Prootonite arvu järgi
- 1) Üheprootonilised happed, mille keemilises valemis on üks vesinikioon, nt HCl, HBr.
- 2) Mitmeprootonilised happed, mille keemilises valemis on mitu vesinikiooni, nt H2SO4, H3PO4.
3. Hapnikusisalduse järgi
- 1) Hapnikhapped sisaldavad hapniku aatomeid, nt H2SO4, H2SiO3.
- 2) Hapnikuta happed ei sisalda hapniku aatomeid, nt H2S, HCl.
Hapete keemilised omadused
HAPE + ALUS → SOOL + H2O
1. Aluse ja happe vaheline reaktsioon on neutralisatsioonireaktsioon, mille tulemusena tekib sool ja vesi.
HCl + NaOH → NaCl + H2O
H2SO4 + 2LiOH → Li2SO4 + 2H2O
Seda tüüpi reaktsioon kulgeb siis, kui
- mõlemad lähteained lahustuvad vees ja tekib nõrk elektrolüüt vesi;
- tahkele või vees mittelahustuvale alusele lisada happelahust;
- tahkele või vees mittelahustuvale happele lisada aluselahust. Nt ränihape + tugev alus NaOH.
Väga nõrga happe ja aluse vaheline reaktsioon ei toimu (nt Cu(OH)2 + H2S).
HAPE + METALL → SOOL + H2↑
2. Happed reageerivad metallidega, tekivad sool ja vesinik.
2 Na + 2 HCl → 2 NaCl + H2↑
2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2↑
Zn + 2 HCl (lahj.) → ZnCl2 + H2 ↑
Mg + 2 HCl (lahj.) → MgCl2 + H2 ↑
Fe + 2 HCl (lahj.) → FeCl2 + H2 ↑
2 Al + 6 HCl (lahj.) → 2 AlCl3 + 3 H2 ↑

Joonis 4. Tsingi, magneesiumi, raua ja alumiiniumi reaktsioon 18%-lise HCl-lahusega
Kõik metallid ei reageeri hapetega ühtmoodi. Metallide võimet hapete lahustest vesinikku välja tõrjuda iseloomustab metallide pingerida:

Metallid, mis on vesinikust vähemaktiivsed ja asuvad vesinikust paremal, ei reageeri lahjade happelahustega.
Cu + lahj HCl → ei toimu
Metallid, mis on vesinikust aktiivsemad ja asuvad metallide pingereas vesinikust vasakul (joonisel märgitud sinise kastiga), reageerivad lahjendatud hapete vesilahustega.
Erandiks on lahjendatud lämmastikhappe lahus, mis antud skeemi järgi ei reageeri, sest on väga tugev oksüdeerija. Konts. HNO3 on tugevam oksüdeerija kui H2SO4. Lahjendatud HNO3-s (erinevalt H2SO4-st) on oksüdeerijaks anioonid (NO3- -ioonid), mitte H+-ioonid. Seetõttu ka lahja HNO3-lahuse reageerimisel metallidega ei eraldu vesinikku. Sõltuvalt happe kontsentratsioonist, metalli aktiivsusest ning temperatuurist võivad saadused olla erinevad.
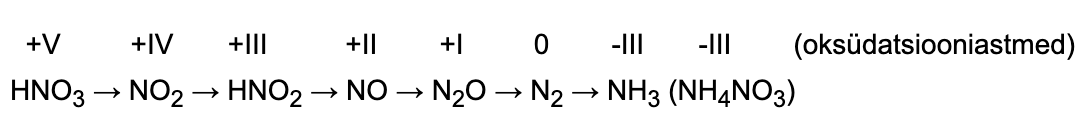
METALL + LÄMMASTIKHAPE → SOOL + VESI + LÄMMASTIKUÜHEND
Vaatleme näitena Zn reageerimist erineva kontsentratsiooniga lämmastikhappe lahusega. Katseandmete põhjal on välja pakutud järgmine jaotus ning võrrandid.
Zn + 4 konts HNO3 → Zn(NO3)2 + 2 NO2↑ + 2 H2O
3 Zn + 8 lahj HNO3 → 3 Zn(NO3)2 + 2 NO↑ + 4 H2O
Lämmastikhappe vesilahusega reageerivad ka vähemaktiivsed metallid Cu, Hg, Ag.
HAPE + ALUSELINE OKSIID → SOOL + H2O
3. Happed reageerivad aluseliste oksiididega, tekivad sool ja vesi.
See reaktsioon toimub alati.
2 HCl + BaO → BaCl2 + H2O
2 HNO3 + CaO → Ca(NO3)2 + H2O
CuO + H2SO4 → CuSO4 + H2O
1.3. Alused
Igapäevaelus kohtame aluseid harvemini kui happeid. Aluseid sisaldavad näiteks kodused puhastusvahendid. Alused on ained, mis annavad vesilahusesse hüdroksiidioone (OH--ioone). Laiemas tähendused on alused ained, mis liidavad vesinikioone ehk prootoneid. Tuntumad alused on hüdroksiidid, mis koosnevad metalli katioonist ja hüdroksiidioonist.
Kuidas aluseid nimetatakse ja millised on aluste keemilised omadused, vaata järgnevast videost.
Allikas: https://youtu.be/ANIUet7khb8
Nimetamine ja valemite koostamine
Hüdroksiidide nimetuse üldkuju: metalli nimi + (o.a) + hüdroksiid.
Aluste nimetamisel tuleb eelnevalt teada, kas alust moodustaval metallil on püsiv oksüdatsiooniaste või mitte. Sellest tulenevalt on kaks aluste nimetamise reeglit:
1. kui metallilisel elemendil on püsiv oksüdatsiooniaste, siis antakse nimetus: metalli nimi + hüdroksiid
nt NaOH - naatriumhüdroksiid, Al(OH)3 - alumiiniumhüdroksiid
2. kui metallilisel elemendil on muutuv oksüdatsiooniaste, siis määratakse kõigepealt metalli o.a ning siis antakse nimetus: metalli nimi + (o.a) + hüdroksiid
nt CuOH - vask(I)hüdroksiid, Fe(OH)2 - raud(II)hüdroksiid.
Aluse valemi koostamist vaatame kaltsiumhüdroksiidi näite põhjal.
1. Valemi koostamisel kirjuta kõigepealt üksteise kõrvale metalli katioon ning seejärel hüdroksiidioon, nt Ca2+ OH-.
2. Kasuta alaindekseid, et saaksid tervikuna neutraalse ühendi (kogu laeng peab = 0). Antud näites tuleb võtta kaks OH- iooni. Tähtis on meeles pidada, et hüdroksiidioon on liitioon, mis koosneb hapnikust ja vesinikust, sellepärast pane OH--rühm sulgude vahele.
Kogu eelnevat arutelu arvesse võttes on kaltsiumhüdroksiidi valem Ca(OH)2.
Aluste liigitamine
Tugevad alused ehk leelised on vees hästi lahustuvad hüdroksiidid. Tugevad alused on kõik I A rühma metallide hüdroksiidid (LiOH, NaOH, KOH, RbOH, CsOH). II A rühmas on tugevad alused alates Ca-st, liikudes rühmas allapoole (Ca(OH)2, Sr(OH)2, Ba(OH)2).
Nõrgad alused on enamjaolt vees mittelahustuvad hüdroksiidid, nt Fe(OH)2, Al(OH)3.
Aluste keemilised omadused
ALUS + HAPE → SOOL + H2O
1. Alused reageerivad hapetega, tekivad sool ja vesi, see on neutralisatsioonireaktsioon.
NaOH + HCl → NaCl + H2O
2 LiOH + H2SO4 → Li2SO4 + 2 H2O
Vaata täpsemalt hapete peatükist.
ALUS + HAPPELINE OKSIID → SOOL + H2O
2. Alused reageerivad happeliste oksiididega, moodustuvad sool ja vesi.
2 LiOH + CO2 → Li2CO3 + H2O
Ca(OH)2 + SO3 → CaSO4 + H2O
Pea meeles, et moodustuv sool koosneb aluse katioonist ja happelisele oksiidile vastavast happe anioonist, mis on toodud hapete peatükis olevas tabelis.

ALUS $\xrightarrow[]{temp.}$ ALUSELINE OKSIID + H2O
3. Vees lahustumatud alused lagunevad kuumutamisel, tekivad aluseline oksiid ja vesi.
Fe(OH)2 $\xrightarrow{temp.}$ FeO + H2O
Cu(OH)2 $\xrightarrow{temp.}$ CuO + H2O
Mida väiksema aktiivsusega on metall, seda kergemini selle hüdroksiid kuumutamisel laguneb.
Ülesanne 3
1.4. Soolad
Soolad on igapäevaelus väga laialdaselt kasutuses. Näiteks toitu saad maitsetada soolaga, siin mõeldakse peamiselt naatriumkloriidi ehk NaCl. Kooki saad kergitada vesiniksoola naatriumvesinikkarbonaadiga (NaHCO3). NaCl ja kaaliumkloriidi (KCl) lisatakse mineraliseeritud veele Värska.
Soolad on ained, mis koosnevad metalli katioonist ja happejääkioonist ehk happeanioonist. Kuidas soolasid nimetatakse ja milliste reaktsioonide tulemusena soolad saadakse, vaata järgmisest videost.
Allikas: https://youtu.be/TQ-110H2mL8
Nimetamine
Soolade nimetamise üldkuju:
katiooni nimi + (o.a) + happejääkiooni nimi
Soolade nimetamisel vaata, millist katiooni (metalliiooni) sool sisaldab ja milline on katioonile järgnev happejääkioon.
Soolade nimetamise üldkuju: katiooni nimi + (o.a) + happejääkiooni nimi.
Happejääkioonide nimed on toodud hapete teema tabelis.
Soolade nimetamisel vaata eelnevalt, kas metalliiooni oksüdatsiooniaste on püsiv või muutuv. Sellest tulenevalt on kaks nimetamise reeglit.
1. Kui soola koostises oleval metallilisel elemendil on püsiv oksüdatsiooniaste, antakse nimetus: metalli nimi + happejääkiooni nimi
nt NaCl - naatriumkloriid, AlBr3 - alumiiniumbromiid.
2. Kui soola koostises oleval metallilisel elemendil on muutuv oksüdatsiooniaste, antakse nimetus: metalli nimi + (o.a) + happejääkiooni nimi
nt CuCO3 - vask(II)karbonaat, Fe2(SO4)3 - raud(III)sulfaat.
Valemite koostamine
Soola valemi koostamist vaatame kahe näite põhjal.
1. näide. Kirjuta kaltsiumkloriidi valem.
- Kirjuta kõigepealt teineteise kõrvale metalli katioon ning seejärel happejääkioon, nt Ca2+ Cl-.
- Võrdsusta positiivsed ja negatiivsed laengud, et ühend oleks tervikuna neutraalne. Antud näites tuleb anioone võtta 2 tükki.
- Eelnevat arvesse võttes on kaltsiumkloriidi valem CaCl2.
2. näide. Kirjuta raud(III)sulfaadi valem.
- Kirjuta kõigepealt teineteise kõrvale metalli katioon ning seejärel happejääkioon, nt Fe3+ SO42-.
-
Võrdsusta positiivsed ja negatiivsed laengud, et ühend oleks tervikuna neutraalne. Antud näites tuleb katioone võtta 2 ja anioone 3 tükki.
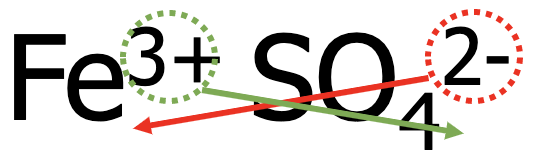
- Eelnevat arvesse võttes on kaltsiumkloriidi valem Fe2(SO4)3.
Ülesanne 2
Soolade liigitamine
Lihtsoolad koosnevad metalliioonist ja „tavalisest“ happejääkioonist (vt hapete teema tabelit).
Vesiniksoolad koosnevad metalliioonist ja happejääkioonist ning vesinikust. Vesinikku sisaldavaid happejääkioone annavad lahusesse mitmeprotoonsed happed. Tuntuim vesiniksool on naatriumvesinikkarbonaat (NaHCO3) ehk söögisooda. Vesiniksoolad tekivad aluse ja happe vahelisel reaktsioonil, kui alust ei ole piisavalt happe täielikuks neutraliseerimiseks. Nt süsihappe ja kaaliumhüdroksiidi vahelise reaktsiooni tulemusena võib moodustuda nii kaaliumkarbonaat kui ka kaaliumvesinikkarbonaat.
H2CO3 + KOH → KHCO3 + H2O
kaalimvesinikkarbonaat - vesiniksool
H2CO3 + 2 KOH → K2CO3 + 2 H2O
kaaliumkarbonaat - lihtsool
Nagu näha, kulub ühe osa kaaliumkarbonaadi tekkimiseks 2 osa kaaliumhüdroksiidi, kuid kaaliumvesinikkarbonaadi tekkimiseks kulub vaid üks osa kaaliumhüdroksiidi.
Happed, mis tekitavad vesiniksoolasid ning hapetele vastavad happejääkioonid
|
Hape |
-1 H+ |
-2 H+ |
-3 H+ |
|
H2CO3 |
HCO3- vesinikkarbonaatioon |
CO32- karbonaatioon |
- |
|
H3PO4 |
H2PO4- divesinikfostaatioon |
HPO42- vesinikfostaatioon |
PO43- fosfaatioon |
|
H2SO3 |
HSO3- vesiniksulfitioon |
SO32- sulfitioon |
- |
Soolade saamine
Keemilisi reaktsioone, mille käigus soolad moodustuvad, oleme juba oksiidide, hapete ja aluste osas käsitlenud, aga olgu need siin kokkuvõtlikult uuesti kirjas.
1. HAPE + ALUS → SOOL + H2O
HCl + NaOH → NaCl + H2O
2. HAPE + METALL → SOOL + H2↑
3 H2SO4 + 2 Al → Al2(SO4)3 + 3 H2↑
See reaktsioon ei toimu alati. Lahjendatud hapetega reageerivad vaid need metallid, mis on vesinikust aktiivsemad ehk asuvad metallide elektrokeemilise aktiivsuse reas vesinikust eespool ehk vesinikust vasakul (vt hapete osa).
3. HAPE + ALUSELINE OKSIID → SOOL + H2O
2 HNO3 + CaO → Ca(NO3)2 + H2O
See reaktsioon toimub alati.
4. ALUS + HAPPELINE OKSIID → SOOL + H2O
2 LiOH + CO2 → Li2CO3 + H2O
See reaktsioon toimub alati.
5. ALUSELINE OKSIID + HAPPELINE OKSIID → SOOL
CaO + CO2 → CaCO3
See reaktsioon toimub alati ning tekib happelisele oksiidile vastava happe sool.
6. Ühest soolast võib saada ka teise soola.
TUGEV HAPE (või ALUS) + SOOL → UUS SOOL + VÄHE DISSOTSIEERUV, MITTELAHUSTUV või LENDUV ÜHEND
CH3COOH + NaHCO3 → CH3COONa + H2O + CO2↑
Selle reaktsiooni alusel kerkivad pannkoogid. Etaanhappe asemel on sel juhul muidugi sidrunhape või keefiris leiduv piimhape.
2NH4Cl(t) + Ca(OH)2(t) 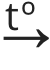 CaCl2 + 2NH3↑ + 2H2O ↑
CaCl2 + 2NH3↑ + 2H2O ↑
Nii valmistatakse laboratooriumis vajadusel ammoniaaki.
FeCl3 + 3 NaOH → Fe(OH)3 $\downarrow $+ 3 NaCl
Selliselt saab valmistada vees mittelahustuvaid hüdroksiide.
Ülesanne 3
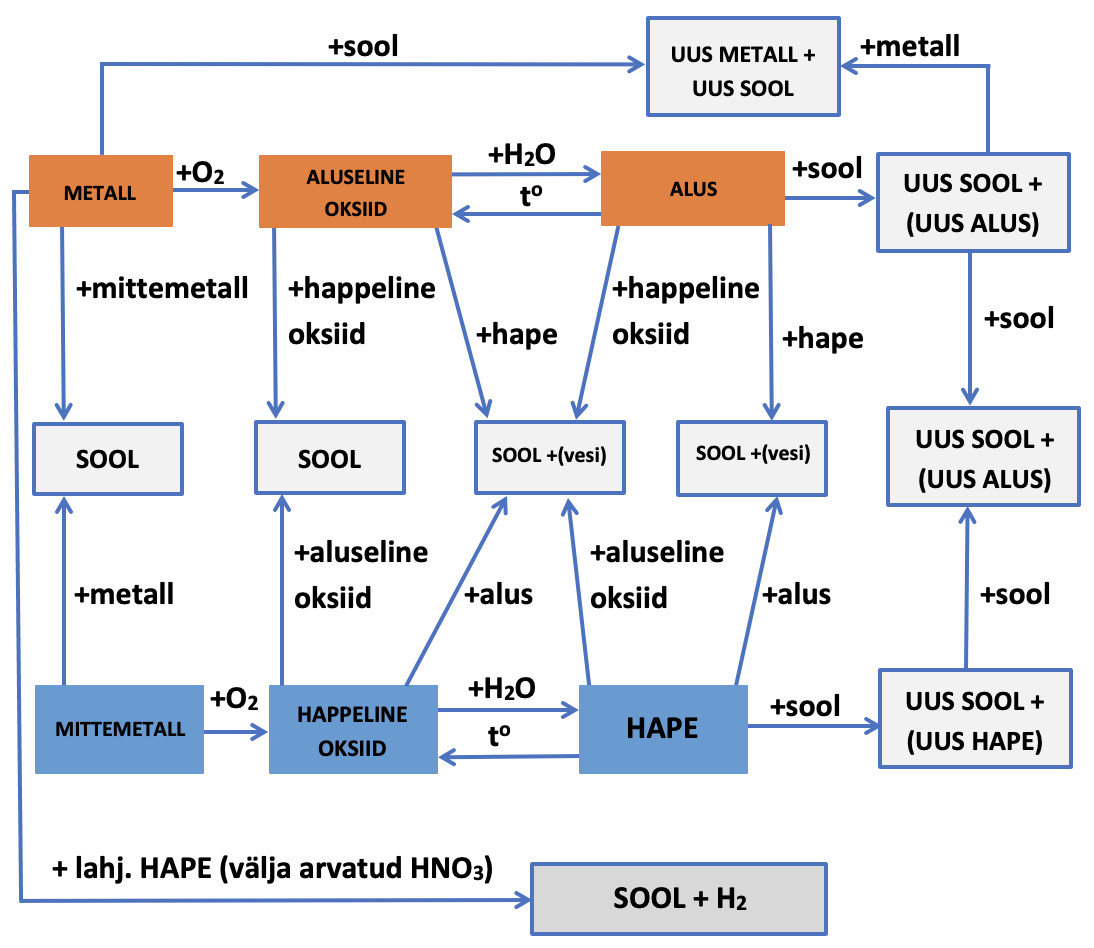
1.5. Seosed anorgaaniliste ainete põhiklasside vahel
Kuidas saada happest soola või aluselisest oksiidist alust? Anorgaaniliste ainete vahelisi seoseid saad vaadata järgmisest videost.
Allikas: https://youtu.be/vTmaYTCx-sk
Seoseid aineklasside vahel õppisid juba eelmistes osades. Toome need siin veelkord ära, nüüd kokkuvõtlikult tabelitena.
Tabel 1. Seosed aineklasside vahel
|
Reaktsioon |
Näited |
Selgitus |
|
LIHTAINE + HAPNIK → OKSIID |
C + O2 → CO2 2 Ca + O2 → 2 CaO |
Toimub peaaegu alati. Hapnikuga ei reageeri väärismetallid (Au, Pt), väärisgaasid. |
|
HAPPELINE OKSIID + VESI → HAPE |
CO2 + H2O → H2CO3 SO2 + H2O → H2SO3 |
Erandina ei reageeri veega SiO2. Happelise oksiidi ja happe koostises oleva mittemetallilise elemendi o.a ei muutu (nt CO2, H2CO3 – mõlemas aines on C o.a +4). |
|
ALUSELINE OKSIID + VESI → LEELIS |
CaO + H2O → Ca(OH)2 Na2O + H2O → 2 NaOH |
Veega reageerivad ainult tugevalt aluselised oksiidid. Tugevalt aluselised oksiidid on I A rühma metallide ja II A rühma metallide oksiidid, välja arvatud BeO ja MgO. Reaktsiooni tulemusel tekib tugev alus ehk leelis. |
|
ALUS + HAPE → SOOL + VESI |
NaOH + HCl → NaCl + H2O Ca(OH)2 + H2SO4 → CaSO4 + 2H2O |
Tegemist on neutralisatsioonireaktsiooniga. Väga nõrga aluse ja väga nõrga happe vahel reaktsiooni ei toimu. |
|
HAPPELINE OKSIID + ALUS → SOOL + VESI |
SO2 + Ca(OH)2 → CaSO3 + H2O CO2 + 2 NaOH → Na2CO3 + H2O |
Tekib happelisele oksiidile vastava happe sool. Happelise oksiidi ja happe koostises oleva mittemetallilise elemendi o.a ei muutu (nt CO2, H2CO3 – mõlemas aines on C o.a +4). Toimub alati. |
|
ALUSELINE OKSIID + HAPE → SOOL + VESI |
Li2O + H2SO4 → Li2SO4 + H2O CaO + 2 HCl → CaCl2 + H2O |
Tugevalt aluseliste oksiididega toimub reaktsioon energiliselt, nõrgalt aluseliste puhul võib olla vajalik kuumutamine. Toimub alati. |
|
ALUSELINE OKSIID + HAPPELINE OKSIID → SOOL |
BaO + CO2 → BaCO3 Na2O + SO2 → Na2SO3 |
Aktiivsemate oksiididega toimub reaktsioon kiiremini, vähem aktiivsetega on vajalik kuumutamine. Tekib happelisele oksiidile vastava happe sool. Toimub alati. |
| METALL + HAPE → SOOL + VESINIK |
Ca + H2SO4 → CaSO4 + H2↑ 2 Na + 2 HCl → 2 NaCl + H2↑ |
Lahjendatud hapetega reageerivad vaid vesinikust aktiivsemad metallid (paiknevad metallide elektrokeemilise aktiivsuse reas vesinikust vasakul). |
| METALL + VESI → ALUS + VESINIK |
Ca + 2 H2O → Ca(OH)2 + H2↑ 2 Na +2 H2O → 2 NaOH + H2↑ |
Reageerivad vaid aktiivsed metallid (Li-st kuni Mg-ni), tekib alus. |
| ALUS$\xrightarrow{temp.}$OKSIID + VESI |
Fe(OH)2 $\xrightarrow{temp.}$ FeO + H2O Cu(OH)2 $\xrightarrow{temp.}$ CuO + H2O |
Kuumutamisel lagunevad paremini vees lahustumatud hüdroksiidid. I A rühma hüdroksiidid ei lagune kuumutamisel. Mida väiksema aktiivsusega on metall, seda kergemini selle hüdroksiid kuumutamisel laguneb. |