4. Metallid
4.1. Aatomi ehitus ja elementide omadused
Milleks peaksime teadma aatomi ehitust?
Ained koosnevad erinevatest aatomitest, molekulidest või ioonidest. Aatomiehitus ja aatomitevahelised sidemed määravad aine omadused. Järgnevast videost saadki tuletada meelde aatomiehituse põhiteadmised ja aatomiehituse seosed perioodilisustabeliga.
Allikas: https://youtu.be/DTwdlVdi1pM
Tänapäevase aatomimudeli ehk kvantmehaanilise mudeli lõid austria teadlane E. Schrödinger ja saksa teadlane W. Heisenberg. Selle teooria kohaselt liiguvad elektronid kindlas ruumiosas, moodustades tuuma ümber elektronpilve. Jooniselt 1 näed heeliumi aatomit: kõige tumedamad alad tähistavad piirkonda, kus elektroni leidumise tõenäolisus on kõige suurem.
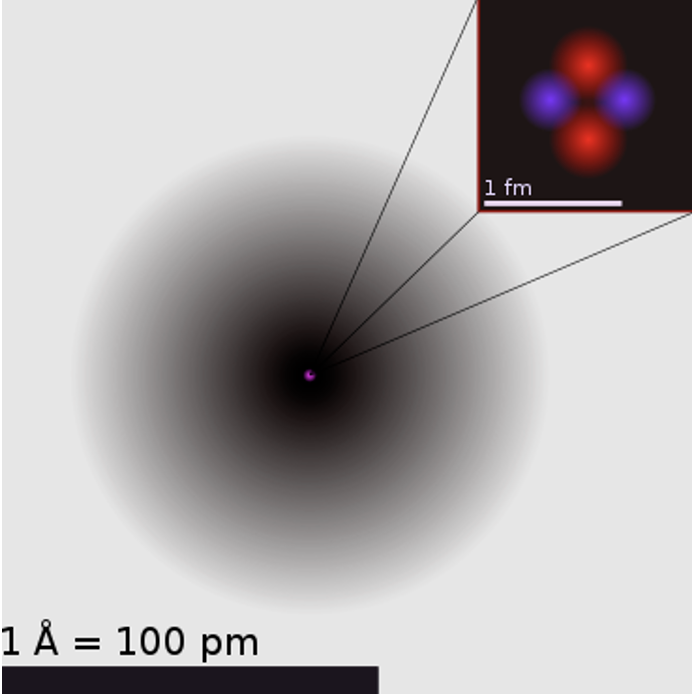
Joonis 1. Heeliumi aatomi kvantmehaaniline kujutus, välja on suurendatud heeliumi tuum, kus on näha kahte neutronit ja kahte prootonit. Allikas: https://upload.wikimedia.org/wikipedia/commons/9/97/Helium_atom.png
Ala, kus elektroni leidumise tõenäosus on kõige suurem, on orbitaal. Joonisel 2 on toodud orbitaalide erinevad kujud ja nimed.
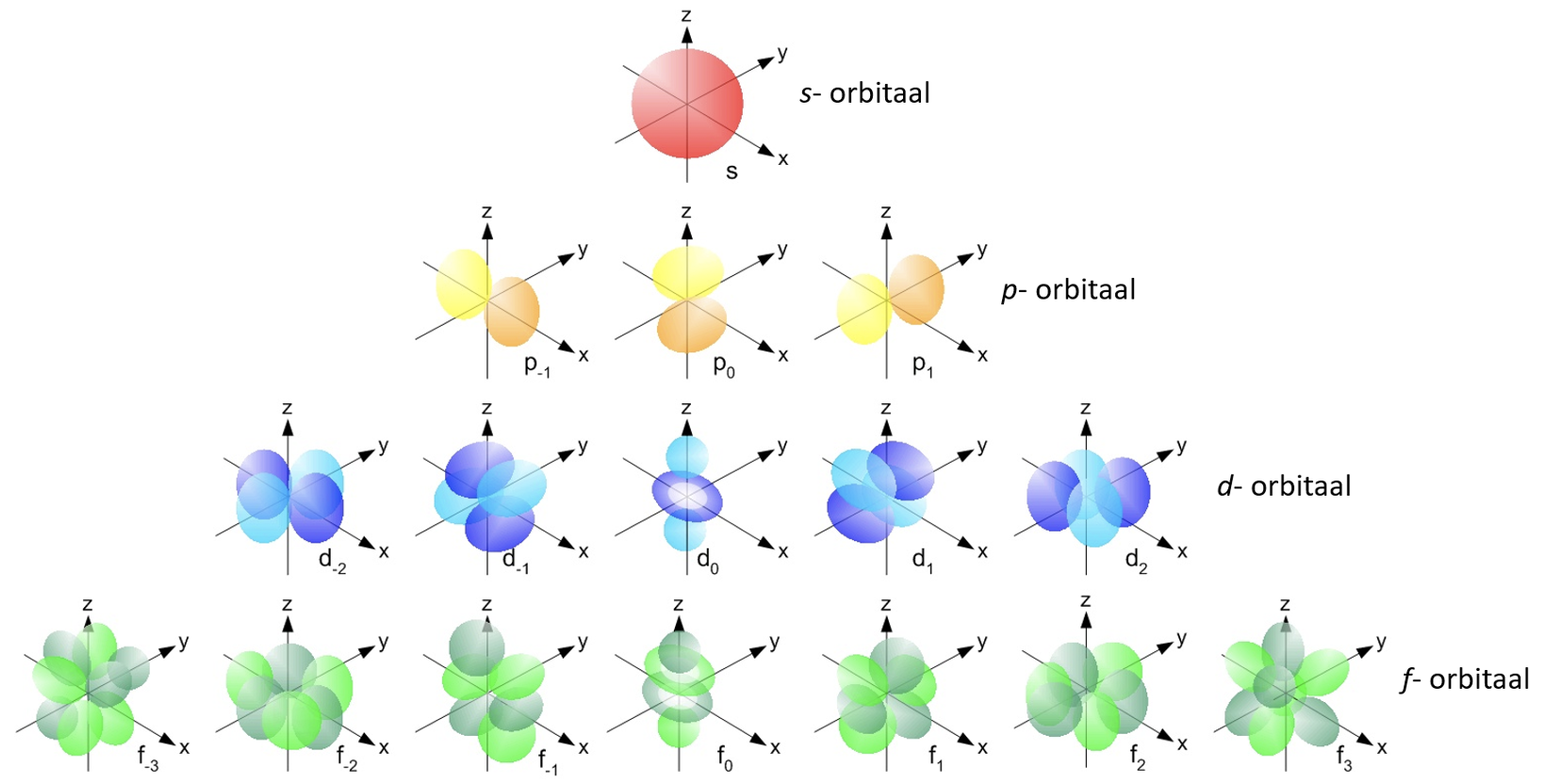
Joonis 2. Erinevate orbitaalide nimed ja kujud. Allikas: https://energywavetheory.com/atoms/orbital-shapes/
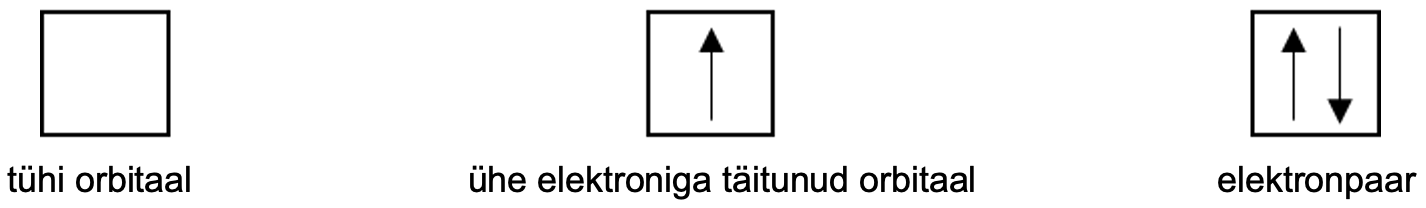
Orbitaalid paiknevad kindlatel energiatasemetel. Aatomi energiatasemete arvu näitab perioodi number. Ühele orbitaalile saab paigutada maksimaalselt kaks elektroni, mis peavad olema vastasspinnidega. Kui orbitaal on täitunud kahe elektroniga, siis moodustab see elektronpaari. Orbitaale ja nende täitumist märgitakse ruutskeemi abil, kus kastike tähistab orbitaali ja nool üles ning nool alla tähistab vastassuunalise spinniga elektrone.
Esimesel energiatasemel on sfääriline 1s-orbitaal (1 tähistabki esimest energiataset). Teises kihis on juba kaks alakihti: 2s ja 2p (orbitaalide kujusid esimesel kahel energiatasemel saad vaadata videost 1). p-orbitaale on kokku kolm, mis asetsevad ruumis eri suundades (vaata joonist 2) ning p-orbitaalid saavad täituda kokku maksimaalselt 6 elektroniga.
Video 1. Erinevate orbitaalide kujud kahel esimesel energiatasemel. Allikas: https://www.youtube.com/watch?v=VfBcfYR1VQo
Vaatame, kuidas orbitaalid täituvad elektronidega. Teises perioodis on süsiniku aatom järjenumbriga 6, mis näitab tuumalaengut ja ka elektronide koguarvu aatomis. 1s-orbitaalil on 2 elektroni, seejärel 2s-orbitaalil 2 elektroni ja kolmel 2p-orbitaalil ka 2 elektroni. Iga kast skeemil tähistab ühte orbitaali ning täitub maksimaalselt kahe elektroniga. 2p orbitaalid täituvad ühtlaselt ning näed, et osa orbitaale jääb tühjaks. Viimase kihi elektronid saavad osaleda keemiliste sidemete moodustamises. Näed, et süsiniku aatom saab liita maksimaalselt neli elektroni. Samas võib süsinik keemilise sideme moodustamisel ka kõik viimase kihi elektronid loovutada. Joonisel 3 on toodud elektronide täitumise järjekord. Pane tähele, et joonisel on orbitaalid kindlal energiatasemel, esimese kihi orbitaal on madalama energiaga ning teise kihi orbitaal on juba mõnevõrra suurema energiaga.

Joonis 3. Süsiniku aatomi ruutskeem ja orbitaalide täitumine elektronidega
Kolmandas elektronkihis on juba kolm alakihti ja kolme erinevat tüüpi orbitaale: s, p ja d. d-alakihis on viis orbitaali, järelikult mahutab d-alakiht kokku 10 elektroni.
Niisiis, esimese kolme elektronkihi vahel jaotuvad elektronid järgnevalt:
- elektronkihis saab olla kuni 2 elektroni, mis asetsevad 1s-orbitaalil;
- elektronkihis saab olla kuni 8 elektroni, 2 elektroni 2s- ja 6 elektroni 2p-orbitaalidel;
- elektronkihis saab olla kuni 18 elektroni, 2 elektroni 3s-orbitaalil, 6 elektroni 3p- ja 10 elektroni 3d-orbitaalidel.
Elektronide paiknemist aatomi elektronkihtidel saab lihtsustatult väljendada elektronskeemi, täpsemalt aga elektronvalemi abil. Näiteks süsiniku korral on elektronskeem ja elektronvalem järgmised:
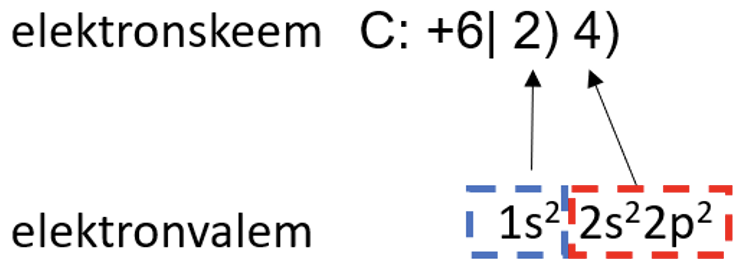
Elektronskeem näitab kõigepealt summaarset elektronide arvu ja seejärel elektronide jaotust elektronkihtides. Elektronvalemis näitavad suured numbrid elektronkihi numbrit, tähed tähistavad alamkihtide liike ning numbrid astendajates näitavad elektronide arvu alamkihtidel.
Elektronvalemi koostamisel on abiks joonisel 4 toodud skeem, mis näitab orbitaalide täitumise järjekorda.
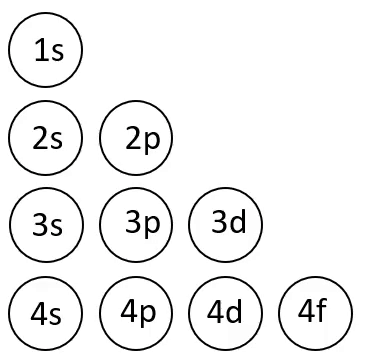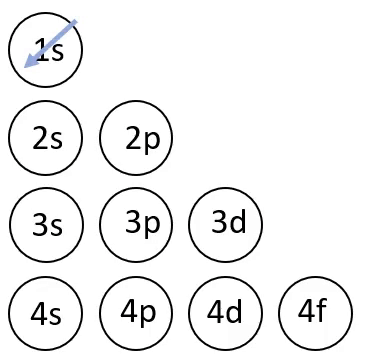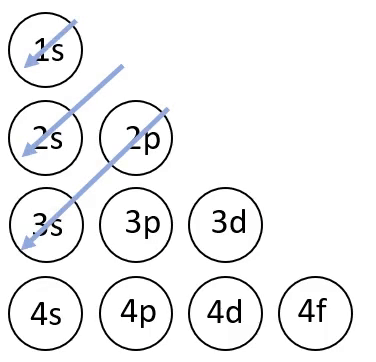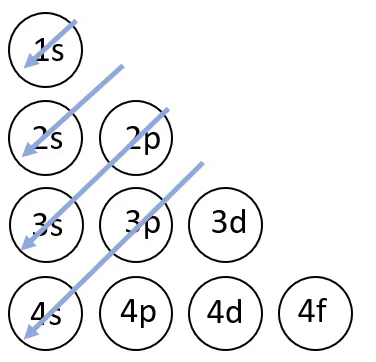
Joonis 4. Orbitaalide täitumise järjekord
Keemiliste elementide omadused
Perioodilisustabelis on elemendid reastatud tuumalaengu kasvu järjekorras. Elemendid asetsevad nii, et need peegeldavad ka aatomiehituse ning omaduste muutust perioodis ja rühmas. Teades elemendi asukohta perioodilisuse süsteemis, saame teha järeldusi tema omaduste kohta.
 Liht- ja liitainete, metalliliste ja mittemetalliliste elementide kohta vaata siit.
Liht- ja liitainete, metalliliste ja mittemetalliliste elementide kohta vaata siit.
Aatomraadius
Elektronkihtide arv suureneb rühmades ülalt alla ja seetõttu ka aatomraadius suureneb. Perioodis vasakult paremale aatomraadius väheneb, sest tuumalaeng suureneb ja tuuma mõju elektronkihitidele on suurem. Perioodilisuse süsteemis aatomraadius kasvab diagonaalselt ülevalt paremalt alla vasakule (joonis 5).
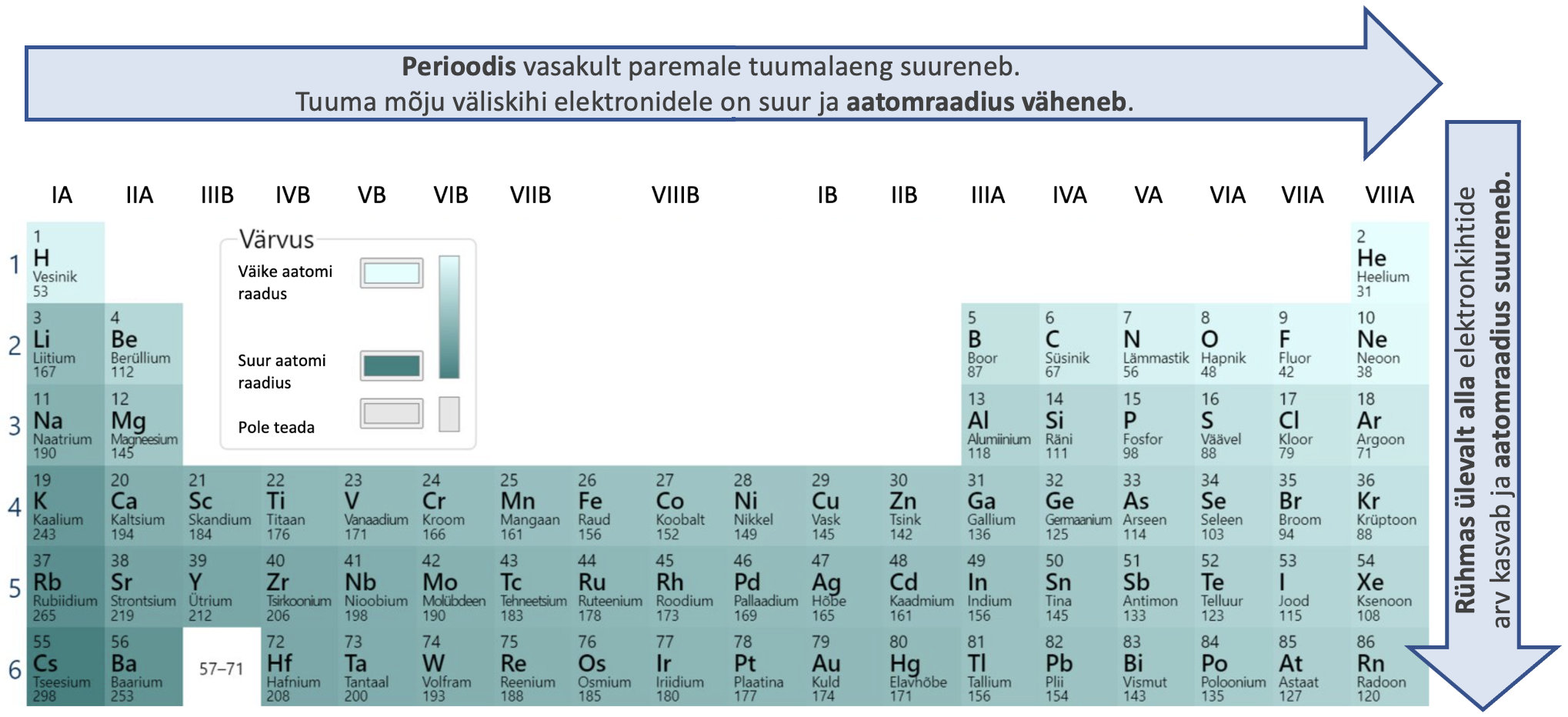 Joonis 5. Aatomraadiuse muutus perioodilisuse süsteemis
Joonis 5. Aatomraadiuse muutus perioodilisuse süsteemis
Metalliliste elementide omadused
Rühmas ülevalt alla metallilised omadused tugevnevad.
Metallilistel elementidel on väliskihtidel suhteliselt vähe elektrone. Aatomi tuum ei hoia elektrone eriti tugevalt kinni ja seetõttu loovutavad metallilised elemendid kergesti elektrone. Rühmas ülevalt alla elektronkihtide arv suureneb ja seetõttu tuuma mõju viimasele elektronkihile väheneb ning metall loovutab kergemini elektrone. Element on seda metallilisem, mida lihtsamalt see loovutab elektrone. Seetõttu rühmas ülevalt alla metallilised omadused tugevnevad. Tüüpilisteks näideteks on I A ja II A rühma metallid. I A rühma metallidel on viimasel s-orbitaalil ainult üks elektron, see loovutatakse kergesti ja tekib palju stabiilsem metallikatioon.
Na - e- → Na+
A-rühma elementide maksimaalne oküdatsiooniaste ühendis on võrdne rühma numbriga.
Elektronide loovutamisel käitub metalli aatom redutseerijana ja metalli oksüdatsiooniaste kasvab. Kui on loovutatud kõik väliskihi elektronid, siis on elemendil maksimaalne oksüdatsiooniaste. I A ja II A rühma metallid loovutavad kõik oma väliskihi elektronid. Seetõttu näitab I A ja II A rühma metallide rühmanumber nende maksimaalset oksüdatsiooniastet.
I A rühma metallide oksüdatsiooniaste on alati I, näiteks NaOH, LiCl, KBr ühendites:
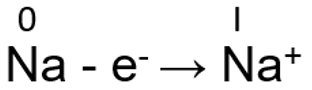
II A rühma elementide maksimaalne oksüdatsiooniaste on alati II, Mg(OH)2, BaCl2, CaO:
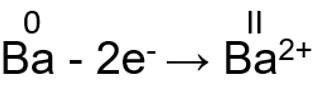 .
.
Teades elemendi oksüdatsiooniastet ühendis, saad kirjutada vastavaid oksiidide, hüdroksiidide ja soolade valemeid.
Mittemetalliliste elementide omadused
 Erinevaid trende perioodilisuse tabelis, elementide omadusi ning tüüpilisi valemeid saad vaadata väga põnevas animeeritud perioodilisuse tabelis.
Erinevaid trende perioodilisuse tabelis, elementide omadusi ning tüüpilisi valemeid saad vaadata väga põnevas animeeritud perioodilisuse tabelis.
Mittemetallilised elemendid paiknevad perioodilisuse tabelis paremal. Nende elementide aatomituuma mõju väliskihi elektronidele on tugev, mis tingib suhteliselt väikse aatomraadiuse. Kõige mittemetallilisem element on VII A rühma element fluor (F). Mittemetalli aatomid pigem liidavad elektrone, et täita osaliselt täitunud väline elektronkiht. Elektronide liitmisel mittemetall käitub oksüdeerijana ja sellest tekib mittemetalli anioon. Elektronide liitmisel oksüdatsiooniaste kahaneb:
Cl + e- → Cl-
S + 2e- → S2-.
Enamik mittemetallide aatomeid saavad ka elektrone loovutada, st käituvad ka redutseerijana.
Mittemetallide minimaalne oksüdatsiooniaste on
- (8 - rühma number).
Mittemetallide minimaalne oksüdatsiooniaste on võrdne väliskihi orbitaalide tühjade kohtade arvuga. Kokku mahub väliskihile 8 elektroni. Elemendi rühmanumber näitab elektronide arvu väliskihil, seega puuduolevate elektronide arvu saame leida 8 - elemendi rühmanumber. Seega on mittemetallide minimaalne oksüdatsiooniaste - (8 - rühma number). Minimaalne oksüdatsiooniaste on näiteks ühendites metallidega.
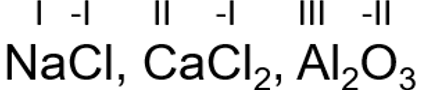 .
.
4.10. Keemilised vooluallikad
Kütuste kohte kohta saad ülevaate järgmisest videost.
Allikas: https://youtu.be/zE8UiwMe1o8
Kindlasti oled kuulnud erinevatest energiaallikatest. Tuulest saadakse tuulegeneraatorite abil tuuleenergiat, päikesest päikesepaneelide abil päikeseenergiat. Keemiline energia vabaneb keemiliste reaktsioonide käigus. Keemiliste vooluallikate abil saame elektrienergiat. Ühed tuntumad keemilised vooluallikad on akud. Igapäevaelus ei kujuta me enam elu ette ilma hea telefoniakuta. Akud on mõeldud pikaajaliseks kasutamiseks ning tühjenemisel saab neid uuesti laadida. Keemilist energiat saame ka patareidest. Patareid on tavaliselt mõeldud ühekordseks kasutamiseks.
Keemilise vooluallika tööpõhimõte
Üks lihtsamaid keemilisi vooluallikaid on vask-tsinkelement. Elemendi all mõeldakse siin tervet keemilist vooluallikat, mitte keemilist elementi. Element koosneb kahest erineva aktiivsusega metallist, katoodist ja anoodist. Katood ja anood on juhtmete abil ühendatud elektritarbijaga. Metallid on sukeldatud elektrolüüdi lahusesse. Anoodiruumis on tsinksulfaadi lahus ja katoodiruumis vask(II)sulfaadi lahus. Redoksreaktsioonis tõrjub aktiivsem metall tsink vase soolalahusest välja. Protsess on eksotermiline ja toimub isevooluliselt (joonis 1).
Anoodireaktsioon
Anood on metalliline tsink, tsink on redutseerija ja oksüdeerub:
 Zn - 2e- → Zn2+
Zn - 2e- → Zn2+
Selle tulemusena anood lahustub ja reaktsioon saab toimuda seni, kuni tsink on täielikult lahustunud. Metalliline tsink laadub negatiivselt, sest tsink loovutab elektronid.
Katoodireaktsioon
Katoodiks on metalliline vask. Vask on mitteaktiivne metall ning metalliline vask on üsna stabiilne. Seetõttu lahuses olevad vaseioonid liidavad elektrone ehk redutseeruvad ning vask sadeneb.
 Cu2+ + 2e- → Cu↓
Cu2+ + 2e- → Cu↓
Katood laadub positiivselt. Katoodil toimub vase redutseerimine.
Liidame poolreaktsioonid kokku ja saame summaarse reaktsioonivõrrandi ioonsel kujul:
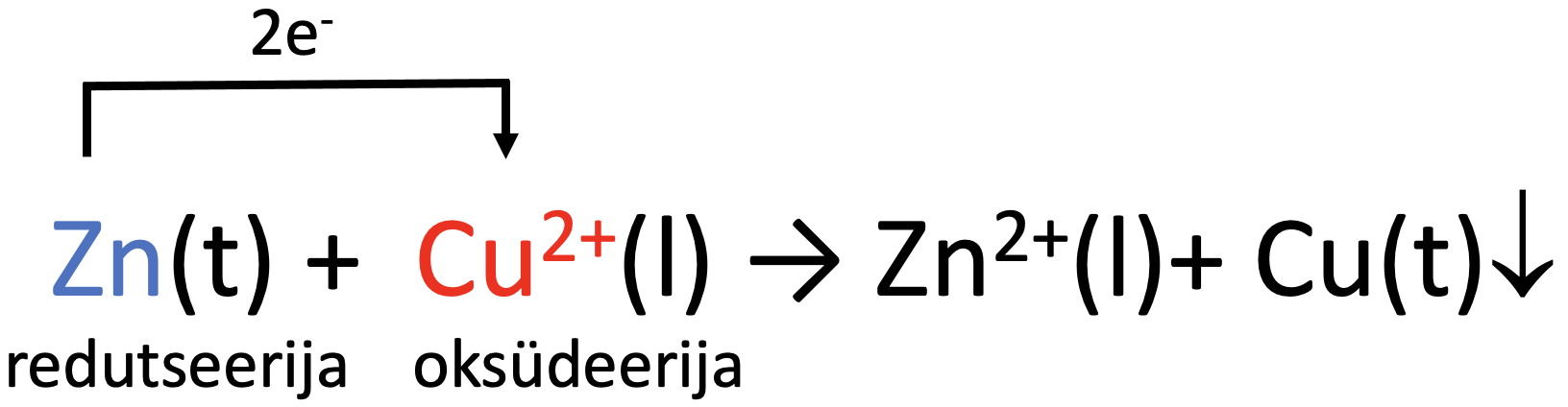
Molekulaarse reaktsioonivõrrandi saame siis, kui lisame juurde ka sulfaatioonid:
Zn + CuSO4 → ZnSO4 + Cu↓.
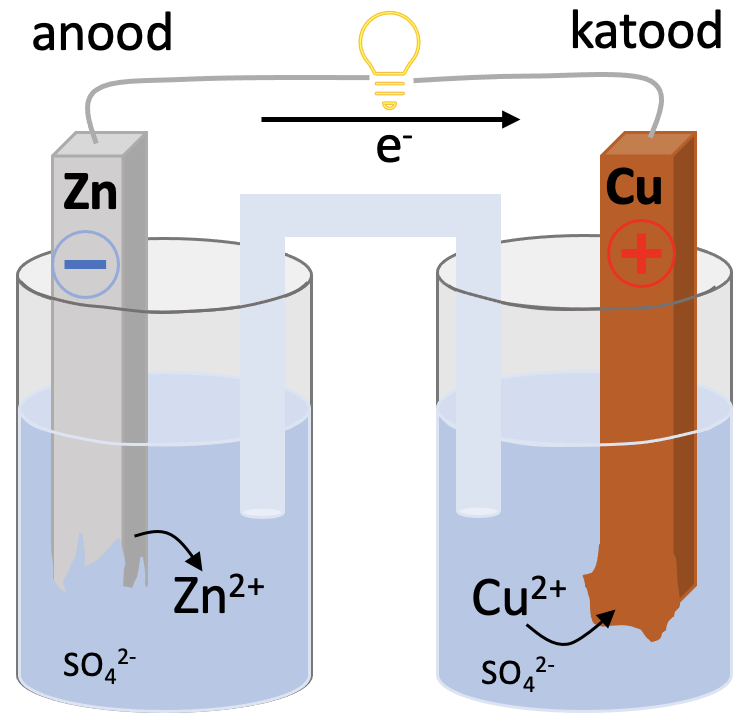
Joonis 1. Vask-tsinkelement
Ülesande 1 lahendused
1.10. Tsink-vask keemilises vooluallikas toimub keemiline reaktsioon Zn + CuSO4→ ZnSO4 + Cu↓.
Kui lahustub 1 g tsinki, mitu grammi vaske tekib? Anna vastus täpsusega kaks kohta pärast koma.
Vastus: 0,98 g
Lahendus: antud on tsingi mass 1 g. Saame selle moolide arvu leida, teades, et M(Zn) = 65 g/mol:
\(n(Zn) = {m \over M}= {1g \over 65g/mol}=0.015mol\)
Reaktsioonivõrrandist näeme, et tsingi ja vase moolsuhe on 1:1. Seega tekib 0,015 mol vaske. Teades, et M(Cu) = 63,5 g/mol, leiame selle massi:
m(Cu) = n × M = 0,015 mol × 63,5 g/mol = 0,9769 ≈ 0,98 g
1.11. Tsink-vask keemilises vooluallikas toimub keemiline reaktsioon Zn + CuSO4→ ZnSO4 + Cu↓.
Kui lahustub 1 g tsinki, mitu grammi vaske tekib, protsessi kadu on 10 %? Anna vastus täpsusega kaks kohta peale koma.
Vastus: 0,88 g
Lahendus: antud on tsingi mass 1 g. Saame selle moolide arvu leida, teades, et M(Zn) = 65 g/mol:
\(n(Zn) = {m \over M}= {1g \over 65g/mol}=0.015mol\)
Reaktsioonivõrrandist näeme, et tsingi ja vase moolsuhe on 1:1. Seega tekib 0,015 mol vaske. Teades, et M(Cu) = 63,5 g/mol, leiame selle massi:
m(Cu) = n × M = 0,015 mol × 63,5 g/mol = 0,9769 ≈ 0,98 g
Kuna aga kadu on 10%, tekib arvutatud massist 10% vähem ehk 90%. Seega on mass 0,98×0,9 = 0,88 g.
4.2. Redoksreaktsioonid
Meie ümber kulgeb väga palju keemilisi muundumisi, mida saame liigitada redoksreaktsioonide hulka. Redoksreaktsioonid on näiteks õuna lõikepinna tumenemine õhu käes, meie igapäevane nii märkamatu tegevus nagu hingamine, hõbeehete tuhmumine aja jooksul, küünla põlemine jne. Redoksreaktsioone selgitab siinolev video.
Allikas: https://youtu.be/OH5M-kREEJk
Redoksreaktsioon on reaktsioon, mille käigus muutub vähemalt kahe keemilise elemendi oksüdatsiooniaste, kuna toimub elektronide üleminek ühelt aineosakeselt teisele. Redoksreaktsioonis toimub paralleelselt kaks protsessi: oksüdeerumine ja redutseerumine. Oksüdeerumine on protsess, kus aineosake loovutab elektrone ning selle käigus elemendi oksüdatsiooniaste kasvab. Redutseerumine on vastandprotsess: aineosake liidab elektrone ning seetõttu elemendi oksüdatsiooniaste kahaneb. Osake, mis liidab elektrone, on oksüdeerija ning osake, mis loovutab elektrone, on redutseerija.
Lihtsam on neid uusi mõisteid meelde jätta ja nendega tegutseda, kui jätad meelde seose: redutseerija reedab elektrone (annab elektrone ära). Elektron on negatiivse laenguga ja kui aineosake annab ära negatiivset laengut, muutub ta ise positiivsemaks ehk selle keemilise elemendi oksüdatsiooniaste suureneb. Protsess, mis redutseerijaga toimub on oksüdeerumine. Seega oksüdeerumine on elektronide loovutamise protsess ja siit edasi saad oksüdeerija ja redutseerumise mõistete tähendused juba ise tuletada.
Kuidas teha kindlaks, kas tegemist on redoksreaktsiooniga?
Selleks tuleb analüüsida toimuva reaktsiooni võrrandit, leides selles kõikide elementide oksüdatsiooniastmed. Võtame näiteks neutralisatsioonireaktsiooni võrrandi, kus omavahel reageerivad naatriumhüdroksiid ja vesinikkloriidhape:
NaOH + HCl → NaCl + H2O
Määrame kõikide elementide o.a-d.
I -II I I -I I -I I -II
NaOH + HCl → NaCl + H2O
Näeme, et mitte ühegi elemendi o.a ei muutunud, järelikult see reaktsioon pole redoksreaktsioon.
Analüüsime magneesiumi põlemisreaktsiooni võrrandit:
0 0 II -II
2 Mg + O2 → 2 MgO
Selles võrrandis elementide o.a-d muutuvad ja tegemist on redoksreaktsiooniga. Määrame, mis on oksüdeerijaks ja redutseerijaks ning mis oksüdeerub ja mis redutseerub. Selleks on meil abi vastavatest mõistetest.
0 II
Mg$\xrightarrow[]{-2e^{-}}$Mg
Nagu näed, magneesiumi o.a suureneb, järelikult ta loovutab elektrone – sellest lähtuvalt on ta redutseerija ja ise oksüdeerub.
0 -II
O$\xrightarrow[]{+2e^{-}}$O
Siin näed, et hapniku o.a väheneb, seega ta liidab elektrone ja järelikult on oksüdeerija ning ise redutseerub. Jäta meelde, et metallide reageerimisel hapnikuga käituvad metallid redutseerijana ja hapnik oksüdeerijana.
Analüüsime järgmisena kaltsiumi reaktsiooni väävelhappega. Alustuseks määrame taas kõikide elementide o.a-d:
0 I VI -II II VI -II 0
Ca + H2SO4 → CaSO4 + H2↑
Nagu näed, muutuvad ka selles reaktsioonis kahe elemendi o.a-d:
0 II
Ca$\xrightarrow[]{-2e^{-}}$Ca
Kaltsiumi o.a suureneb – ta loovutab elektrone. Järelikult on ta redutseerija ja ise oksüdeerub.
I 0
H$\xrightarrow[]{+1e^{-}}$H
Vesiniku o.a väheneb, seega ta liidab elektrone. Sellest tulenevalt on ta oksüdeerija ja ise redutseerub. Redoksvõrrandi tasakaalustmisel jäta meelde, et oksüdeerumisel ja redutseerumisel üleminevate elektronide arv peab olema võrdne, seega peaks viimase võrrandi korrutama läbi kahega.
Taas saad meelde jätta, et metallide reaktsioonidel hapetega käitub metall redutseerijana ja oksüdeerijaks on vesinikioonid.
4.3. Mis on metall?
Metallilised elemendid moodustavad enam kui kolmveerandi keemilistest elementidest. Metalliliste elementide paigutust perioodilisussüsteemis kajastab hästi tabeli poolpikk variant elementidest: jooniselt 1 on näha, et metallid jäävad tabeli vasakusse poolde ning neid liigitatakse järgmiselt: s-metallid, p-metallid ning d-metallid (siirdemetallid). Ka elektronvalem, mis kirjeldab aatomi elektronstruktuuri ning näitab elektronide jaotumist kihtidesse, viitab otseselt sellele, millise metalliga on tegu: s-, p- või d-metalliga. Nt kui elektronvalem lõpeb s-tähega, siis on tegemist s-metalliga.
Metall on lihtaine, milles esineb metalliline side ja millel on seetõttu nn metallilised omadused (hea elektri- ja soojusjuhtivus, iseloomulik läige jne). Metalliaatomite väliselektronkihis on üldjuhul vähe elektrone. Need elektronid asuvad tuumast kaugemal, võrreldes mittemetallidega (vaata joonist 1), mistõttu need loovutatakse lihtsalt ühendite moodustamisel. Väliskihi elektronide loovutamine on seda lihtsam, mida kaugemal elektronid tuuma mõjusfäärist asuvad. Metallide tuumalaengu mõju pole neile kuigi tugev.
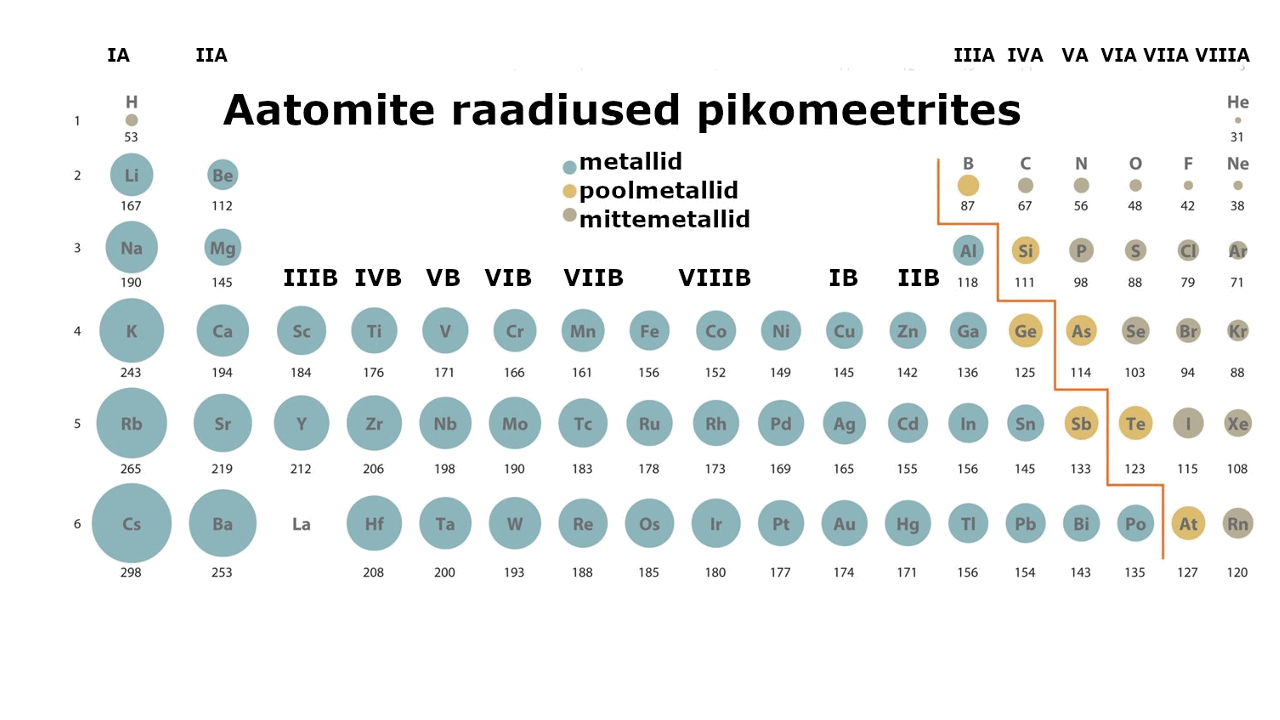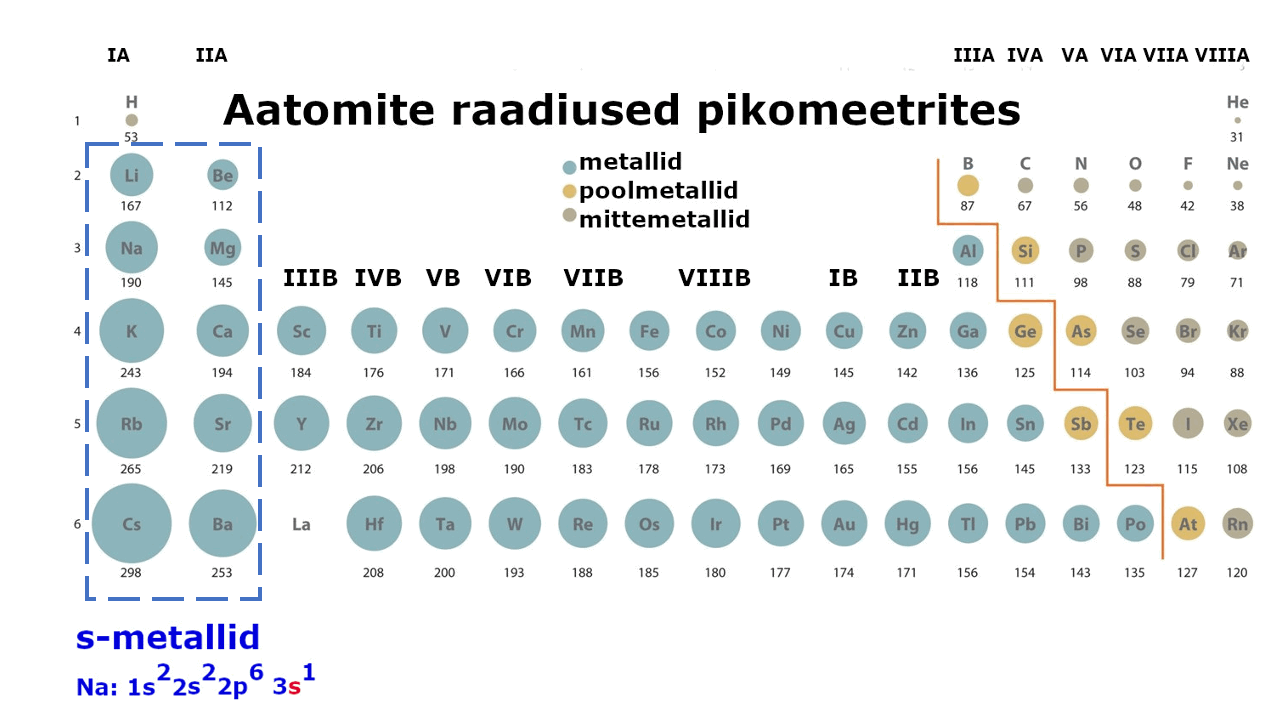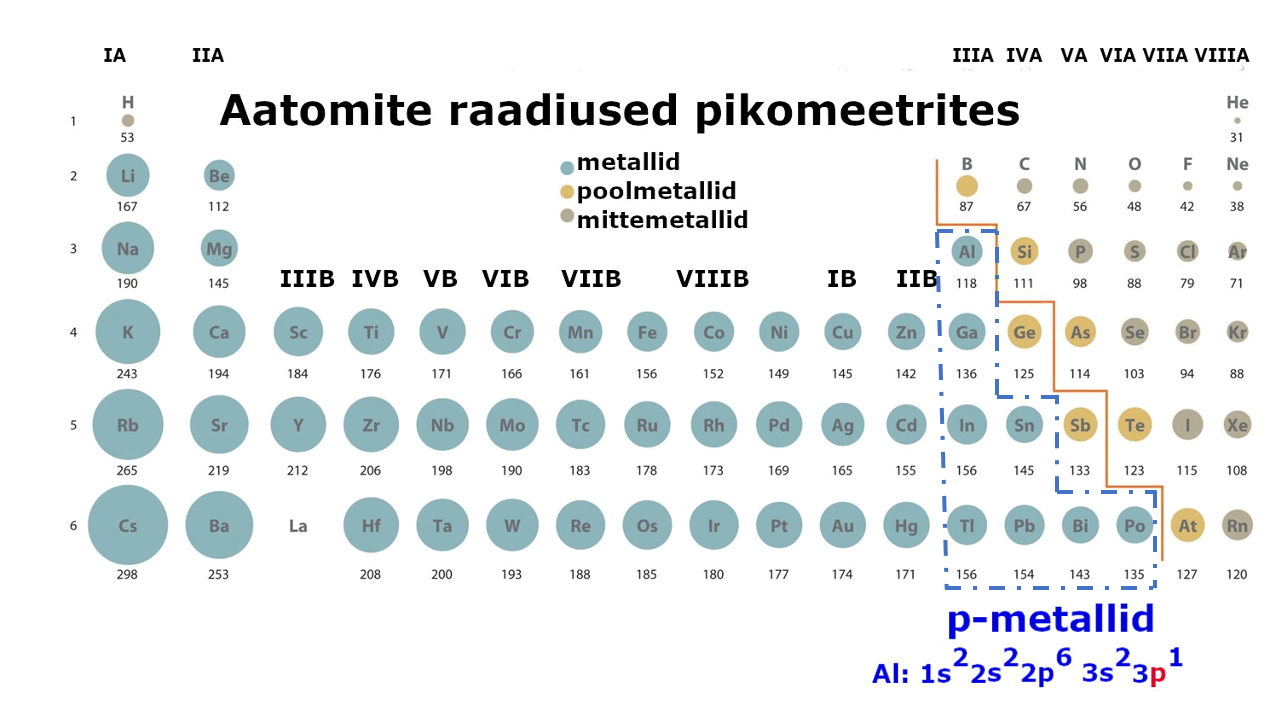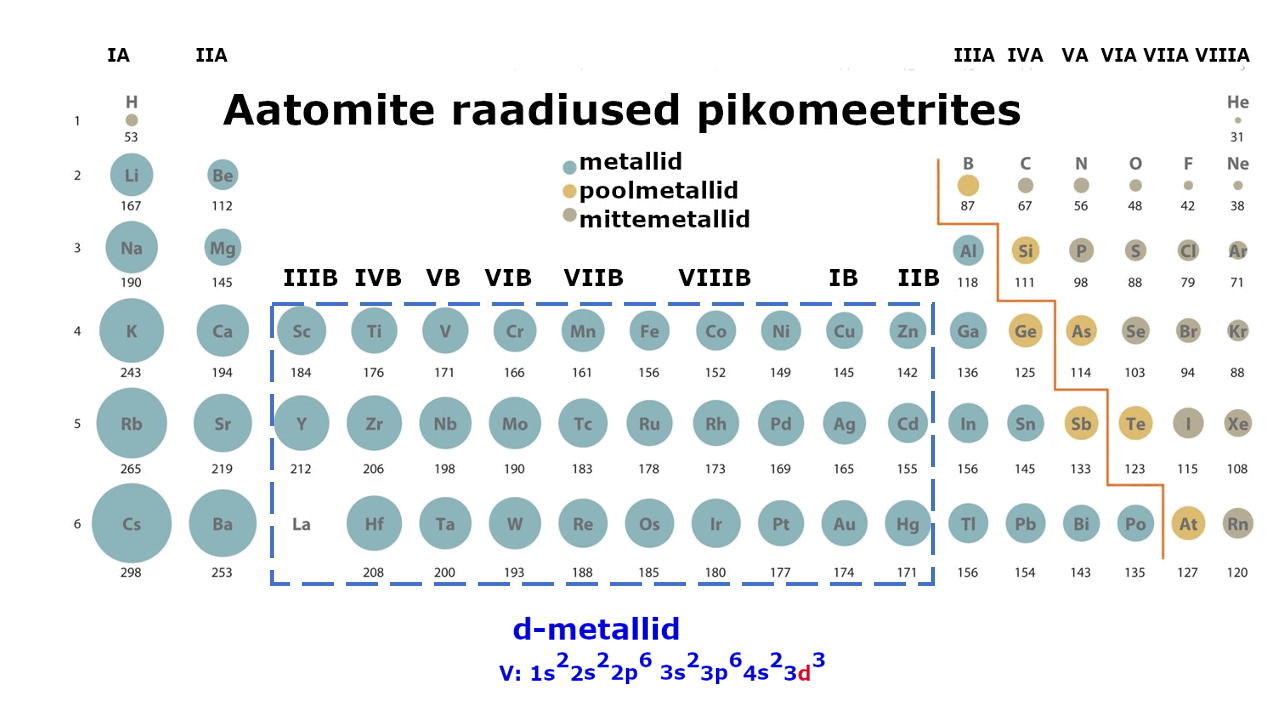
Joonis 1. Aatomite raadiuste muutus perioodilisustabelis ja s-, p-, d-metallid
Eriti lihtsalt loovutavad väliskihist elektrone I A rühma metallid ehk leelismetallid. Paljud reaktsioonid leelismetallide osavõtul toimuvad kergesti, võib isegi öelda, et tormiliselt. Näiteks reageerivad nad kergesti õhus oleva õhuhapnikuga (O2), kaotades silmnähtavalt metallidele omase läike (vaata videot Na pinna oksüdeerumise kohta).
Reaktsioonil veega leelismetallid (eriti Na, K, Rb, Cs) süttivad põlema.

Joonis 2. Kaaliumi lõikamisel näeme, et kaaliumi läikiv pind oksüdeerub kiiresti õhuhapnikuga ning tuhmub (pinnale tekib perroskiidide kiht, KO2). Teiseks on toodud kaaliumi reaktsioon veega, mille tulemusena tekib kaaliumhüdroksiid. Näha on ka gaasilise aine, vesiniku eraldumist. Reaktsioonivõrrand 2 K + 2 H2O → 2 KOH + H2↑.
Metallide aktiivsus suureneb rühmas ülevalt alla ning perioodis paremalt vasakule. Kõige metallilisem element on tseesium (Cs).
Metalliline side
Metallilised omadused on seotud aatomite võimega loovutada väliskihi elektrone. Metalli kristallvõres asuvad aatomid üksteisele nii lähedal, et osaliselt kattuvad aatomite elektronorbitaalid, kus väliskihielektronid asuvad. Nõrgalt seotud väliskihi elektronid saavad väga kergesti liikuda ühe tuuma mõjualast teise tuuma mõjualasse. See toimub üle kogu metallikristalli. Sel viisil tekib metallides eriline side, mida nimetatakse metalliliseks sidemeks. Väga lihtsustatud mudel metallilise sideme kirjeldamiseks pakuti välja 20. sajandi algul ning see kandis nime "elektrongaasi mudel". Selle mudeli kohaselt asuvad metalli kristallvõre sõlmpunktides üksteise kõrval metalli katioonid. Katioone hoiavad koos nende vahel kiiresti liikuvad elektronid, mis takistavad katioonide tõukumist. Tänapäeva teadus on aga näidanud seda, et selline mudel pole päris korrektne. Näiteks ei selgita mudel metallide elektrijuhtivuse vähenemist temperatuuri tõstmisel – elektrongaasi mudeli teooriast järelduks vastupidine sõltuvus.
Metalli kristallivõre sõlmpunktides on metalli aatomid, mis saavad üksteisega väliskihi elektrone vahetada (vaata joonist 3). Puhtal kujul avaldub metalliline side vaid leelis- ja leelismuldmetallide korral, kus väliskihielektronid on ühistatud. Neile on iseloomulik väga suur plastilisus, pehmus (eriti leelismetallidel), madalad sulamis- ja keemistemperatuurid. Side nõrgeneb aatomiraadiuse kasvamisel (rühmas ülevalt alla), keemis- ja sulamistemperatuur vähenevad.

Joonis 3. Metalliline side
Metallidel on rida iseloomulikke ühiseid omadusi, mis tulenevad metallilisest sidemest:
- head soojus- ja elektrijuhid;
- tavatingimustel kristalsed ained (v.a Hg);
- plastilised, sepistatavad, metalse läikega, hea peegeldusvõimega.
Nende kohta saad lugeda järgnevatest peatükkidest.
4.4. Metallide füüsikalised omadused
Paljud metallide füüsikalised omadused on meile tuttavad argielu kogemustest. Kindlasti tead, et enamik metalle peegeldab hästi valgust. Peegeldus ja läige avalduvad eriti hästi poleeritud pinnal. Parima peegeldusvõimega on Ag, Al ja In, mistõttu neid kasutatakse peeglite valmistamisel. Metallide üldiste omaduste kohta saad vaadata järgnevast videost.
Allikas: https://youtu.be/Bei8q6d46RE
Metallid on head soojusjuhid.
Metallid on head soojusjuhid. Metalleseme kuumutamisel levib soojus kiiresti üle kogu eseme. Mainimata ei saa jätta metallide head elektrijuhtivust, mis võimaldab neid kasutada elektrijuhtmete valmistamsel ning erinevates kontaktides. Ag, Cu, Al, Au, Fe juhivad elektrit hästi, Pb ja Hg halvasti.
Metallide erijuhtivus
Erinevate metallide juhtivate omaduste võrdlemisel kasutatakse suurust erijuhtivus. Erijuhtivus iseloomustab aine või materjali võimet elektrit juhtida. Mida suurem on arvuliselt erijuhtivus, seda paremini materjal juhib elektrit.
Mõningate metallide erijuhtivusi näeb tabelist 1. Kõige parem elektrijuht on Ag, teisel kohal on vask. Head erijuhtivuse omadused on tingitud vabadest elektronidest aatomi välisel elektronkihil (joonis 1).
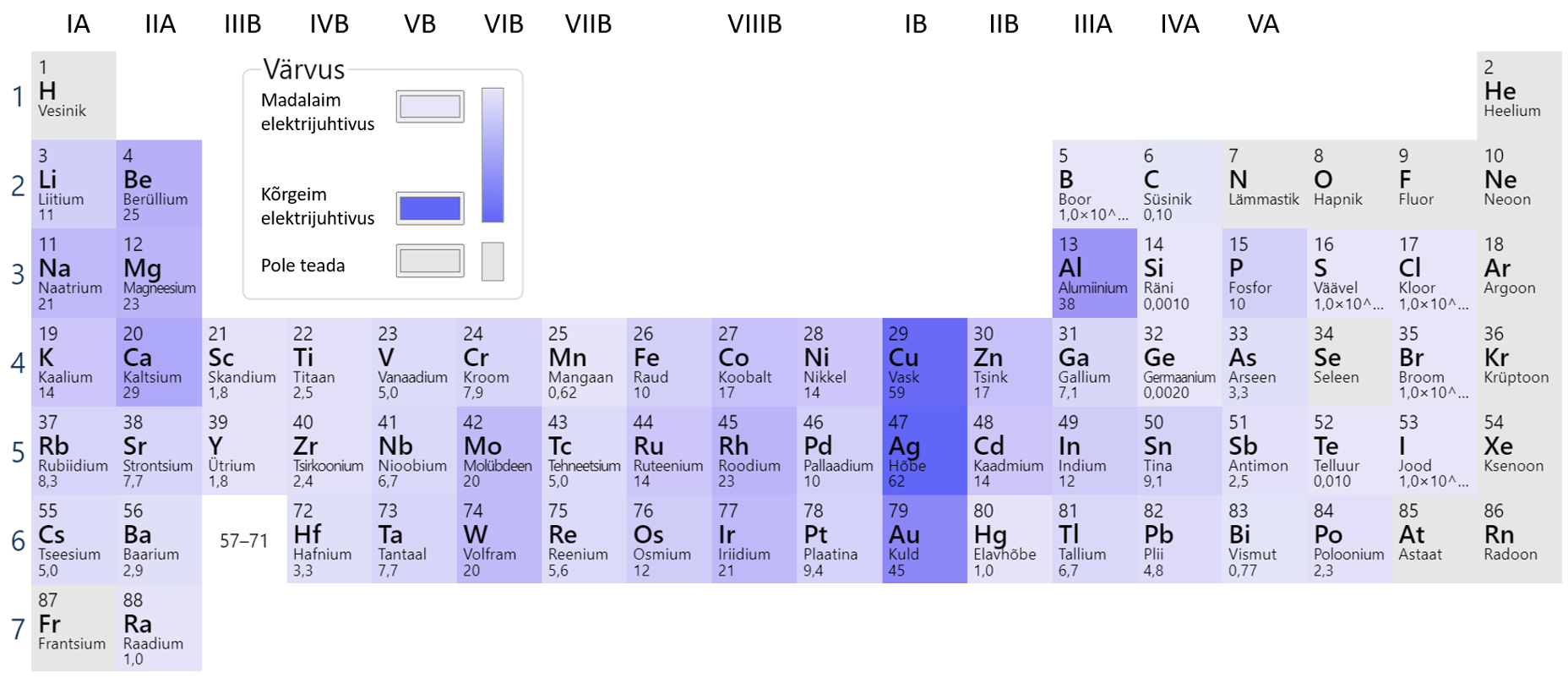
Joonis 1. Metallide elektrijuhtivuse võrdlus. Allikas: https://ptable.com/?lang=et#Properties/Conductivity/Electric
Ka leelismetallid on head elektrijuhid, kuna nende aatomite välisel elektronkihil on üks vaba elektron. Väga suure keemilise aktiivsuse tõttu pole aga leelismetallid praktiliseks kasutamiseks sobilikud.
Tabel 1. Metallide füüsikalised omadused
|
Metall |
Al |
Fe |
Cu |
Ag |
Au |
Sn (α-Sn) |
W |
|
Sulamistemperatuur (oC) |
660 |
1535 |
1083 |
962 |
1064 |
232 |
3380 |
|
Tihedus (g/cm3) |
2,70 |
7,87 |
8,960 |
10,5 |
19,32 |
5,77 |
19,30 |
|
Erijuhtivus (S/m) |
35,7 |
10,2 |
58.1 |
62,5 |
41,7 |
8,3 |
18,2 |
Metallide värvus
Kuigi metallidel on palju ühiseid omadusi, võivad nende füüsikalised omadused üsna tugevalt erineda. On metalle, mis mõne oma omaduse poolest teistest oluliselt erinevad. Tüüpilisi metallide värvusi näeb jooniselt 2. Enamik metalle on tüki või lehe kujul hõbevalged või halli värvi, aga kuld on kollane ja vask punakas. Pulbrina on metallid tuhmhallid või hoopiski mustad (joonist 3), kuna metalli pind oksüdeerub kiiresti õhuhapnikuga ja metalli pinnale tekib oksiidide kiht. Alumiiniumil ja magneesiumil säilib hõbedane läige ka pulbri kujul. Metallid erinevad üksteisest ka iseloomuliku helgi poolest. Näiteks Cr ja Pb helgivad sinakalt, Bi punakalt, Ni kollakalt, Zn sinakasvalgelt.

Joonis 2. Metallide värvused

Joonis 3. Pulbrilise ja tükilise metalli omaduste võrdlus
Kui enamik metalle on tavatingimustel tahked ained, siis termomeetrites kasutatav elavhõbe on erand – toatemperatuuril on Hg vedelik (vaata joonist 4).
Joonis 4. Elavhõbe (Hg)
Metallide kõvadus
Metallidel on väga erinev kõvadus. Leelismetallid ning osad leelismuldmetallid on noaga hästi lõigatavad. Rühmas allpool olevaid metalle on noaga lihtsam lõigata. Liitiumi on mõnevõrra raskem lõigata kui kaaliumi (vaata joonist 5).

Joonis 5. Lõikamisel tekkiv läikiv liitiumi pind oksüdeerub kiiresti õhuhapnikuga ning sama juhtub kaaliumiga. Liitiumi pinna tuhmumine on seotud Li2O tekkega pinnale, kaaliumi korral tekib pinnale peroksiidide kiht, KO2. Liitiumit on skalpelliga raskem lõigata kui kaaliumi.
Teiste metallide lõikamiseks tuleb kasutada spetsiaalseid vahendeid. Suhteliselt pehmed metallid on ka puhas kuld, plii ja tina, mida saab küünega kriimustada. Kõige kõvem metall on kroom, terava kroomitükiga on võimalik kriimustada klaasi. Metallide kõvadus sõltub puhtusest. Puhtad metallid on pehmemad, lisandid suurendavad metalli kõvadust. Erinevate metallide kõvaduse võrdlust näed joonisel 6.
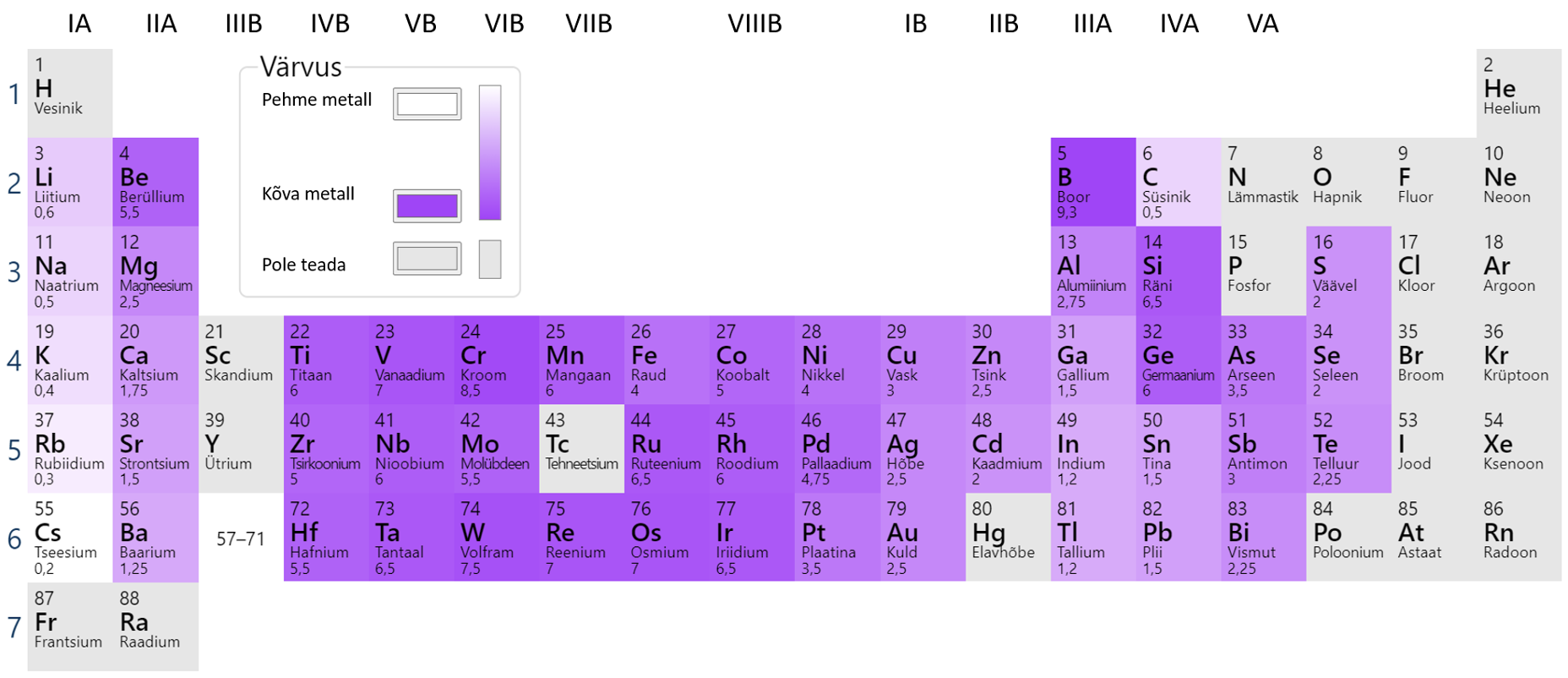
Joonis 6. Metallide kõvaduse võrdlus. Allikas: https://ptable.com/?lang=et#Properties/Hardness/Mohs
 Loe lisaks: Kuidas määrata metallide tugevust.
Loe lisaks: Kuidas määrata metallide tugevust.
Metallide kõvadust määratakse erinevate skaalade alusel, tuntum neist on Mohsi skaala (tabel 2). Skaala aluseks on 10 erinevat mineraali (ainet), millega metalli pindasid kriimustatakse. Selle skaala alusel on kõige tugevam aine teemant, süsiniku üks allotroopidest.
Tabel 2. Mohsi skaala
Metallide sulamistemperatuur
Sulamistemperatuur sõltub metallilise sideme osatähtsusest metallis. Metalliline side on üsna nõrk side. Metallilise sideme osakaal on kõige suurem leelis- ja leelismuldmetallidel, seetõttu on neil ka üsna madal sulamistemperatuur. Perioodilisuse süsteemis rühmas ülevalt alla sulamistemperatuur A rühma metallidel üldiselt kahaneb. See on tingitud sellest, et aatomiraadius suureneb ja metalliline side järjest nõrgeneb (joonis 7).

Joonis 7. Metallide sulamistemeratuuride võrdlus. Allikas: https://ptable.com/?lang=et#Properties/BoilingPoint
Mõnede metallide sulamistemperatuurid on toodud tabelis 1. Madalaima sulamistemperatuuriga on elavhõbe (Hg) ning kõrgeim sulamistemperatuur (3380 °C) on volframil (W). Volframil on aatomitevaheliste kovalentsete sidemete osatähtsus kõige suurem. Väga kõrge sulamistemperatuuriga on ka volframi lähedal asuv tantaal, niibium ja mitmed teised siirdemetallid. Sulamistemperatuuri alusel jaotatakse metallid kerg- ja rasksulavateks. Kergsulavad on metallid, mille sulamistemperatuur on alla 500 °C, ja rasksulavateks nimetatakse metalle, mille sulamistemperatuur ületab 1000 °C.
- Temperatuuril 100–300 °C sulavad: In, Li, Sn.
- Temperatuuril 300–500 °C sulavad: Cd, Pb, Zn.
- Rasksulavad: Cr, Mn, Ni, Fe, Mo, Ta.
- Väga raskesti sulavad: Os, Re, W.
Metallide tihedus
Metallide tihedus on tingitud eelkõige elemendi aatommassist, kristallvõre ehitusest ja vähesemal määral ka aatomiraadiusest. Metalli tihedus on seda väiksem, mida väiksem on selle aatommass ja suurem aatomiraadius. Perioodilisuse tabeli ridades ülevalt alla aatommass suureneb ja seetõttu ka tihedus suureneb. Eriti suure tihedusega on siirdemetallid (joonis 8).
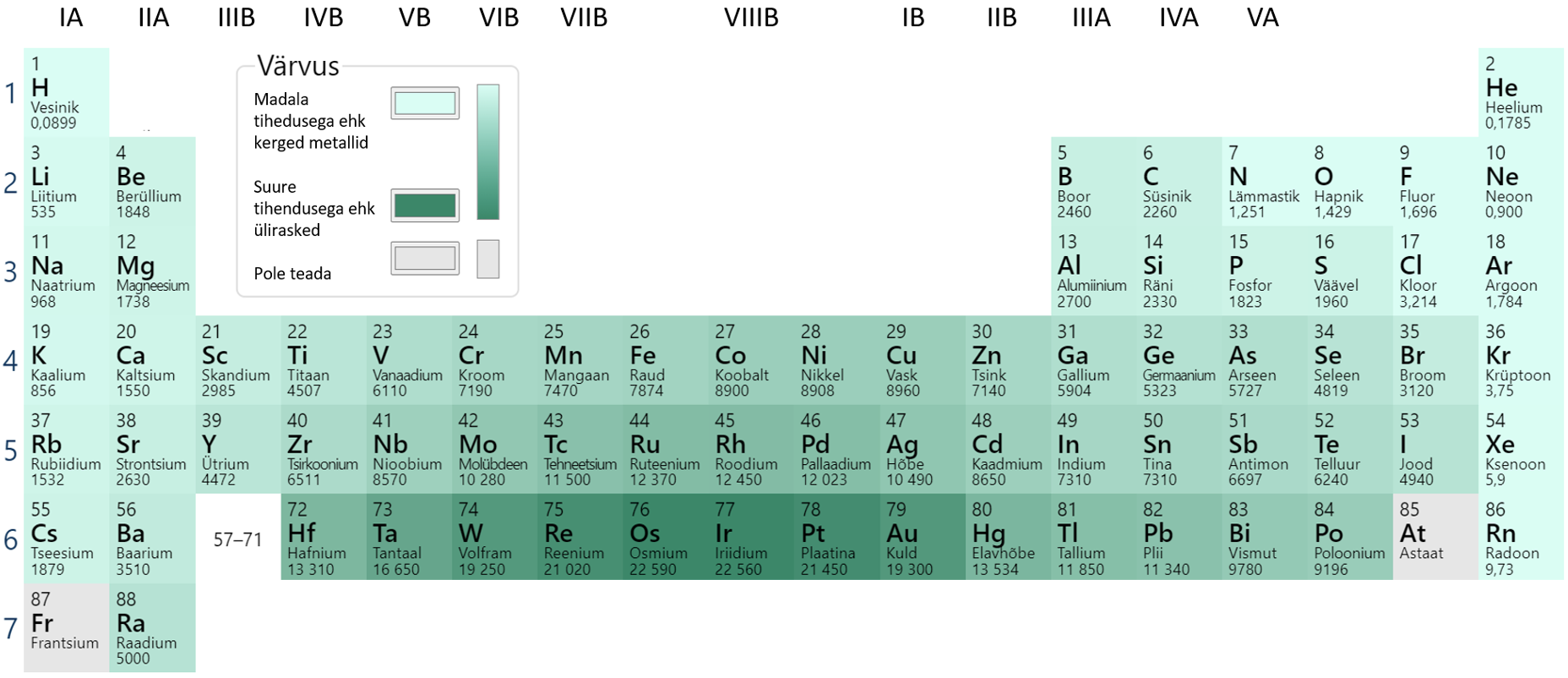
Joonis 8. Metallide tiheduste võrdlus. Allikas: https://ptable.com/?lang=et#Properties/Density/STP
Enamik metalle on veest raskemad, st nende tihedus on suurem kui 1 g/cm3. Eradiks on ainult osa leelismetalle (Na, Li, K). Kergeim metall on liitium. Liitium on isegi nii kerge, et ujub petrooleumi peal (vaata joonis 9).

Joonis 9. Liitium õlis. Allikas: https://en.wikipedia.org/wiki/Lithium#/media/File:Lithium_element.jpg
Tiheduse alusel jaotatakse metallid ja ka sulamid kergmetallideks (kergsulamid, tihedusega alla 5 g/cm3), raskmetallid (rasksulamid, tihedus vahemikus 5–10 g/cm3) ja ülirasketeks (tihedus üle 10 g/cm3). Enamik tuntud argielu metalle on raskmetallid ja nende tihedus on suurem kui 5 g/cm3. Suurima tihedusega on osmium (Os). Praktikas eelistatakse metalle, mis on kerged ehk väikse tihedusega, näiteks alumiinium ja magneesium.
Metallide ja metallisulamite üheks suurimaks eeliseks teiste materjalide ees on plastilisus. Hea plastilisuse annab suur metallilise sideme osakaal. Metallilise sideme osakaal suureneb perioodilisuse tabelis rühmas ülalt alla ja perioodis paremalt vasakule. See omadus teeb metallid ja nende sulamid hästi töödeldavaks, võimaldades neid venitada, valtsida ning sepistada. Kõige pehmemad metallid on leelismetallid, mida saab ka noaga lõigata. Leelismetallid erinevad teistest metallidest ka aktiivuse poolest. Õhuhapniku juuresolekul reageerivad kergesti, mistõttu neid hoitakse sellistes orgaanilistes lahustes, mis takistavad metalli korrosiooni. Leelismetallid ja leelismuldmetallid on tööstuses kasutamiseks liiga pehmed ja keemiliselt aktiivsed.
Füüsikaliste omaduste alusel metallide liigituse võtab kokku joonis 10.
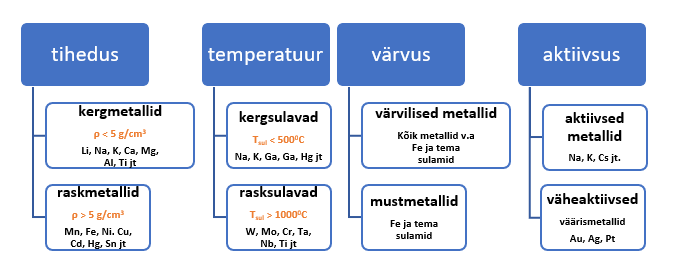
Joonis 10. Kokkuvõtlik skeem metallide füüsikaliste omaduste ja aktiivsuse järgi
4.5. Metallide leidumine looduses
Väga väheseid metalle (nt Au, Pt) leidub looduses ehedana. Enamik metallilistest elementidest esineb looduses ühenditena mitmesugustes maakides. Maak on mineraal või kivim, mis on mingi lihtaine või liitaine saamisel tooraineks. Maagid koosnevad enamasti mitmest ainest, sisaldades peale metalliühendi kõrvalaineid.
Põhilised mineraalitüübid on oksiidid, sulfiidid, kloriidid, karbonaadid ja sulfaadid. Aktiivsed metallid esinevad loodused tavaliselt sooladena ja neile on iseloomulikud ioonilise sidemega ühendid. Tuntuim neist on kivisool ehk haliit (joonis 1). Kuna sellised soolad on väga hästi lahustuvad, leidub neid suurel hulgal merevees.

Joonis 1. Kivisool ehk haliit, looduslik NaCl.
Leelismuldmetalle ja magneesiumi leidub kõige sagedamine vees raskesti lahustuvate karbonaatide või sulfaatidena (joonis 2).


Joonis 2. MgCO3 ja CaCO3
Paljud mitteaktiivsed metallid esinevad looduses oksiidide ja sulfiididena (joonis 3), aga ka hüdroksiididena ja hapnikhapete sooladena. Nendele ühenditele on väga iseloomulik ioonilis-kovalentne side, mis on oma omaduselt ioonilise ja kovalentse sideme vahepealne.
Joonis 3. Alumiiniumi põhimineraal boksiit (Al2O3 × nH2O) ja raua põhimineraal hematiit (Fe2O3)
Metallid (plii, tsink, nikkel, vask jt), mille ühendites on kovalentse sideme osakaal suur, leiduvad looduses sageli sulfiididena.


Joonis 4. Raua ja väävli põhimineraal püriit (FeS2) ja pliiläik (PbS)
Tabel 1. Mõned näited metallide tähtsamatest looduslikest ühenditest
|
Mineraali tüüp |
Ühendi valem |
|
Oksiidid |
Fe2O3, Fe3O4, Al2O3, SnO2 |
|
Sulfiidid |
PbS, ZnS, FeS2, Cu2S, HgS |
|
Kloriidid |
NaCl, KCl, CaCl2 |
|
Karbonaadid |
MgCO3, CaCO3 |
|
Sulfaadid |
CaSO4, BaSO4 |
|
Nitraadid |
KNO3, NaNO3 |
4.6. Metallide saamine
Metallide saamine maakidest
 Vaata lisandite arvestamise ülesandeid.
Vaata lisandite arvestamise ülesandeid.
Maagist metalli või mittemetalli saamiseks kõigepealt maak peenestatakse ja seejärel rikastatakse. Rikastamine on maagist kõrvaliste ainete eraldamine, kasutades ära maagis sisalduvate ainete füüsikaliste omaduste erinevusi (tihedust, magnetilisi omadusi). Looduslikult leiduvad maagid on keemiliselt väga püsivad, seetõttu peab kulutama metallide tootmisel väga palju energiat. Lihtainena on metallid palju ebapüsivamad kui maagis. Maagis esinevad metallid on positiivse oksüdatsiooniastmega, seetõttu tuleb lihtaine saamiseks ühendeid redutseerida.
 Vaata saagise ja kao ülesandeid.
Vaata saagise ja kao ülesandeid.
Redutseerijana kasutatakse mitmesuguseid aineid: süsinikku, süsinikmonooksiidi, vesinikku või aktiivsemaid metalle nagu Al, Mg, Na jne. Metallidega redutseerimisel saadakse nt kroomi ja mangaani siirdemetalle:
Cr2O3(t) + 2 Al(t) $\xrightarrow{temp}$ 2 Cr(t) + Al2O3(t)
3 Mn3O4 (t) + 8 Al (t) $\xrightarrow{temp}$ 9 Mn(t) + 4 Al2O3(t)
3 MnO2(t) + 4 Al (t) $\xrightarrow{temp}$ 3Mn(t) + 2 Al2O3(t)
Nende kolme reaktsiooni korral näed, et viiakse läbi redutseerumine alumiiniumiga, see on aluminotermia.
Väga paljudel juhtudel kasutatakse redutseerijana süsinikmonooksiidi või süsinikku:
Fe2O3(t) + 3 CO(g) $\xrightarrow{temp}$ 2 Fe(t) + 3 CO2(g)
PbO(t) + CO(g) $\xrightarrow{temp}$ Pb(t) + CO2(g)
ZnO(t) + C(t) $\xrightarrow{temp}$ Zn(t) + CO(g)
Vesinikuga redutseerimisel saadakse väga puhast metalli, vesinikku ei saa kasutada aktiivsete metallide tootmiseks.
Fe2O3(t) + 3 H2(g) $\xrightarrow{temp}$ 2 Fe(t) + 3 H2O(g)
CuO (t) + H2 (g) $\xrightarrow{temp}$ Cu(t) + H2O(g)
Rauda toodetakse rauamaagist särdamisel. Särdamine on kuumutamine õhuhapniku juuresolekul. Selle protsessi tulemusena tekivad oksiidid, metallioksiididest edasi saadakse vaba metall tugevate redutseerijate toimel. Näiteks on pürriit (FeS2) lähteaineks nii raua kui ka väävelhappe tootmisel. Püriidi särdamise teel saadakse raud(III)oksiid (Fe2O3) ja vääveldioksiid (SO2):
4 FeS2 (t) +11 O2 (g) → 2 Fe2O3(t) + 8 SO2(g)
- raua tootmine: 2 Fe2O3(t) + C(t) → Fe (t) + CO2(t)
- väävelhappe tootmine Pt-katalüsaatori juuresolekul:
2 SO2(g) + O2(g) ⇄ 2SO3(g)
SO3(g) + H2O(v) → H2SO4(l)
Metallide toomisel kasutatakse lähteineid, mis sisaldavad lisandeid. Seetõttu on protsessi käigus saadud aine hulk reaktsioonivõrrandi järgi arvutatust väiksem. Reaktsiooni saagis näitab, mitu protsenti moodustab tegelikult saadud reaktsioonisaaduse hulk (või mass) reaktsioonivõrrandi järgi teoreetiliselt arvutatud reaktsioonisaaduse hulgast (või massist). Saagist mõjutavad mitmed tegurid. Üks olulisemaid on kindlasti lisandite hulk maagis. Lisandite hulka saab vähendada maagi rikastamise teel, kuid see ei puhasta lähteaineid täielikult. Metallide tootmise käigus võivad tekkida kaod gaasiliste ainete lendumisel, sademete tekkimisel või ka lisanditest tingitud kõrvalreaktsioonide tõttu. Varasemates peatükkides õppisid, et keemilised reaktsioonid ei kulge sageli lõpuni ehk tekib tasakaaluolek. Ka seetõttu on reaktsiooni saagis arvutatud ainehulgast väiksem.
Ülesande 1 lahendused
1.1. Aluminotermia on metalli tootmine kasutades redutseerijana alumiiniumit. Raua tootmine toimub vastavalt reaktsioonivõrrandile:
Fe2O3 + 2Al → 2Fe + Al2O3.
Mitu kilogrammi alumiiniumit on vaja 5 kg raua tootmiseks? Anna vastus täpsusega üks koht peale koma.
Vastus: 2,4 kg
Lahendus: esmalt leiame raua moolide arvu (teades, et M(Fe) = 56 g/mol = 56 kg/kmol):
\(n(Fe) = {m \over M}= {5kg \over 56kg/kmol}=0.09kmol\)
Reaktsioonivõrrandist näeme, et raua ja alumiiniumi moolsuhe on 2:2=1:1. Seega peab ka alumiiniumi moolide arv olema 0,09 kmol. Teades, et M(Al) = 27 kg/kmol, leiame alumiiniumi massi:
m(Al) = n ×M= 0,09 kmol × 27 kg/kmol = 2,43 ≈ 2,4 kg
1.2. Hematiit sisaldab 3% lisandeid. Mitu kilogrammi hematiiti peab võtma, et saada 1000 kg rauda?
Hematiidi peamine koostisosa on Fe2O3. Raua tootmine toimub vastavalt reaktsioonivõrrandile: Fe2O3 + 2Al → 2Fe + Al2O3. Anna vastus täisarvuna.
Vastus: 1473 kg
Lahendus: esmalt leiame raua moolide arvu (teades, et M(Fe)=56 g/mol=56 kg/kmol):
\(n(Fe) = {m \over M}= {1000kg \over 56kg/kmol}=17.86kmol\)
Reaktsioonivõrrandist näeme, et raua ja Fe2O3 moolsuhe on 2:1. Seega on Fe2O3 moolide arv 17,86/2 = 8,93 kmol. Teades, et M(Fe2O3) = 160 g/mol = 160 kg/kmol, leiame selle massi:
m(Fe2O3) = n × M = 8,93 kmol × 160 kg/kmol = 1429 kg
Kuna lisandeid on 3%, on hematiidis puhast Fe2O3 järelikult 97%, mille massi oleme leidnud. 100%-le vastab seega hematiidi mass m = 1429/0,97 = 1473,19 ≈ 1473 kg.
1.3. Mitu grammi alumiiniumit on võimalik saada 350 g boksiidist, mis sisaldab 20% lisandeid?
Al2O3 + 3C → 2Al + 3CO
Anna vastus täisarvuna.
Vastus: 148 g
Lahendus: Boksiidis on lisandeid 20%, seega puhast Al2O3 on 80%. Selle mass on 350×0,8 = 280 g. Leiame Al2O3 moolide arvu (teades, et M(Al2O3)=102 g/mol):
\(n(Al_2O_3) = {m \over M}= {280g \over 102g/mol}=2.745mol\)
Reaktsioonivõrrandist näeme, et Al2O3 ja alumiiniumi moolsuhe on 1:2. Alumiiniumi moolide arv on seega 2×2,745=5,49 mol. Teades, et M(Al) = 27 g/mol, leiame alumiiniumi massi:
m(Al) = n × M = 5,49 mol × 27 g/mol = 148,3 ≈ 148 g
1.4. Pliimaagist (pliiläik PbS) saadi õhu keskkonnas pliioksiid, mis redutseeriti süsiniku abil pliiks:
2PbS + 3O2 → 2PbO + 2SO2
PbO + C → Pb + CO
Mitu grammi pliid saadakse ühest tonnist pliimaagist, kui protsessi saagis on 56%?
Vali õige vastus.
Vastus: 485000 g
Lahendus: antud on pliimaagi mass 1000 kg. Saame selle moolide arvu leida, teades, et M(PbS) = 239 g/mol = 239 kg/kmol:
\(n(PbS) = {m \over M}= {1000kg \over 239kg/kmol}=4.18kmol\)
Pliimaagi ja õhu vahelise reaktsiooni võrrandist näeme, et PbS ja PbO moolsuhe on 2:2=1:1. Seega on ka PbO moolide arv 4,18 kmol. Pliioksiidi ja süsiniku reaktsioonivõrrandist näeme, et PbO ja Pb moolsuhe on 1:1. Seega on ka Pb moolide arv 4,18 kmol. Teades, et M(Pb) = 207 g/mol = 207 kg/kmol, leiame selle massi:
m(Pb) = n × M = 4,18 kmol × 207 kg/kmol = 865,26 kg
Leitud väärtus on plii mass juhul, kui protsessi saagis on 100%. Tegelikult on protsessi saagis vaid 56%, seega tuleb leida 56% arvutatud teoreetilisest plii massist: 0,56×865,26 kg = 484,546 ≈ 485 kg ehk 485000 g.
PS! Saagist võib arvesse võtta ka enne plii massi arvutamist ja korrutada hoopis selle moolide arv 0,56-ga läbi. Siis on leitav mass juba vastav tegelikule plii massile.
Metallide saamine elektrolüüsil
Elektrolüüsi abil toodetakse aktiivsemaid ja vähem aktiivseid metalle.
Elektrolüüs on protsess, kus redoksreaktsioon toimub elektrivoolu toimel. Elektrolüüsil vaadaldakse redutseerumisprotsessi (e- liitmine) ja oksüdeerumisprotsessi (e- loovutamine) eraldi poolreaktsioonidena. Elektrienergia abil on võimalik viia läbi reaktsioone, mis iseeneslikult ei toimu. Elektrolüüsi abil toodetakse kõige aktiivsemaid metalle nagu naatrium, kaalium, magneesium.
Allikas: https://youtu.be/d_qZ0uuhQCY
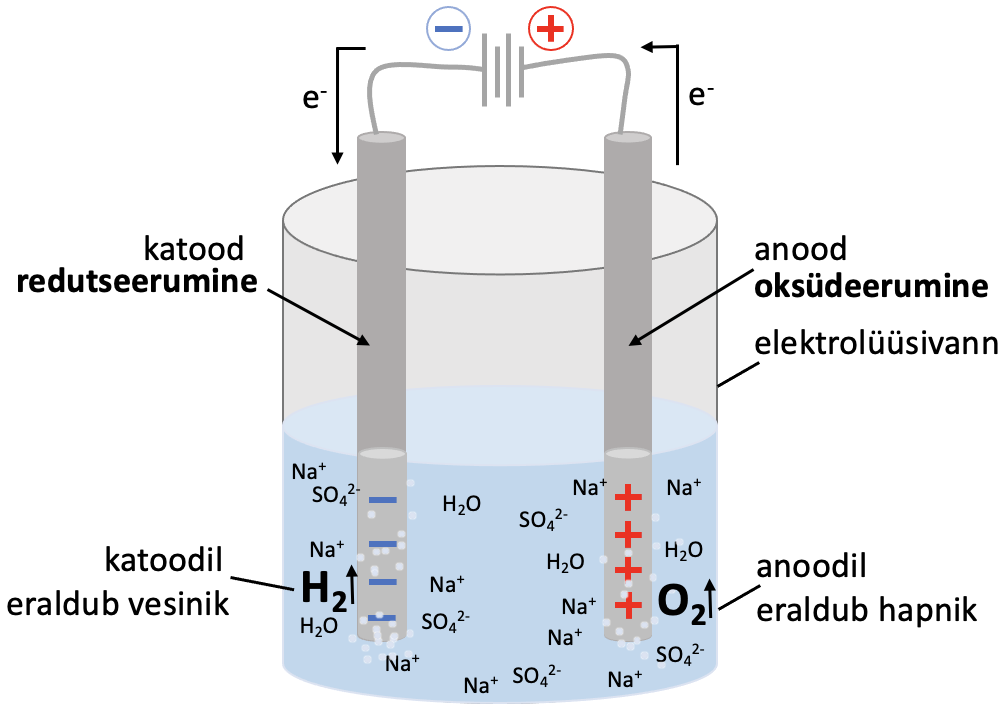
Elektrolüüs viiakse läbi elektrolüüsilahuse või sulatatud elektrolüüdiga täidetud elektrolüüsianumas (vaata joonist 1). Elektrolüüs toimub elektrolüüsivanni paigutatud elektroodidel.
Joonis 1. Elektrolüüsi protsessi põhiskeem
Katood. Alalisvoolu toimel varustatakse katoodi negatiivselt laetud elektronidega, seetõttu laadub katood negatiivselt. Katoodil saab toimuda seega elektronide liitmine ehk redutseerumine. Reaktsioon katoodil sula NaCl näite põhjal:
Na+ + e- → Na
Anood. Anoodilt tõmmatakse alalisvoolu toimel elektrone ära, seetõttu laadub anood positiivselt. Seega on anoodil elektronide puudujääk. Anoodil toimub elektronide loovutamine ehk oksüdeerumine. Reaktsioon anoodil sulatatud NaCl näite põhjal:
2 Cl- - 2 e- → Cl2
Elektroodil toimuvat reaktsiooni nimetatakse poolreaktsiooniks. Elektrolüüsiprotsessi summaarse reaktsiooni saame kahe poolreaktsiooni liitmisel:
 Na+ + e- → Na - reaktsioon katoodil |×2
Na+ + e- → Na - reaktsioon katoodil |×2 2 Cl- - 2 e- → Cl2 - reaktsioon anoodil
2 Cl- - 2 e- → Cl2 - reaktsioon anoodil
____________________________________________
2 Na+ + 2 Cl- $\xrightarrow{elektrolüüs}$ 2 Na + Cl2
Pane tähele, et siin on katoodi poolreaktsioon korrutatud kahega, sest oksüdeerumisel ja redutseerumisel peab elektronide arv olema võrdne.
Elektroodidel toimuvate poolreaktsioonide tõttu tekib elektrivool ja elektronid liiguvad anoodilt katoodile. Lahuses kannavad voolu ioonid: negatiivsed ioonid (anioonid) liiguvad anoodile ning positiivsed ioonid (katioonid) liiguvad katoodile.
Toome kaks näite elektrolüüsist.
Aktiivsete metallide saamine elektrolüüsil
Naatriumi saadakse sulatatud NaCl elektrolüüsil. Lisaks naatrumile saab selle protsessi tulemusena kloori. Lähteaineks on NaCl. Sulatamisel laguneb NaCl kergesti liikuvateks Na+ ja Cl- ioonideks. Elektrolüüsil toimuvad poolreaktsioonid ja summaarne reaktsioon on toodud eespool.
Väheaktiivsete metallide saamine elektrolüüsil
Väheaktiivseid metalle nagu Cu, Ag, Au, Sn, Pb (vaata ka alumist joonist) saab toota vastava soola vesilahuse elektrolüüsil.
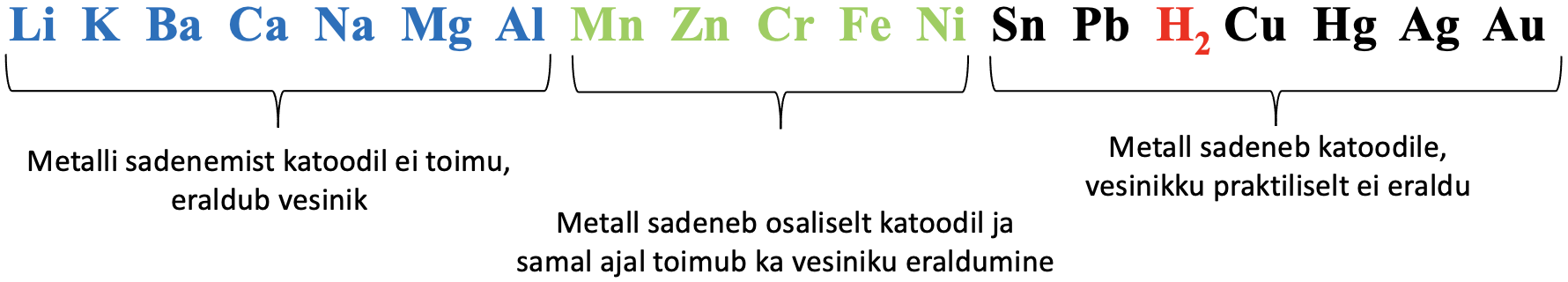
Tahke vask(II)sulfaadi lahuses on vask(II)ioonid ja sulfaatioonid:
CuSO4 → Cu2+ + SO2-4.
Voolu läbijuhtimisel lahusest liiguvad negatiivsed sulfaatioonid positiivsele elektroodile (anoodile) ja positiivsed Cu2+ - ioonid negatiivsele elektroodile (katoodile). SO42--ioonis on väävlil maksimaalne oksüdatsiooniaste – sulfaatioon ei saa oksüdeeruda, selle asemel hakkab anoodil lagunema vesi.
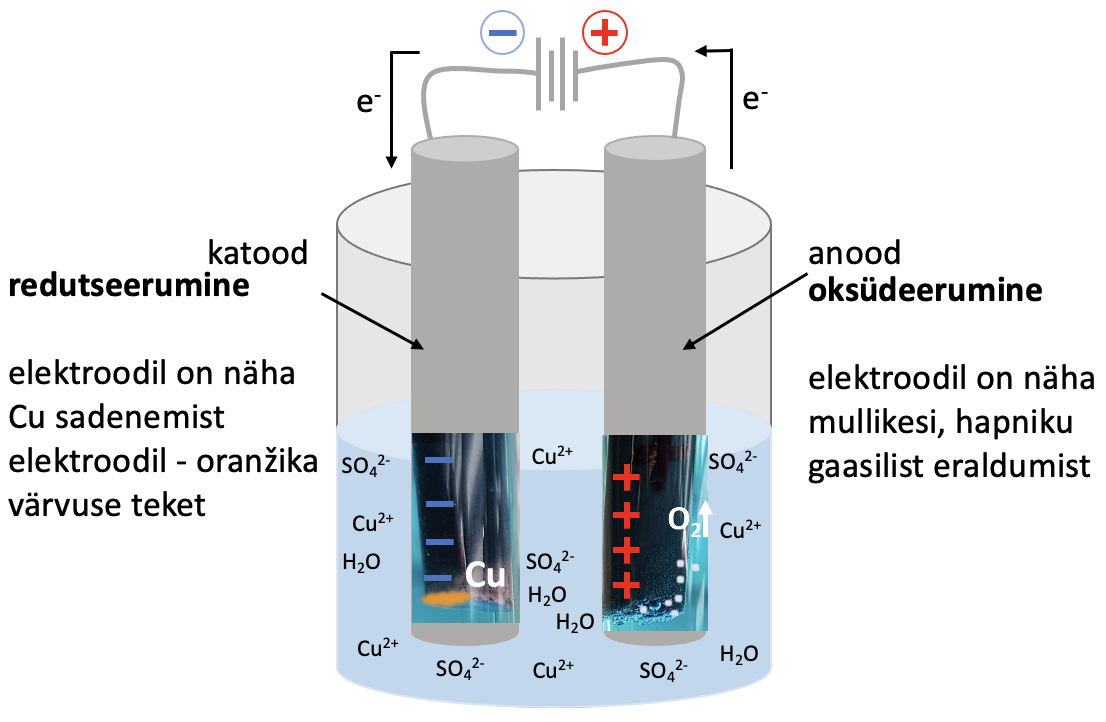
Joonis 2. Väheaktiivsete metallide saamine elektrolüüsil. Joonisel on vase saamine elektrolüüsil vask(II)sulfaadi vesilahusest
 Cu2+ + 2 e- → Cu |×2
Cu2+ + 2 e- → Cu |×2 2 H2O - 4 e- → О2 + 4 H+
2 H2O - 4 e- → О2 + 4 H+
____________________________________________
2 Cu2+ + 2H2O $\xrightarrow{elektrolüüs}$ 2 Cu + О2 + 4 H+ – saame summaarse võrrandi ioonsel kujul.
Molekulaarsel kujul reaktsiooni esitades tuleb arvestada ka sulfaatioone:
2 CuSO4 + 2 H2O $\xrightarrow{elektrolüüs}$ 2 Cu + О2 + 2 H2SO4
Ülesande 2 lahendused
2.14. Mitu grammi kaltsiumbromiidi peab võtma, selleks, et sulatatud soola elektrolüüsil tekiks 5 grammi kaltsiumit? Anna vastus täisarvuna.
Elektrolüüsi võrrand: CaBr2 → Ca + Br2
Vastus: 25 g
Lahendus: antud on kaltsiumi mass 5 g. Saame selle moolide arvu leida, teades, et M(Ca) = 40 g/mol:
\(n(Ca) = {m \over M}= {5g \over 40g/mol}=0.125mol\)
Reaktsioonivõrrandist näeme, et kaltsiumi ja CaBr2 moolsuhe on 1:1. Seega peab võtma 0,125 mol kaltsiumbromiidi. Teades, et M(CaBr2) = 200 g/mol, leiame selle massi:
m(CaBr2) = n × M = 0,125 mol × 200 g/mol = 25 g
2.15. Mitu grammi pliikloriidi peab võtma, selleks, et sulaelektrolüüsil tekiks 5 grammi pliid, kui elektrolüüsiks võetud sool sisaldas 10% lisandeid?
Sula elektrolüüsi võrrand PbCl2 → Pb + Cl2
Anna vastus üks koht peale koma.
Vastus: 7,4 g
Lahendus: antud on plii mass 5 g. Saame selle moolide arvu leida, teades, et M(Pb) = 207 g/mol:
\(n(Pb) = {m \over M}= {5g \over 207g/mol}=0.024mol\)
Reaktsioonivõrrandist näeme, et plii ja PbCl2 moolsuhe on 1:1. Seega peab võtma 0,024 mol pliikloriidi. Teades, et M(PbCl2) = 278 g/mol, leiame selle massi:
m(PbCl2) = n × M = 0,024 mol × 278 g/mol = 6,67 g
See on puhta PbCl2 mass. Elektrolüüsiks võetud sool sisaldas aga 10% lisandeid lisaks puhtale PbCl2-le, seega puhta PbCl2 mass on 90% soola koostisest. Seega tuleb soola võtta 6,67/0,9 = 7,41 ≈ 7,4 g.
4.7. Metallide sulamid
Metallid on meie igapäevaelus asendamatud materjalid. Neist valmistatakse väga palju erinevaid tarbeesemeid alates tööriistadest ja lauanõudest kuni autode, erinevate tööstusseadmete ja konstruktsioonimaterjalideni. Ülevaate levinumatest metallidest ning nende sulamitest ja kasutamisest igapäevaelus annab järgnev video.
Allikas: https://youtu.be/CGAeWeG2Kus
Sulameid saadakse peamiste koostiselementide kokkusulatamisel. Tihti toimub see koos metalli saamise protsessiga. Metallimaagis leiduvad lisandid redutseeruvad kaasa ja jäävad seetõttu metalli koostisesse. Selliselt saadud sulamitest puhta metalli saamine on juba väga keeruline ja kallis. Sulameid saab jaotada ebaühtlasteks ja ühtlasteks sulamiteks. Ebaühtlaste sulamite korral on sulamit moodustavate metallide aatomite erinevused väga suured, seetõttu ei moodustu ühtset kristallivõret. Sellised sulamid koosnevad koostismetallide mikrokristallidest, mis on omavahel tugevalt seotud. Ebaühtlased sulamid on näiteks tina, plii, antimoni ja vismuti sulamid. Näiteks jootetina on tina ja plii ebaühtlane sulam. Ühtlased sulamid on tahked lahused. Ühtlases sulamis moodustavad sarnaste mõõtmetega metalliaatomid ühise kristallivõre.
Sulamid võivad olla väga erinevate omadustega. Lisandite omadused ja nende hulk võib muuta sulami sulamistemperatuuri, kõvadust, tugevust või parandada korrosioonikindlust jt omadusi. Järgnevalt on ära toodud mõningate lisandite mõju sulami omadustele:
- Cr – suurendab korrosioonikindlust;
- Ni – parandab sitkust, korrosioonikindlust;
- Co – muudab magnetilisi omadusi;
- Mo – parandab kulumiskindlust, kõvadust;
- Mn – parandab elastsust, kuumuskindlust;
- Ti – parandab kuumuskindlust, tugevust;
- Al – vähendab tagi teket.
Raud ja tema sulamid
Raud on kahtlemata üks olulisematest ja enim kasutatavatest metallidest. Oma levikult maakoores on ta neljandal kohal hapniku, räni ja alumiiniumi järel (metallilistest elementidest teisel kohal). Looduses leidub rauda ehedal kujul äärmiselt vähe, eelkõige raudmeteoriitides, siiski on teda mitmete ühendite koostises, näiteks savides, looduslikus vees ja kivimites. Samuti leidub elemendilist rauda elusorganismide veres hemoglobiini koostises.
Raua füüsikalised omadused on järgmised:
- hõbehall läikiv metall;
- suhteliselt raske (ρ = 7,9 g/cm3);
- kõrge sulamistemperatuur (1540 oC);
- plastne (hästi töödeldav);
- suhteliselt kõva (Mohri skaalal 4,5);
- magnetiliste omadustega.
Rauda toodetakse rauamaakidest, millest tähtsamad on punane rauamaak ehk hematiit (Fe2O3) ning must rauamaak ehk magnetiit (Fe3O4).


Joonis 1. Punane rauamaak ehk hematiit (vasakul) ja must rauamaak ehk magnetiit (paremal)
Nimetus magnetiit tuleneb tema magnetilistest omadustest. Rauatoodang moodustab metallide kogutoodangust üle 90% ning kuna raud on küllaltki odav ja heade füüsikaliste omadustega metall, on sellel ka palju kasutusvaldkondi. Samas on täiesti puhas raud võrdlemisi pehme, mistõttu kasutatakse esemete valmistamisel tema sulameid: malmi ja terast. Sulam on materjal, mis koosneb mitmest metallist või metallist ja mittemetallist. Seega on sulam segu, mis tihti saadakse mitme erineva aine kokkusulatamisel.
Malm on raua ja süsiniku sulam, kus süsiniku sisaldus on 2...5%. Veel sisaldub malmis näiteks räni ja fosforit. Sulamalm on voolav, mistõttu saab teda kergesti näiteks vormi valada. Malm on võrreldes rauaga kõvem, kuid hapram materjal. Malmist valmistatakse näiteks radiaatoreid, malmpotte ja -panne ning pliidiraudasid ning kaminasüdamikke.


Joonis 2. Malm (vasakul) ja teras (paremal)
Teine raua sulam on teras, mis lisaks rauale sisaldab samuti süsinikku nagu malmgi. Kui malmis on süsiniku sisaldus 2...5%, siis terase süsinikusisaldus on väiksem – 0,002...2%. Tulenevalt väiksemast süsinikusisaldusest on teras paremini töödeldav. Rauda kasutatakse naelte, auto- või laevakerede, tööriistade, lauanõude, teraskonstruktsioonide jne valmistamisel. Nii malm kui ka teras on keemiliselt suhteliselt vähe vastupidavad. Näiteks õhus ja vees hävivad nad ümbritseva keskkonna toimel ehk roostetavad. Selle vältimiseks lisatakse terasele näiteks kroomi, saadakse roostevaba teras, mis on palju vastupidavam väliskeskkonna toimele.
Alumiinium ja tema sulamid
 Alumiinium on raua kõrval tähtsuselt teine ning looduses kõige levinum metall. Kuna alumiinium on küllaltki aktiivne metall, ei leidu teda looduses ehedalt.
Alumiinium on raua kõrval tähtsuselt teine ning looduses kõige levinum metall. Kuna alumiinium on küllaltki aktiivne metall, ei leidu teda looduses ehedalt.
Alumiiniumi füüsikalised omadused on järgmised:
- hõbevalge läikiv metall;
- suhteliselt kerge (ρ = 2,7 g/cm3);
- suhteliselt madal sulamistemperatuur (660 oC);
- hea elektri- ja soojusjuht;
- plastne (hästi töödeldav);
- üpris pehme (Mohri skaalal 2,5…3).
Tähtsaimaks alumiiniumimaagiks on boksiit, mis koosneb peamiselt alumiiniumoksiidist (Al2O3).
 Hoolimata sellest, et alumiinium on keemiliselt aktiivne ning reageerib kergesti õhus oleva hapnikuga, on alumiiniumist valmistatud esemed õhuhapniku suhtes vastupidavad, kuna nende pinnale moodustub hapnikuga reageerimisel tihe ja kaitsev oksiidikiht, mis hoiab ära esemete edasise kahjustumise.
Hoolimata sellest, et alumiinium on keemiliselt aktiivne ning reageerib kergesti õhus oleva hapnikuga, on alumiiniumist valmistatud esemed õhuhapniku suhtes vastupidavad, kuna nende pinnale moodustub hapnikuga reageerimisel tihe ja kaitsev oksiidikiht, mis hoiab ära esemete edasise kahjustumise.
4Al + 3O2 → 2Al2O3
Tänu sellele, et alumiinium on väikese tihedusega ning vastupidav õhu ja vee toimele, kasutatakse teda näiteks nõude ja joogipurkide valmistamisel. Lisaks on alumiiniumil hea peegeldusvõime, mistõttu kasutatakse teda peeglites peegeldava kihina. Alumiiniumi kõige tuntum sulam on duralumiinium, mis sisaldab lisandina umbes 4% vaske ning väikestes kogustes ka magneesiumi, mangaani ja räni. Duralumiinium on tugev, kuid väikese tihedusega materjal, mida kasutatakse näiteks lennukikerede valmistamisel, aga ka laevadetailide tootmisel.
Vask ja tema sulamid
 Vask on elementide levikult maakoores alles 26. kohal, kuid inimkond on kasutanud vaske juba antiikajast. Ehedalt leidub vaske looduses väga harva.
Vask on elementide levikult maakoores alles 26. kohal, kuid inimkond on kasutanud vaske juba antiikajast. Ehedalt leidub vaske looduses väga harva.
Vase füüsikalised omadused on järgmised:
- punakaspruuni värvusega;
- väga hea elektri- ja soojusjuht;
- suhteliselt raske (ρ = 7,9 g/cm3);
- plastne (kergesti töödeldav);
- kõrge sulamistemperatuur (1083 oC);
- suhteliselt pehme (Mohri skaalal 3).
Vaske toodetakse vasemaakidest, millest tähtsamad on vaskläik (Cu2S) ning kalkopüriit (CuFeS2). Tänu keemilisele püsivusele ning väga heale elektrijuhtivusele kasutatakse vaske laialdaselt elektrijuhtmetes ning elektroonikas.


Joonis 6. Vaskläik (vasakul) ja kalkopüriit (paremal)
Vasel on kaks tähtsat sulamit: pronks ja messing. Pronks on punaka või kollaka värvusega vase ning tina sulam. Pronksi saab hästi valada ning tegemist on vastupidava ja kõva materjaliga, mistõttu kasutatakse teda näiteks skulptuuride, monumentide, aga ka kirikukellade valmistamisel. Vase teine sulam on messing ehk valgevask. Messing on oma värvuselt helekollane sulam, mis lisaks vasele sisaldab kuni 40% tsinki. Messingit kasutatakse tema välimuse tõttu erinevate nipsasjakeste, aga ka uksenuppude ja toruliitmike valmistamiseks. Veel kasutatakse messingit puhkpillide valmistamisel. Lisaks sellele kasutatakse vasesulameid laialdaselt müntide tootmisel, kuna tegemist on hästi töödeldava, küllaltki odava ja keemiliselt stabiilse materjaliga.


Joonis 7. Pronks (vasakul) ja messing (paremal)
Tabel 1. Raua sulamite näited ja nende omadusi
|
Rauasulamid |
Omadused |
Sulami kasutusala |
|
Malm |
habras, raskesti töödeldav |
Igapäevaelus kohtad malmist tehtud köögitarvikuid, pliidiraudu, masinate korpuseid ja keresid. |
|
Teras |
hästi töödeldav, kõva, rauast rabedam |
Terasest tehakse paljud ehituskonstruktsioonid, mitmesugused tööriistad. |
|
Roostevaba teras |
vastupidavam korrosioonile |
Roostevaba terase kasutusala on väga sarnane terasega. Roostevaba terase korral on lisatud Cr, mis annab sulamile veel parema korrosioonikaitse. See ei tähenda seda, et roostevaba teras aja jooksul ei korrodeeruks. Sellest on tehtud paljud tööriistad, noad, käärid jm. |
Tabel 2. Vase sulami näited ja nende omadusi
|
Vasesulamid |
Omadused |
Sulami kasutusala |
|
Pronks |
vastupidav ja kõva materjal |
Skulptuurid, medalid, seadmed. Nt Kristjan Jaak Petersoni pronkskuju saad minna vaatama Tartu Toomemäele. |
|
Messing e valgevask |
tsingi lisand annab tugeva korrosioonikindluse, |
Kõige levinum rakendus on erinevad torustiku osad, veekraanid, masinaosad, vaskpillid. |
|
Melhior |
odavam alternatiiv hõbadase läikega materjali saamiseks, hästi töödeldav, väga hea korrosiooni- ja kuumuskindel |
Kasutatakse laialdaselt erinevate nipsasjakeste tootmisel: mündid, ehted, lauatarbed, kellaosad.
|
|
Uushõbe |
hästi töödeldav, keemiliselt vastupidav, odav |
4.8. Metallide keemilised omadused
Metallid on tüüpilised redutseerijad keemilistes reaktsioonides ning loovutavad alati redoksreaktsioonide käigus elektrone. Seda näed igapäevaelus sellest, et metalli pind tuhmub kergesti ehk korrodeerub. Metallide üldisemaid keemilisi omadusi saad vaadata järgmisest videost.
Allikas: https://youtu.be/xLBQO2PDpoM
Metallide redoksomadused
Metallidele on iseloomulik loovutada elektrone, kuna tuumalaengu mõju on nõrk tänu metalli aatomi suurtele mõõtmetele. Väliskihi elektrone ei hoita tugevalt kinni ning need loovutatakse kergesti. Metallid on keemilistes reaktsioonides seega tüüpilised redutseerijad. Redutseerijad on ained, milles aineosakesed loovutavad elektrone. Näiteks alumiiniumi reageerimisel joodiga tekib alumiiniumjodiid: 2Al + 3I2 → 2AlI3.

Joonis 1. Alumiiniumi reaktsioon joodiga katalüsaatori juuresolekul. Tekib alumiiniumjodiid: 2Al+3I\(_2\)→2All\(_3\) Jood sublimeerub, ehk muutub tahkest otse gaasiliseks ning on näha tekkinud lillakat joodiauru.
Reaktsioon on väga eksotermiline, st reaktsiooni käigus vabaneb palju energiat, mille tulemusena ka üks läheteaine, jood (I2), osaliselt sublimeerub. Sublimeerumine on aine üleminek tahkest olekust gaasilisse ilma vahepealse vedela oleku tekkimiseta. Jooniselt 1 on näha lillakad joodiaurud. Selle reaktsiooni käigus metalli aatomid loovutavad elektrone ning mittemetalli (I2) molekulid seovad elektrone.
Al - 3e- → Al3+ metall on redutseerija
I2 + 2e- → 2I- mittemetall on oksüdeerija
Elektroni loovutamisel tekib metalli katioon ja metalli oksüdatsiooniaste kasvab, elektroni liitmisel tekib mittemetallist anioon ja oksüdatsiooniaste kahaneb.
Metallide reaktsioonid mittemetallidega
Enamik metalle reageerib mittemetallidega kõrgemal temperatuuril. Reaktsiooni saab kiirendada ka sobiva katalüsaatori valimisel. Metallide reaktsioonid mittemetallidega leiad tabelist 1.
Tabel 1. Metallide reaktsioonid mittemetalidega
|
METALL |
+ HAPNIK |
→ OKSIID |
4 Fe + 3 O2 $\xrightarrow{temp}$ 2 Fe2O3 raud(III)oksiid 2 Cu + O2 $\xrightarrow{temp}$ 2 CuO vask(II)oksiid 4 Na + O2 $\xrightarrow{temp}$2 Na2O naatriumoksiid (2 Na + O2 $\xrightarrow{temp}$ Na2O2) naatriumperoksiid 2 Zn + O2 $\xrightarrow{temp}$ 2 ZnO tsinkoksiid 4 Al + 3O2 $\xrightarrow{temp}$ 2 Al2O3 alumiiniumoksiid |
|
+ VÄÄVEL |
→ SOOL |
2 Na + S $\xrightarrow{temp}$ Na2S naatriumsulfiid |
|
|
+ HALOGEEN CI2, F2, Br2 jne |
→ SOOL |
2 K + Cl2$\xrightarrow{temp}$ 2 KCl kaalimkloriid 2 Na + Br2 $\xrightarrow{temp}$ 2 NaBr naatriumbromiid Ca + F2 $\xrightarrow{temp}$ CaF2 kaltsiumfluoriid |
|
|
+ H2 VESINIK |
→ hüdriidid |
2 Na+ H2 $\xrightarrow{temp}$ 2 NaH naatriumhüdriid |
|
|
+ N2 LÄMMASTIK |
→ nitriidid |
3 Ca+ N2 $\xrightarrow{temp}$ Ca3N2 kaltsiumnitriid |
|
|
+ P FOSFOR |
→ fosfiidid |
3 Ca+ 2P $\xrightarrow{temp}$ Ca3P2 kaltsiumfosfiid 3 Mg + 2 P $\xrightarrow{temp}$ Mg3P2 magneesiumfosfiid |
|
|
+ C SÜSINIK |
→ karbiidid |
Ca+ 2 C $\xrightarrow{temp}$ CaC2 kaltsiumkarbiid |
Metallide reaktsioonid hapete lahjade vesilahustega
Metallide reaktsioonide kirjutamisel lahjendatud hapete lahustega kasuta metallide pingerida:

Metallide reageerimisel happe lahusega on oksüdeerijaks happe vesinikioonid
Metallid, mis asuvad metallide pingereas vesinikust vasakul, reageerivad lahjendatud hapete vesilahustega ning reaktsiooni tulemusena tekivad sool ja vesinik. Erandiks on lahjendatud lämmastikhappelahus, millest tuleb juttu hiljem.
METALL + HAPPE LAHJENDATUD LAHUS → SOOL + VESINIK
Zn(t) + 2 HCl(lahjendatud) → ZnCl2(l)+ H2(g)

Mg(t) + 2 HCl(lahj) → MgCl2(l) + H2(g)
Fe(t) + 2 HCl(lahj) → FeCl2(l) + H2(g)
2 Al(t) + 6 HCl(lahj) → 2 AlCl3(l) + 3 H2(g)
Eriti aktiivselt eraldub vesinikku magneesiumi reageerimisel. Järgneva nelja video põhjal saad näha, kui aktiivselt reageerib metall lahjendatud happelahusega. Aktiivsema metalli (Mg) reaktsioonil happelahusega eralduvad intensiivselt vesinikumullid. Kõige aeglasemalt toimub raua (Fe) reatsioon happelahusega.
|

|
|
Magneesiumi reageerimine soolhappe lahusega:
|
Alumiiniumi reageerimine soolhappe lahusega:
|
|

|
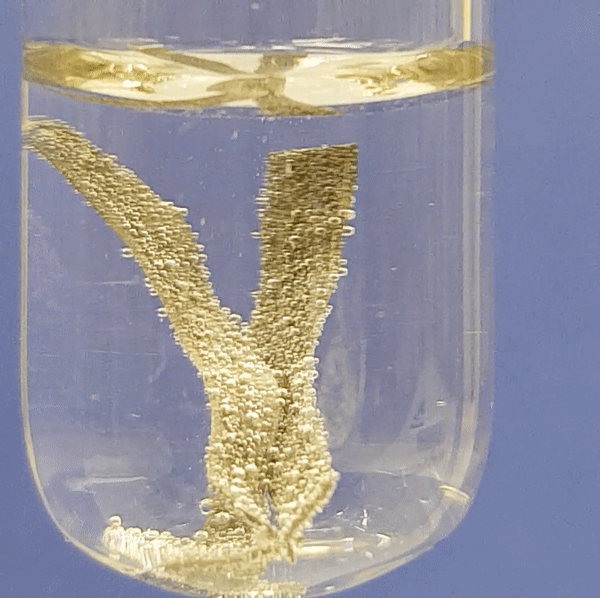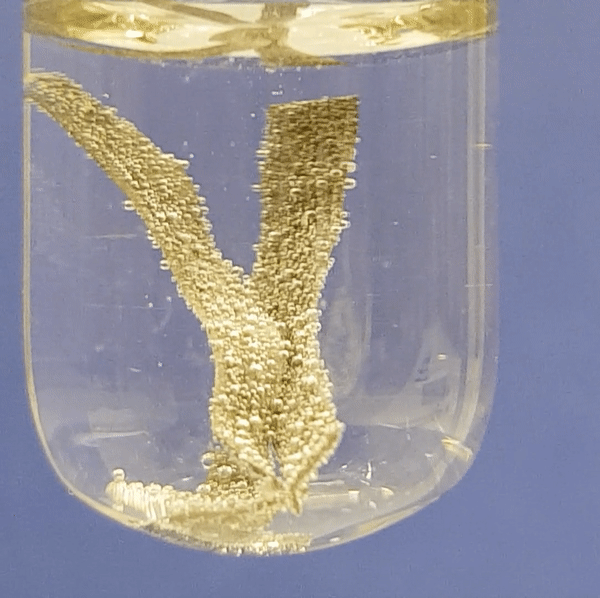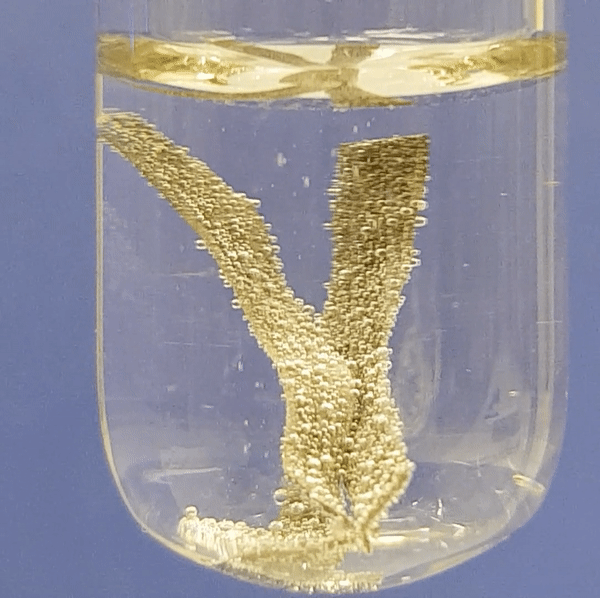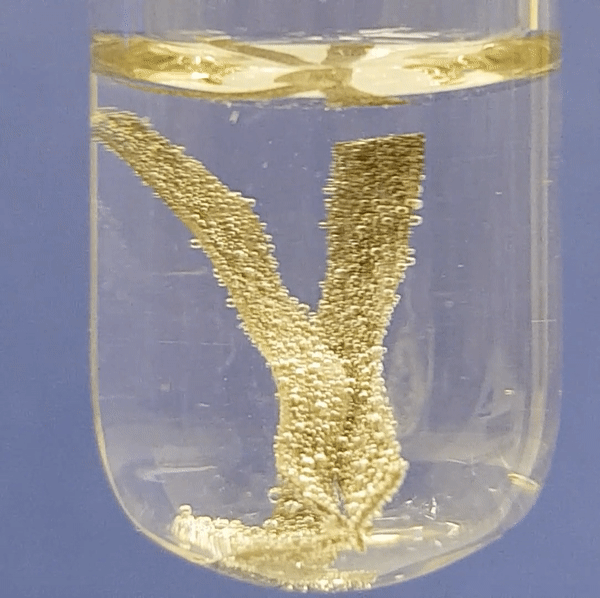
|
|
Tsingi reageerimine soolhappe lahusega:
|
|
Raua reageerimine soolhappe lahusega:
|
Joonis 2. Metallide reageerimine soolhappe lahusega
Reaktsioonide kirjutamisel tuleb lahustuvustabelist vaadata tekkiva soola lahustuvust. Kui metalli pinnale tekib mittelahustuva soola kiht, siis võib metalli ja lahjendatud happelahuse vaheline reaktsioon lakata või pole soolakihi kiire tekkimise tõttu reaktsioon üldse märgatav. Seda võib näha näiteks kaltsiumi reageerimisel lahja väävelhappelahusega.
Ca + H2SO4(lahj)→ CaSO4↓+H2
Metallid, mis asuvad pingereas vesinikust paremal, lahjade happelahusega ei reageeri.
Kaltsiumi pind kattub rasklahustuva kaltsiumsulfaadi tiheda kihiga, mis takistab metalli edasist kokkupuudet happelahusega ja reaktsioon vaibub. Katsete läbiviimisel oleks mõistlik metallid ka oksiidikihist puhastada.
Metallid, mis asuvad pingereast vesinikust paremal, lahjade happelahustega ei reageeri.
Cu + HCl(lahj) → ei toimu
Metallide reaktsioonid lämmastikhappelahusega
Lahja HNO3-lahuse reageerimisel metallidega ei eraldu vesinikku.
Lämmastikhape on väga tugev oksüdeerija. Kontsentreeritud HNO3 on tugevam oksüdeerija kui H2SO4. Lahjendatud HNO3-s (erinevalt H2SO4-st) on oksüdeerijaks NO3- -ioonid, mitte H+-ioonid. Seetõttu ka lahja HNO3-lahuse reageerimisel metallidega ei eraldu vesinikku. Sõltuvalt happe kontsentratsioonist, metalli aktiivsusest ning temperatuurist on saadused erinevad.
METALL + LÄMMASTIKHAPE → SOOL + VESI + LÄMMASTIKUÜHEND
tsink + lämmastikhape → tsink(II)nitraat + lämmastikdioksiid + vesi
Zn + 4 HNO3(konts) → Zn(NO3)2 + 2 NO2↑ + 2H2O
tsink + lämmastikhape → tsink(II)nitraat + lämmastikoksiid + vesi
3 Zn + 8 HNO3(lahj)→ 3 Zn(NO3)2 + 2 NO↑ + 4 H2O
Lämmastikhappe vesilahusega reageerivad ka vähemaktiivsed metallid Cu, Hg, Ag.
Metalli reageerimisel lämmastikhappe lahusega võib tekkida veel teisi lämmastikühendeid. Koolikeemias seda teemat laiemalt ei käsitleta, aga huvi korral võid lisaks lugeda siit
 Loe lisaks: Metallide reaktsioonid lämmastikhappelahusega.
Loe lisaks: Metallide reaktsioonid lämmastikhappelahusega.
Üldised reegelid lämmastikhappe reageerimisel metallidega:
1. mida lahjem on lahus, seda madalama oksüdatsiooniastmega lämmastikuühend tekib;
2. mida aktiivsem on metall, seda madalama oksüdatsiooniastmega lämmastikühend tekib.
+5 +4 +3 +2 +1 0 -3 -3
HNO3 → NO2 → HNO2 → NO → N2O → N2 → NH3 (NH4NO3)
Lämmastikhappe lahuse kontsentratsiooni mõju
Vaatleme näitena Zn reageerimist erineva kontsentratsiooniga lämmastikhappe lahusega (eksperimentaalsete andmete põhjal).
Metall + lämmastikhape → sool + vesi + lämmastikühend
Zn + 4 HNO3(konts) → Zn(NO3)2 + 2 NO2↑ + 2H2O
3 Zn + 8 HNO3 (lahj)→ 3 Zn(NO3)2 + 2 NO↑ + 4 H2O
NB! Olukord on sageli keerulisem, sest reaktsioonisegu võib sisaldada erinevaid ühendeid samaaegselt (vaata ülevalpool toodud lämmastikühendite rida). Sageli kirjutatakse reaktsioonivõrrand aga selle saaduse kohta, mida segus on kõige rohkem.
Lämmastikhappe reageerimine erineva aktiivsusega metallidega
Al, Fe, Ni ja Cr passiveeruvad konts. lämmastikhappes ja Pt ning Au ei reageeri. Alates Mn-st tekib NO2, aktiivsete metallidega tekib N2O. Sn reageerimisel HNO3-ga tekib tinahape H2SnO3. Väga aktiivsete metallide reageerimisel kontsentreeritud lämmastikhappe lahusega tekib põhisaadusena dilämmastikoksiid.
8 Na + 10 HNO3 (konts) → 8 NaNO3 + N2O + 5 H2O
4 Ca + 10 HNO3 (konts) → 4 Ca(NO3)2 + N2O + 5 H2O
Väheaktiivsete metallidega reageerimisel on põhisaaduseks punakaspruun NO2, mida eraldub reaktsiooni käigus märgatavalt (vaata joonist allpool).
Ag + 2 HNO3 (konts) → AgNO3 + NO2 + H2O
Bi + 6 HNO3 (konts) → Bi(NO3)3 + 3 NO2 + 3 H2O
Cu + 4 HNO3 (konts) → Cu(NO3)2 + 2 NO2 + 2 H2O
Tina reageerimisel kontsentreeritud lämmastikhappega tekib tinahape H2SnO3, mis ei lahustu vees. Tina reageerimisel lahjendatud lämmastikhappe lahusega tekib sool.
Sn+4 HNO3 (konts) → H2SnO3 + 4 NO2 + H2O
3 Sn + 8 HNO3 (lahj) → 3 Sn(NO3)2 + 2 NO + 4 H2O

Vase reaktsioon kontsentreeritud lämmastikhappelahusega. HNO3 sisaldus suurem kui 63%
Metallide reaktsioonid vee ja veeauruga
Metallide reageerimine veega sõltub metalli aktiivsusest. Taas on reaktsioonide kirjutamisel abiks metallide pingerida. Eristada saab kolme tüüpi reaktsioone.
- AKTIIVNE METALL + VESI → HÜDROKSIID + VESINIK
- KESKMISE AKTIIVSUSEGA METALL + VEEAUR → OKSIID + VESINIK
- VÄHEAKTIIVSED METALLID EI REAGEERI EI VEE EGA VEEAURUGA
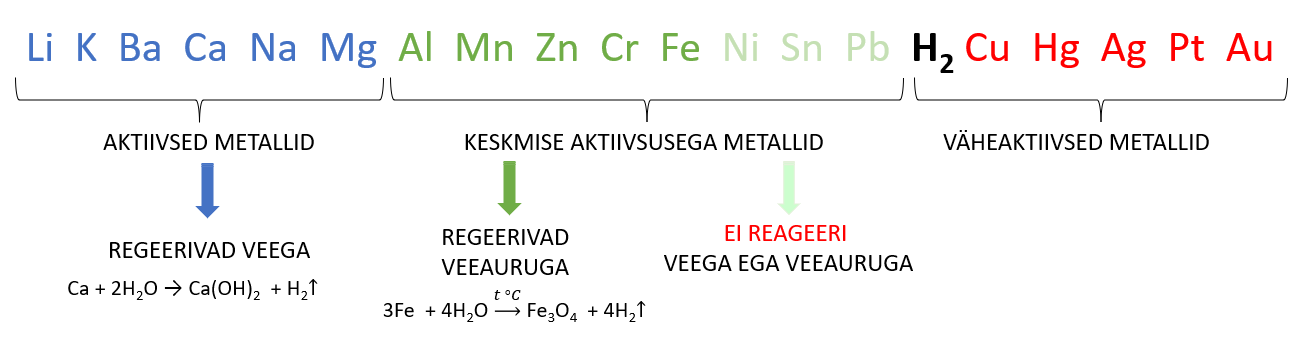
Metallid alates alumiiniumist ei reageeri veega tavatingimustel (st toatemperatuuril). Põhjuseks on tihe oksiidikiht metalli pinnal. Kui oksiidikihti metalli pinnal ei oleks, siis reaktsioon toimuks, mistõttu ei ole võimalik Al toota soolalahuse elektrolüüsil. Veega reageerib alumiinium temperatuuril üle 180 °C:
2 Al + 6 H2O → 2 Al(OH)3 + 3 H2 (tekkida võib ka oksiidi ja hüdroksiidi segu).
Aktiivse metalli reageerimisel veega eraldub vesinik ja tekib leelise lahus.
Aktiivsed metallid Li, Rb, K, Cs, Ba, Sr, Ca, Na, Mg regeerivad veega. Redutseerijaks on metall ja oksüdeerijaks on vesi. Veest eraldub leelismetallide toimel vesinik. Alates kaaliumist toimub reaktsioon nii tormiliselt, et tekkinud leelismetall ja vesinik süttivad.
2 Li(t) + 2 H2O(v) → 2 LiOH(l) + H2(g)
2 Rb(t) + 2 H2O(v) → 2 RbOH(l) + H2(g) (süttib põlema)
Ba(t) + 2 H2O(v) → Ba(OH)2(l) + H2(g) (energiline reaktsioon)


Joonis 3. Na ja Ca reaktsioon veega
Allolevalt videolt näed, et Mg-tüki ümber on tekkinud vees aluseline keskkond, sest fenoolftaleiin (indikaator) on värvunud roosaks. Vesinikumullide eraldumine intensiivistub vähesel kuumutamisel. Toatemperatuuril Mg reaktsioon veega praktiliselt ei toimu.
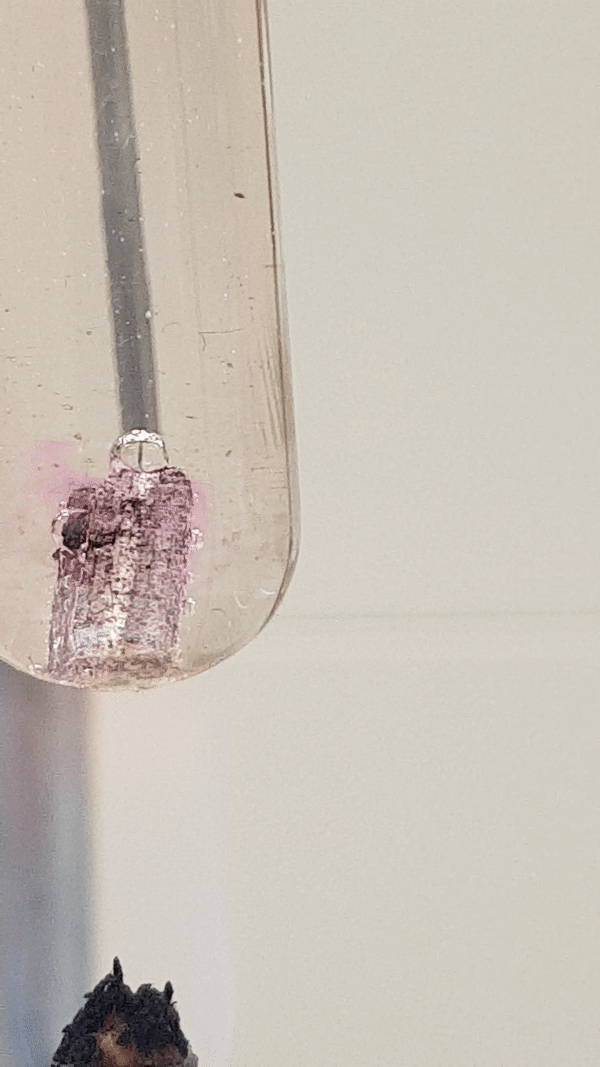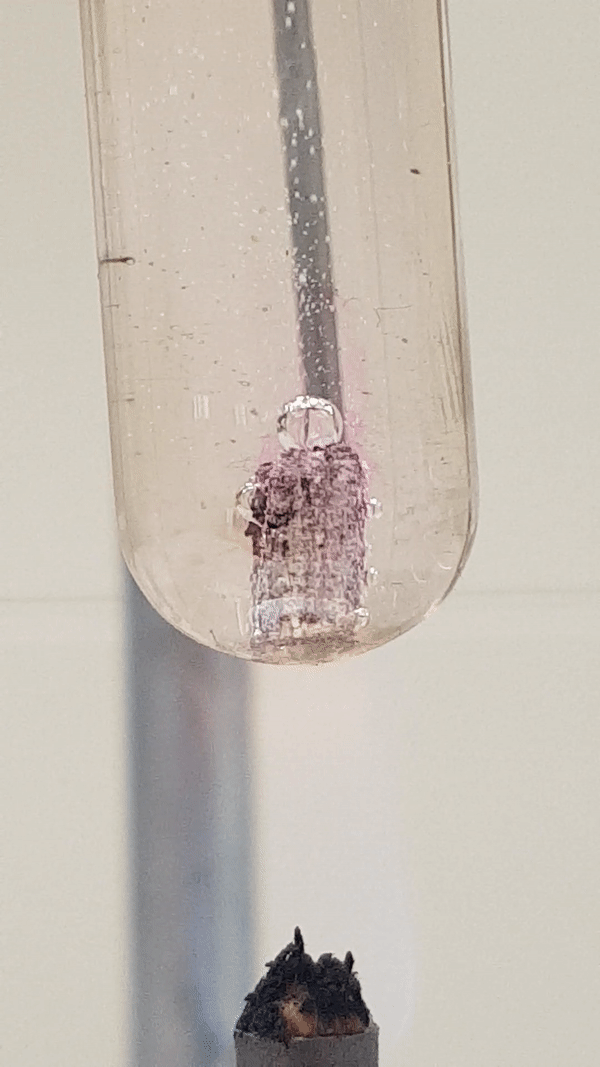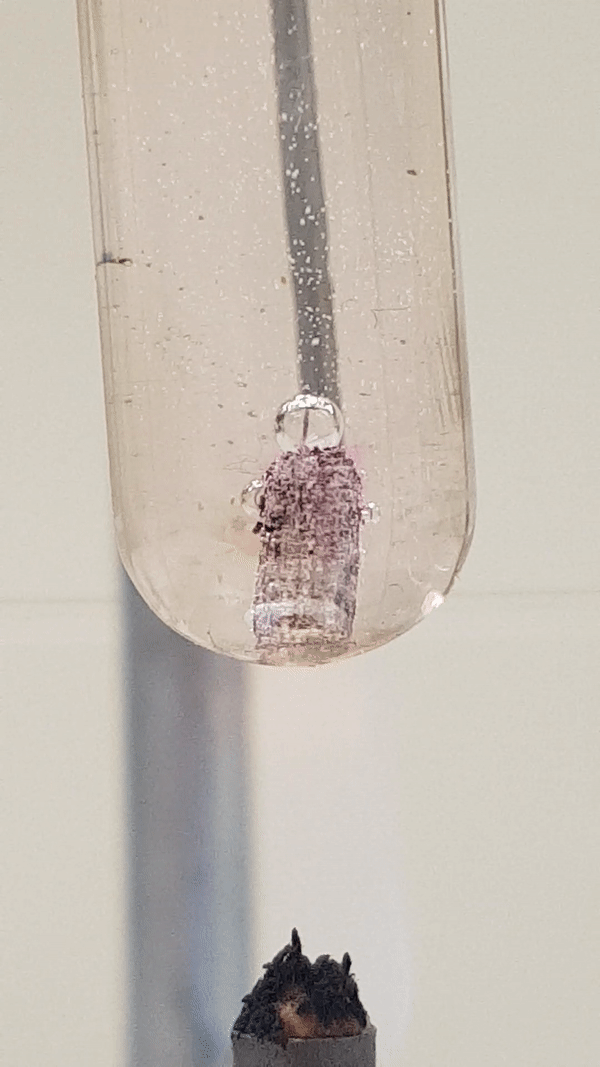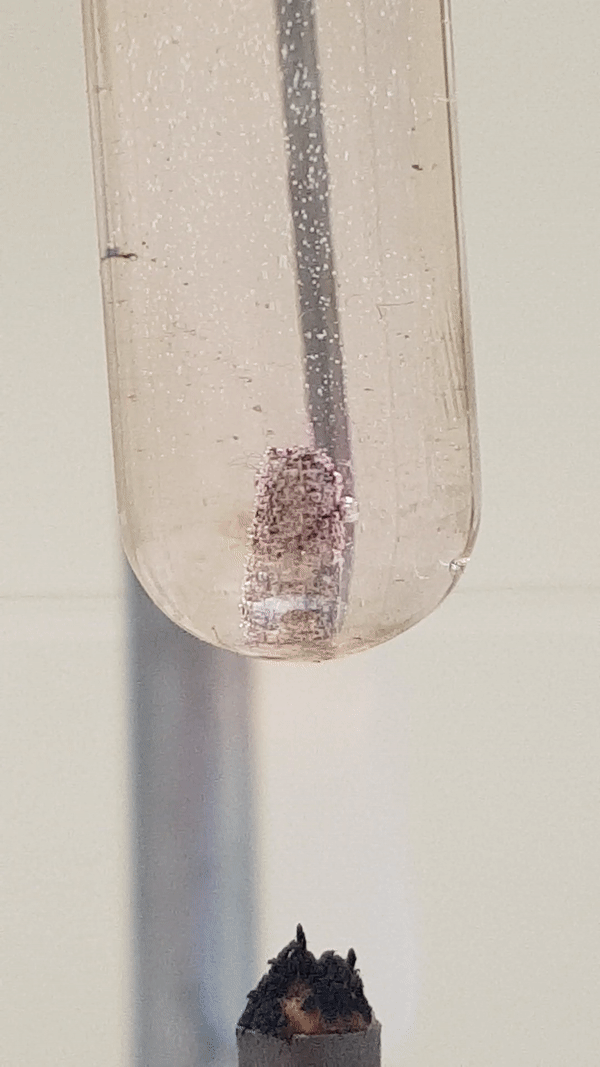
Joonis 4. Mg reaktsioon veega (lisatud on indikaatorit fenoolftaleiini). Vähesel kuumutamisel tekib magneesiumhüdroksiid ja eraldub vesinik. Reaktsiooni tunnusena näed, et aluse tekkimisel värvub lahus indikaatori tõttu roosaks, lisaks näed gaasi eraldumist. Mg(t) + 2 H2O(v) → Mg(OH)2(l) + H2(g)
Metallide reaktsioonid soolade vesilahustega
Üldreegel on, et metalli reageerimisel soolalahusega tõrjub aktiivsem metall välja vähem aktiivse metalli.
Metallide sukeldamisel soolade vesilahustesse võib toimuda väga palju erinevaid protsesse. Sageli toimuvad paralleelreaktsioonid. Reaktsioonid võivad olla mõjutatud nii metalli aktiivsusest kui ka soolalahuse happesusest. Kui soovitakse viia läbi reaktsioon, kus aktiivsem metall tõrjub vähem aktiivse metalli soolalahusest välja, tuleb järgida järgmisi reegleid:
- aktiivsem metall ei reageeri soola lahuses veega;
- reageeriv sool peab lahustuma vees;
- lähtemetall peab olema aktiivsem kui väljatõrjutav metall.
Kui on jälgitud eelnimetatud reegleid, siis saame kirjutada reaktsioonivõrrandeid järgneva skeemi alusel:
METALL + SOOL → UUS SOOL + UUS METALL
Fe(t) + CuSO4(l) → Cu(t) + Fe2SO4(l)
Reaktsiooni saame kirjutada ioonvõrrandina:

Kuna raud on pigereas eespool, saab raud välja tõrjuda metallilise vase vasesoola lahusest.
Nende reaktsioonide kirjutamisel on jällegi abiks metallide pingerida.

Joonis 5. Videost näed, et raudplaadile tilgutatakse sinakat vask(II)sulfaadi lahust. Toimub reaktsioon ja on näha, et hallika raudplaadi pinnale tekib punakat värvi vasekiht.
 Loe lisaks: Amfoteersete metallide reaktsioonid leelistega.
Loe lisaks: Amfoteersete metallide reaktsioonid leelistega.
LEELIS + METALL (amfoteerne) → KOMPLEKSÜHEND + VESINIK
Alumiiniumi reaktsiooni naatriumhüdroksiidi lahusega on näha videost allpool. Alumiinium on amfoteerne metall, mis reageerib nii aluste kui hapetega teatud tingimustel.
2 Al(t) + 6 NaOH(l) + 6 H2O(v) → 2 Na3[Al(OH)6](l)+ 3 H2(g)
või ioonsel kujul:
2 Al(t) + 6 OH–(l) + 6 H2O → 2 [Al(OH)6]3-(l) + 3 H2(g)

Alumiiniumi reaktsioon puhastusvaheniga Torusiil. Torusiil on selles katses 15%-line NaOH-lahus
4.9. Metallide korrosioon
Korrosioon on metalli hävinemine ümbritseva keskkonna mõjul.
Metalle kasutatakse väga laialdaselt tööstuses ja igapäevaelus. Metallidel on materjalina suured eelised: hea plastilisus, tugevus, elektri- ja soojusjuhtivus. Samas on neil ka suur puudus – paljud metallid ei ole keemiliselt vastupidavad. Metallid reageerivad õhus, vihmavees ja pinnases olevate ainetega, moodustades oksiide, karbonaate, sulfiide jt. Korrosioon on metalli hävinemine ümbritseva keskkonna mõjul. Metalli korrosioon on redoksreaktsioon, kus metall on redutseerija.
Allikas: https://youtu.be/EwiL-4H361U
Leelis- ja leelismuldmetallide ( IA ja IIA rühma metallid) korrosioon on väga kiire. Seda nägid ka eelnevatest peatükkidest, kus metalli pinna lõikamisel kattus metalli läikiv pind kiiresti tuhmi oksiidikihiga. Raua korrosioon on pigem aeglane protsess ja raua pinnale tekib pikema aja jooksul punakaspruun roostekiht (Fe2O3·nH2O). Raua korrosiooni nimetatakse ka roostetamiseks ning selle tulemusena võib hävineda kogu metall. Kuna rauda kasutatakse väga laialdaselt, siis tekitab raua korrosioon olulist majanduslikku kahju.
Vasel ja hõbedal korrodeerub ainult metalli pindkiht. Vask muutub hallikaksroheliseks vask(II)hüdroksiidkarbonaadi ((CuOH)2CO3) tekke tõttu. Hõbeda pinnale tekib hõbeoksiid või hõbesulfiid (Ag2O, Ag2S).
Metallide korrosioon on isevooluline protsess. Metallist moodustub tagasi ühend, millena ta ka looduslikult esineb. Korrosioonil tekkinud ühendid on püsivad. Korrosioonile vastupidine protsess on metalli tootmine maagist, milleks tuleb kulutada väga palju energiat. Joonisel 1 on toodud lihtsustatud energiadiagramm, mis näitab metalli muutumist metalliühendiks.
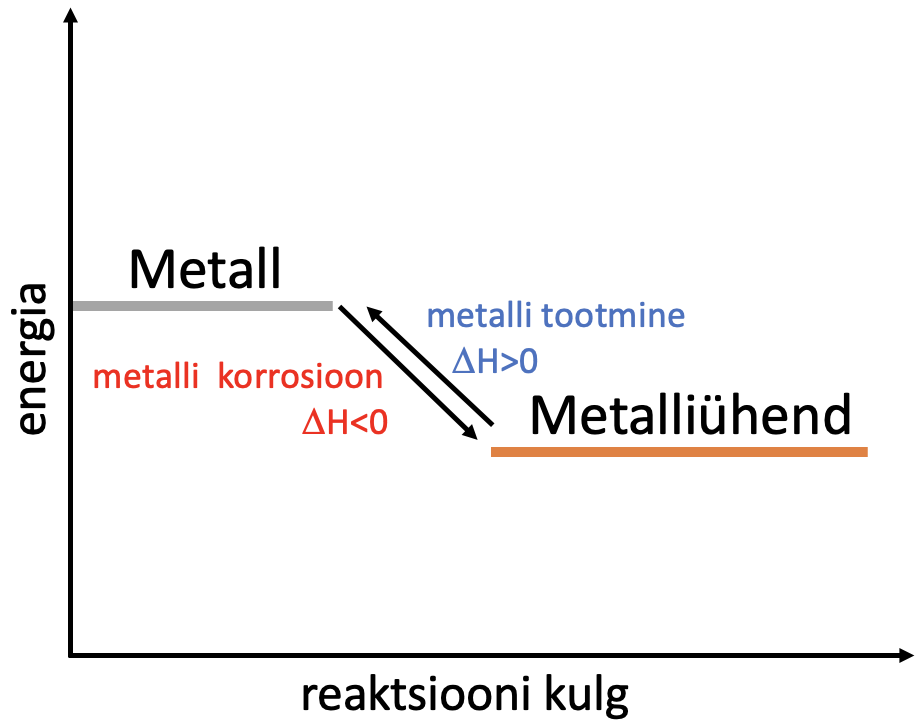
Joonis 1. Metalli ja metalliühendi energiadiagramm
Keemiline korrosioon
Keemiline korrosioon toimub otseses reaktsioonis metalli ja keskkonnas leiduvate oksüdeerijatega, eelkõige kuivade gaaside (hapnik, kloor) või orgaaniliste vedelike (bensiin, õlid) keskkonnas. Tüüpilisemad näited on siin keemiatööstuse reaktorid, automootorid, kuumutusahjud jne.
2 Na (t) + O2(g) → Na2O2(t) keemiline korrosioon
2 Na (t) + O2(g) → 2 Na2O(t) keemiline korrosioon
2 Fe(t) + 3 Cl2(g) $\xrightarrow{temp}$ 2 FeCl3(t) keemiline korrosioon
3 Fe(t) + 2 O2(g) $\xrightarrow{temp}$ Fe3O4(t) kuumutamisel keemiline korrosioon
Elektrokeemiline korrosioon
Elektrokeemiline korrosioon on oluliselt levinum kui keemiline korrosioon. Elektrokeemiline korrosioon leiab aset elektrolüüdilahuses, milleks võib olla ka õhuke veekiht, mis tekib metalli pinnale niiskes õhus ja milles on lahustunud õhus sisalduvad ained.
Tavatingimustes korrodeeruvad veega ainult aktiivsemad metallid. Väheaktiivsete metallide korrodeerumiseks ei ole vesi piisavalt tugev oksüdeerija.
2 Na (t) + 2 H2O(v) → 2 NaOH(l) + H2(g) elektrokeemiline korrosioon
Happelises lahuseks on oksüdeerijaks vesinikioon:
Fe(t) + 2 HCl(l) → FeCl2(l) + H2(g) elektrokeemiline korrosioon
Viimase võrrandi saab kirjutada järgmiste poolreaktsioonidena:
Fe(t) - 2e- → Fe2+(l) toimub raua oksüdeerumine
Vabanenud elektronid kasutatakse ära teises poolreaktsioonis:
2H+(l) + 2e- → H2(g).
Need kaks poolreaktsiooni võivad toimuda metalli erinevates piirkondades. Korrodeerumine saab toimuda seni, kuni jätkub vesinikioone. Kaks poolreaktsiooni kokku võttes saab kirjutada summaarse ioonvõrrandi:
Fe(t) + 2H+(l) → Fe2+(l) + H2(g).
Juhul, kui ei ole tegemist neutraalse lahusega, on enamasti põhiliseks oksüdeerijaks vees lahustunud õhuhapnik (O2), mida on õhus 21 mahuprotsenti. Hapniku redutseerumisel tekib aluseline keskkond:
O2 (g)+ 2H2O(v) +4e- → 4OH-(l)
Hüdroksiidioonide toimel tekivad algul Fe2+-ioonid, mis oksüdeeruvad õhuhapniku toimel edasi Fe3+-ioonideks. Raua pinnale tekib rooste (Fe2O3× nH2O), mis on muutuva koostisega (vaata joonist 2).
4Fe(t) + 3O2(g) + nH2O(v) → 2Fe2O3 nH2O(t)
Igapäevaelus laialdaselt tundud roostetamine ongi raua elektrokeemiline korrosioon neutraalses elektrolüüdilahuses.
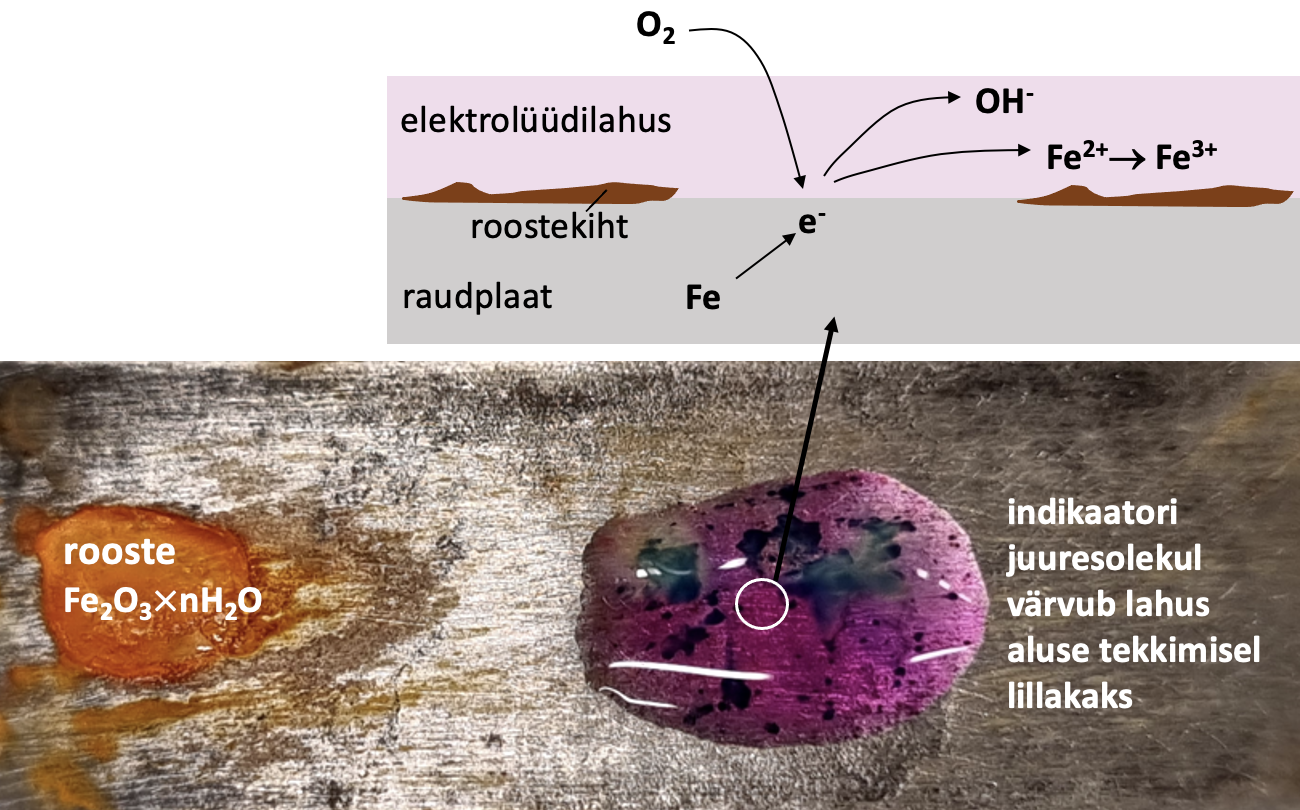
Joonis 2. Raua elektrokeemiline korrosioon neutraalses lahuses
Korrosioonitõrje
Korrosioon tekitab majanduslikult väga palju kahju. Metallidest valmistatud seadmed, konstruktsioonid ja masinad võivad muutuda kasutuskõlbmatuks metallide hävimise tõttu. Selle vältimiseks rakendatakse erinevaid korrosioonitõrje meetodeid.
- Metall isoleeritakse väliskeskkonnast lakkimise, värvimise või emailimise teel. Leiab kasutust eelkõige masinate, seadmete ja suurte metallkonstruktsioonide korral. Isoleerimiseks kasutatakse sageli ka metalli katmist mõne polümeerse kilega (plastikuga).
- Metalli katmine teise, vähem aktiivse metalli kihiga. Pinnale kantav metall on vähem aktiivne ja seetõttu korrosioonikindlam. Eriti dekoratiivne on esemete kulla või hõbedaga katmine. Katmine toimub elektrolüüsi teel. Hävineb kõigepealt vähem aktiivne metall. Korrosioonikaitse on tõhus senikaua, kui kattekoht on vigastamata.
- Metalli katmine aktiivsema metalliga. Igapäevaelus kaetakse metallvõrke, vihmaveetorusid ja veeämbreid tsingiga. Eriti vastupidavad ja dekoratiivsed on näiteks kroomitud autodetailid. Aktiivsem metall hakkab korrodeeruma, aga moodustab tugeva oksiidikihi, mis kaitseb alusmetalli. Aktiivsema metalli kiht kaitseb põhimetalli ka siis, kui pindkiht on kahjustatud. Seetõttu on see ka tõhusam korrosioonitõrje meetod kui vähem aktiivse metalliga katmine.
- Elektrokeemiline kaitse leiab kasutust laevakerede või maa-aluste metalltorude kaitsmisel. Kaitstav ese ühendatakse juhtme abil aktiivsemast metallist plaadiga, mis oksüdeerub. Loovutatud elektronid liiguvad juhtme kaudu kaitsvale metallesemele, kus toimub redutseerumine vesinikioonide ja hapniku molekulide osavõtul.
- Kasutatakse ka korrosiooni aeglustajaid, mida nimetatakse inhibiitoriteks. Need võivad olla väga erinevad anorgaanilised või orgaanilised ained. Näiteks titaani ja alumiiniumi pinnale tekitatakse oksiidikiht (TiO2, Al2O3), mis kaitseb metalli hävinemise eest.

