8. Keemia ja meie elukeskkond
8.1. Sahhariidid, valgud, rasvad
Kõik elusorganismid koosnevad väga paljudest erinevatest süsinikuühenditest, millest eriti olulised on sahhariidid (vanema nimega süsivesikud), rasvad ja valgud. Ülevaate nendest saad allolevast videost.
Allikas: https://youtu.be/WZEq5i-Llsk
Sahhariidid
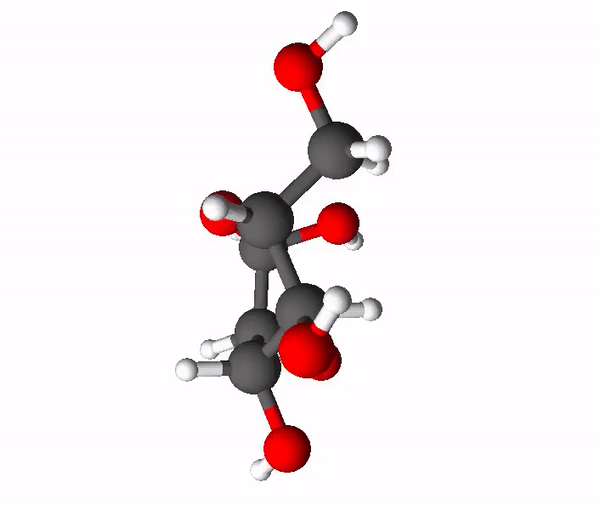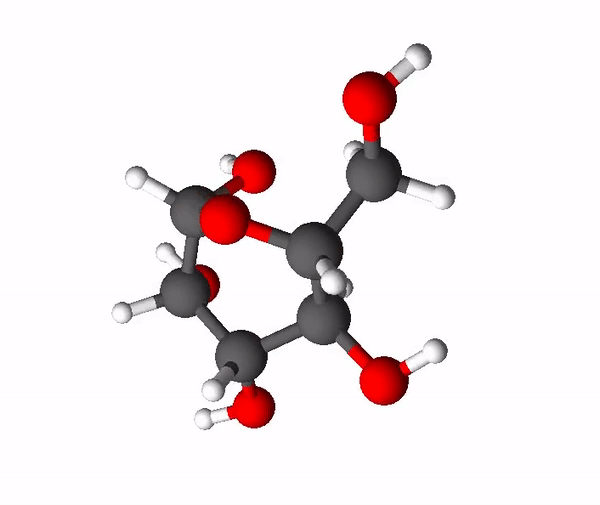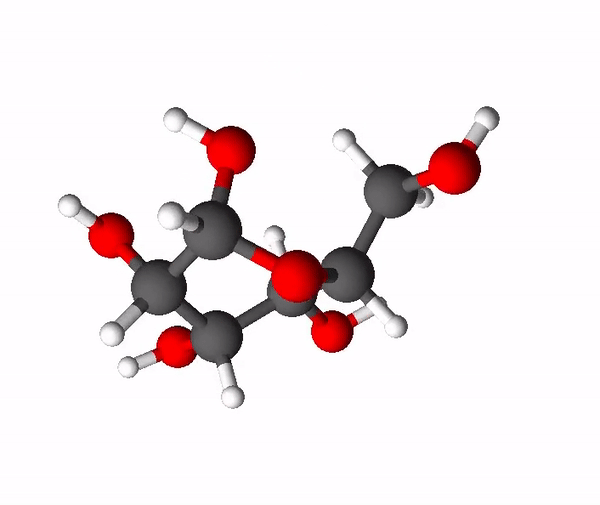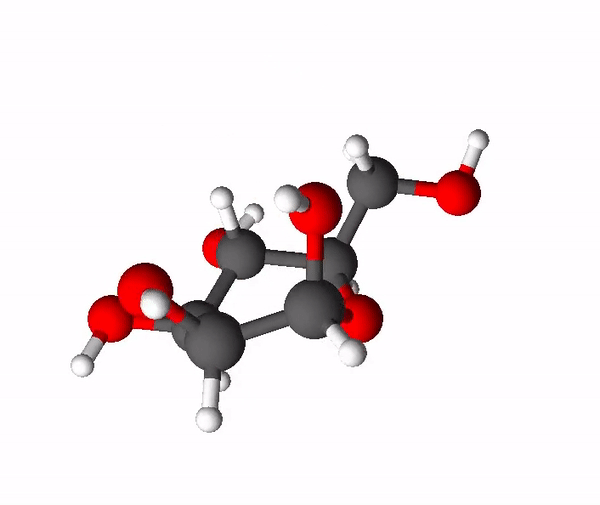 Sahhariidid on orgaanilised ühendid, mis koosnevad süsinikust, vesinikust ja hapnikust ning enamasti on nende molekulides vesiniku ja hapniku aatomite suhe täpselt sama nagu vee molekulis (2 osa vesiniku aatomeid ja 1 osa hapniku aatomeid). Asjaolust, et sahhariidid näivad koosnevat justkui süsinikust ja veest, tuleneb ka nende kohta kasutatav mõiste süsivesikud. Sahhariidide molekulides on palju -OH ehk hüdroksüülrühmi, mis põhjustab nende head vees lahustuvust ehk nad on hüdrofiilsed ained. Väiksemamolekulilised sahhariidid on magusa maitsega ja neid nimetatakse igapäevaelus ka suhkruteks. Tuntuimad suhkrud on glükoos, fruktoos ja sahharoos.
Sahhariidid on orgaanilised ühendid, mis koosnevad süsinikust, vesinikust ja hapnikust ning enamasti on nende molekulides vesiniku ja hapniku aatomite suhe täpselt sama nagu vee molekulis (2 osa vesiniku aatomeid ja 1 osa hapniku aatomeid). Asjaolust, et sahhariidid näivad koosnevat justkui süsinikust ja veest, tuleneb ka nende kohta kasutatav mõiste süsivesikud. Sahhariidide molekulides on palju -OH ehk hüdroksüülrühmi, mis põhjustab nende head vees lahustuvust ehk nad on hüdrofiilsed ained. Väiksemamolekulilised sahhariidid on magusa maitsega ja neid nimetatakse igapäevaelus ka suhkruteks. Tuntuimad suhkrud on glükoos, fruktoos ja sahharoos.
Glükoos ehk rahvapäraselt viinamarjasuhkur on üks tähtsamaid sahhariide. Tema summaarne valem on C6H12O6. Glükoosi molekulis on 5 süsiniku aatomit ja 1 hapniku aatom moodustanud 6-lülilise tsükli, kusjuures üks süsiniku aatom jääb tsüklist välja.
Glükoosi leidub kõigis rohelistes taimedes, kuna ta tekib taimedes fotosünteesi käigus. Glükoos on tähtis toitaine, mida püsisoojased organismid kasutavad kiire energiaallikana. Tema oksüdeerumisel organismis vabaneb suur hulk energiat ja protsessi lõppsaadusteks on CO2 ja H2O.
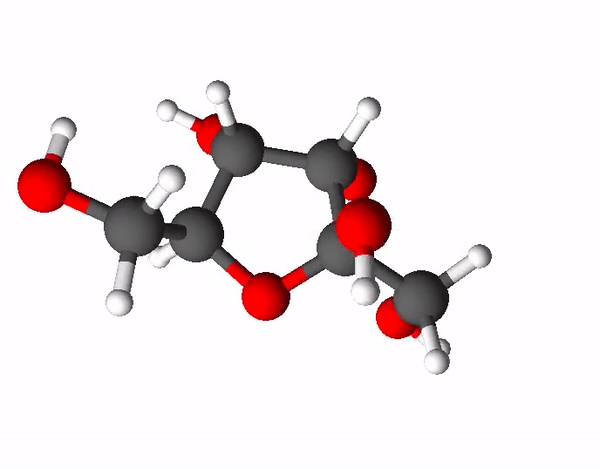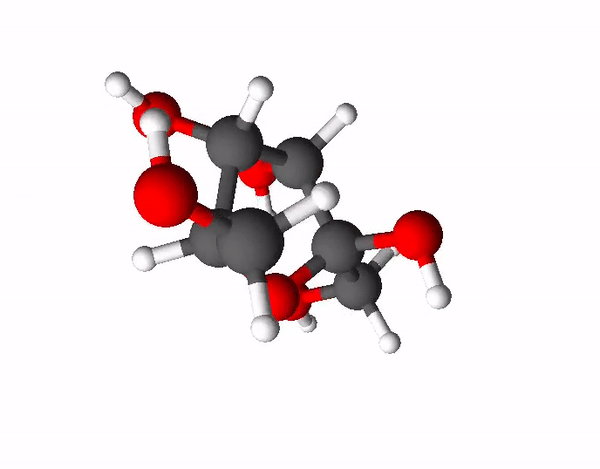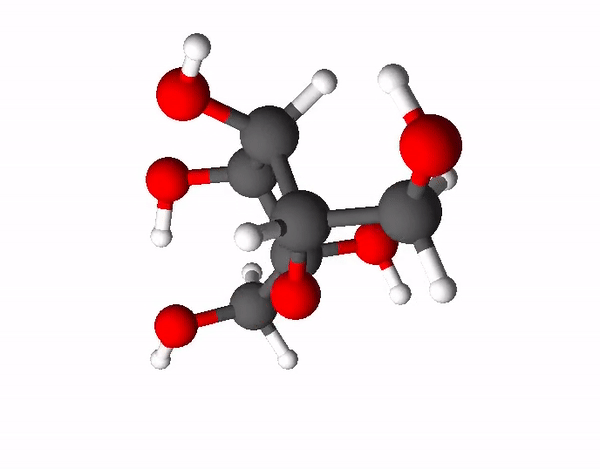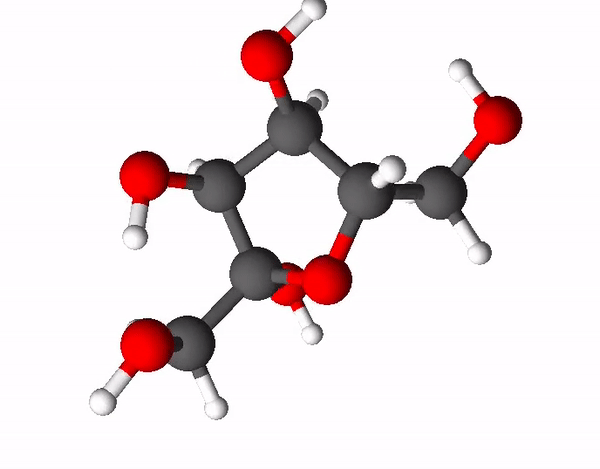 Teine väga levinud ja ka kõige magusam suhkur on fruktoos ehk rahvapäraselt puuviljasuhkur. Fruktoos on sama summaarse valemiga kui glükoos (C6H12O6), kuid tal on hoopis erinev struktuur ehk fruktoos ja glükoos on omavahel isomeerid. Isomeerid on ained, millel on sama elemendiline koostis, kuid erinev struktuur. Fruktoosi molekulis on 4 süsiniku aatomit ja 1 hapniku aatom moodustanud 5-lülilise tsükli, mille korral 2 süsiniku aatomit jäävad tsüklist välja.
Teine väga levinud ja ka kõige magusam suhkur on fruktoos ehk rahvapäraselt puuviljasuhkur. Fruktoos on sama summaarse valemiga kui glükoos (C6H12O6), kuid tal on hoopis erinev struktuur ehk fruktoos ja glükoos on omavahel isomeerid. Isomeerid on ained, millel on sama elemendiline koostis, kuid erinev struktuur. Fruktoosi molekulis on 4 süsiniku aatomit ja 1 hapniku aatom moodustanud 5-lülilise tsükli, mille korral 2 süsiniku aatomit jäävad tsüklist välja.
Fruktoosi leidub puuviljades: viigimarjades, viinamarjades, pirnides, õuntes. Kõige fruktoosirikkam toit on mesi.
Sahharoos ehk lauasuhkur on meie igapäevaelus kõige olulisem suhkur. Sahharoos kuulub disahhariidide hulka. Disahhariidid on sellised süsivesikud, mis moodustuvad kahe monosahhariidi ehk lihtsuhkru ühinemisel, mille korral on eraldunud vee molekul. Sahharoos tekib glükoosi ja fruktoosi molekulidest ning tema summaarne valem on C12H22O11. Teda leidub paljudes taimedes, kõige rohkem suhkruroos ja suhkrupeedis, millest sahharoosi toodetaksegi.
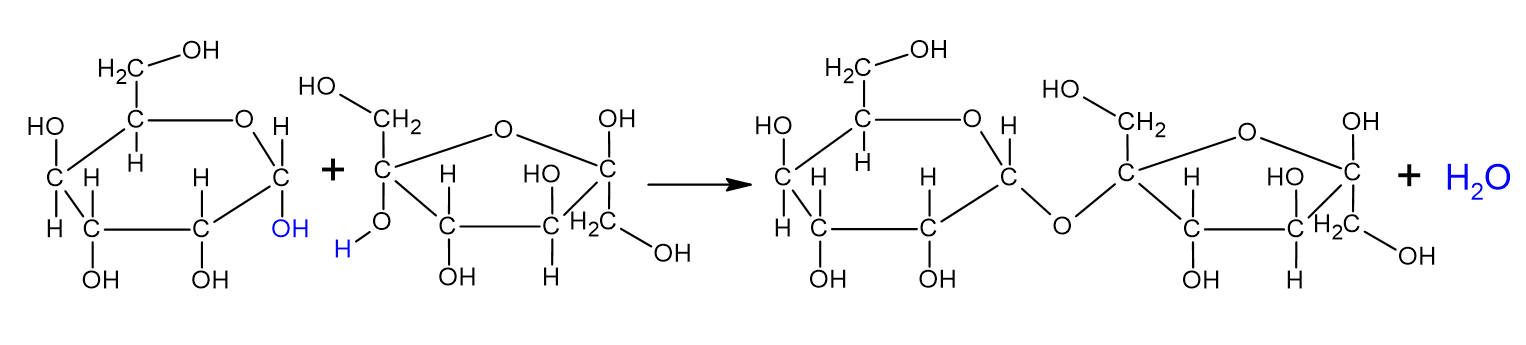
Sahharoosi tekkimine
Omavahel võivad ühineda aga ka väga paljud glükoosi molekulid ja nii tekivad polümeerid ehk antud juhul polüsahhariidid. Polümeerid on ühendid, mille väga suured molekulid koosnevad enamasti ühesugustest väiksemate molekulide lülidest. Tähtsamad polüsahhariidid on tärklis ja tselluloos. Nii tärklis kui ka tselluloos koosnevad üksteisega seotud glükoositsüklitest, kuid glükoositsüklite paigutus ja nende ahelate arv on erinev.
Tärklise korral on kõik glükoositsüklid seotud omavahel ühes ja samas asendis ning glükoositsüklite arv ahelas jääb saja ja mõne tuhande vahele.
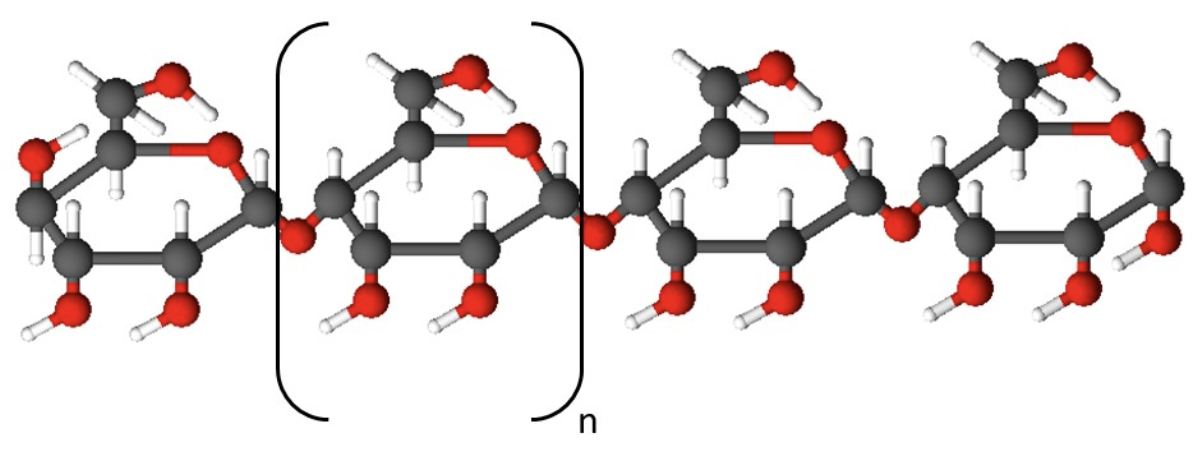
Tärklise struktuur
Tärklis on valge tahke aine, mis ei lahustu külmas vees ja kuumas vees moodustab kliistri. Kõige rohkem leidub teda taimede mugulates (kartul) ja seemnetes (teraviljad). Taimedele on tärklis oluline varuaine ja inimestele tähtis toitaine, mis lagundatakse organismides glükoosiks. Tärklist saame toiduga peamiselt teraviljadest, jahutoodetest (makaronid) ning kartulist.
Tselluloosi korral on aga kaks järjestikust glükoositsüklit üksteise suhtes pööratud 180 kraadi ning tsüklite arv küündib kuni 10 000ni.
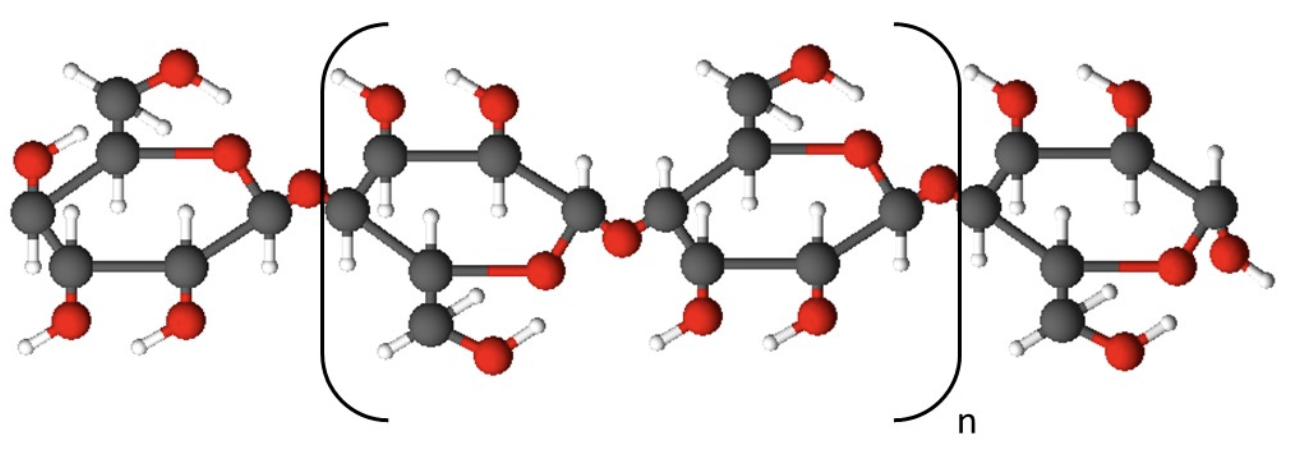
Tselluloosi struktuur
Tselluloos on kiulise ehitusega, tugev ja painduv aine. Ta on keemiliselt väga vastupidav ega lahustu üheski tavalises lahustis. Tselluloos on taimerakukestade koostises ja eriti palju on teda puidus, kust eraldatud tselluloosist toodetakse muuhulgas näiteks paberit. Samuti on puuvill peaaegu puhas tselluloos. Kuigi tärklis ja tselluloos tunduvad ehituselt sarnased, on nende omadused vägagi erinevad. Näiteks tärklis laguneb seedimisel kergesti glükoosiks, kuid tselluloosi loomad, seega ka inimene, seedida ei suuda.
Rasvad
Teine oluline orgaaniliste ühendite liik on rasvad. Rasvad on ühendid, mis on tekkinud glütserooli ja rasvhapete liitumisel. Glütserool on alkohol, mille molekulis on kolm süsiniku aatomit seotud kolme hüdroksüülrühmaga. Rasvhapped on pikema süsivesinikahelaga karboksüülhapped, milles tavapäraselt on paarisarv süsinikke.
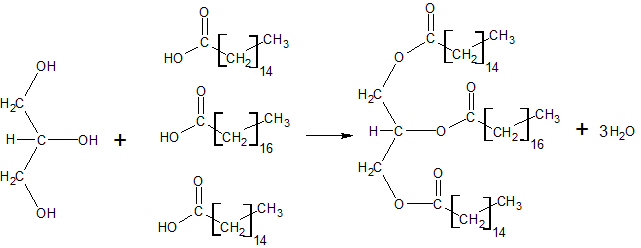
Rasvade moodustumine
Rasvu leidub kõigis organismides ning nad on olulised varuained, mida organism kasutab toidupuuduse korral, kuna rasvad on kõige energiarikkamad toitained. Lisaks on rasvad olulised püsisoojastel loomadel sooja hoidmisel, kuna rasvad on halvad soojusjuhid. Inimese jaoks on rasvad olulised veel seetõttu, et nad kaitsevad mitmeid elundeid (neerud) põrutuse eest ning mõningad olulised vitamiinid (D-vitamiin) lahustuvad rasvades.
Rasvad on hüdrofoobsed ained, kuna nende molekulides on pikad süsivesinikahelad, mis ei oma vastastiktoimet veega, seetõttu ei lahustu rasvad vees, kuid neid saab lahustada mitmetes orgaanilistes lahustites (bensiin). Kuna rasvad on veest väiksema tihedusega, siis rasva ja vee segus jääb rasvakihti veekihi peale. Oma agregaatolekult on osad rasvad tahked ja teised vedelad. Loomsed rasvad on enamasti tahked (searasv) ning taimsed rasvad on vedelad ning neid nimetatakse ka õlideks (rapsiõli). Taimeõlides olevad rasvhapped sisaldavad süsinike aatomite vahel mõningaid kaksiksidemeid. Toiduainetööstus on aga õppinud muutma tahkeks taimseid rasvasid, mis on tavaliselt vedelad. Selle jaoks pannakse taimsed rasvad reageerima vesinikuga ning tekib tahke taimne rasv, millest toodetakse margariini.
Valgud
Valgud on looduslikud polümeerid, mis koosnevad erinevate aminohapete jääkidest. Valkude molekulid tekivad aminohapete ühinemisel. Aminohapped on karboksüülhapped, mis sisaldavad oma struktuuris ka aminorühma.
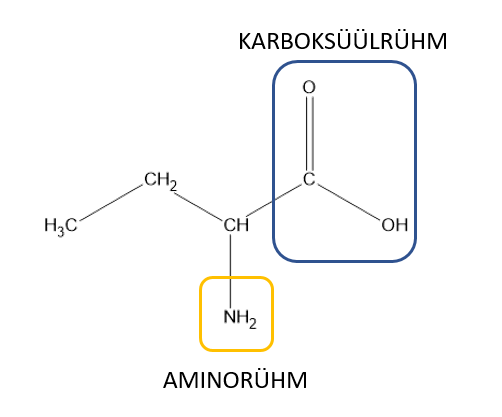
Aminohappe struktuur
Organismides leidub 20 erinevat aminohapet ja sellest tulenevalt on ka väga palju erinevaid võimalusi, kuidas valkude molekule nendest kokku panna. Valgud on elusorganismides kõige tähtsamad ühendid, kuna nad täidavad väga paljusid erinevaid ülesandeid. Valgud on organismis ehitusmaterjaliks, näiteks meie nahk ja juuksed koosnevad valkudest. Hemoglobiin, mis on samuti valk, transpordib meie kehas hapnikku. Ka ensüümid on valgud, mis hoolitsevad selle eest, et keemilised reaktsioonid meie kehas toimuksid kiiremini. Liikumise tagavad sellised valgud nagu müosiin ja aktiin, mis on meie lihastes. Valgulised antikehad kaitsevad meie organismi võõraste ainete eest jne. Valke saame peamiselt loomsest toidust: lihast, munast, piimast ja kalast, aga ka näiteks pähklitest. Seedimisel lagundatakse toidust saadud valgud aminohapeteks ja neist ehitatakse juba uuesti üles meie kehaomased valgud.
8.2. Tervislik toitumine
Meie organismil on tarvis päevast päeva kasvada, areneda ja toimida. Selleks vajab ta aga energiat ning erinevaid aineid, mille kindlustab meile igapäevane toitumine. Mida aga toidu valikul jälgida tuleks? Infot selle kohta annab Sulle järgnev video.
Allikas: https://youtu.be/_S4irjBimd4
Igapäevaselt saame endale eluks vajalikke aineid ja energiat toidust, toitu valmistatakse erinevatest toiduainetest, mis omakorda sisaldavad toitaineid. Vaatleme näiteks sellist toitu nagu pannkoogid. Me kõik teame, et toiduained, mida pannkookide valmistamiseks vaja läheb, on munad, piim, jahu, suhkur, sool ja õli. Nendes nimetatud toiduainetes sisaldub aga erineval määral valke, rasvu, süsivesikuid, mineraalaineid ja vitamiine.
Selleks, et meie organism toimiks tõrgeteta, peame jälgima teatud põhimõtteid:
1. Süüa tuleb nii palju, kui vaja. See tähendab, et organism peab saama toidust õige koguse energiat ja vajalikke toitaineid. See, kui palju energiat organism vajab, sõltub paljudest teguritest (vanus, sugu, füüsiline aktiivsus, organismi ainevahetuse eripära jne), kuid silmas tuleks pidada, et energiahulk, mille me toidust saame, oleks tasakaalus selle energiahulgaga, mille me ära kulutame. Kõige enam saab meie organism energiat rasvadest. Valgud ja süsivesikud annavad energiat üle kahe korra vähem kui rasvad.
2. Organismile vajalikke toitaineid tuleks tarbida õiges vahekorras. Silmas peaks pidama, et päevasest energiavajadusest peaks rasvad katma 25...30%, valgud 10...15% ja süsivesikud 55...60%. Seda, milliseid toiduaineid millises vahekorras võiks süüa, kirjeldab taldrikureegel: umbes poole taldriku mahust peaks katma toorsalat või köögiviljad, ülejäänud kaks veerandit peaks enda alla võtma kala või liha ja praelisand (kartul riis, tatar, makaronid).

Taldrikureegel. Allikas: https://healthmatters.idaho.gov/topics-that-matter/nutrition-matters/
3. Mõõdukalt tohib süüa kõike, mis maitseb. Liialdada ei maksaks isegi tervisliku toiduga, sest see võib samuti viia ühekülgse toitumiseni ja olukorrani, kus organism ei saa kõiki vajalikke toitaineid õiges koguses toidust kätte.
4. Toituma peaks mitmekesiselt. See tähendab seda, et oma toiduvalikud peaks üle vaatama ka sama toidugrupi piires: mitmekesistada tuleks nii puu- ja köögivilja kui ka näiteks piimatoodete valikut oma toidulaual. See on vajalik ka selleks, et vältida samade lisaainete suurte koguste jõudmist organismi.
Põhitoitained ja nende kasutamine
Süsivesikud ehk sahhariidid on organismi peamised energiaallikad, nende katta jääb päevasest energiavajadusest 55...60%. Seedimise käigus lagunevad nad glükoosiks, kusjuures ühest grammist süsivesikutest saab inimene umbes 4 kilokalorit (kcal) energiat. Süsivesikuid saab organism puu- ja aedviljadest, marjadest, teraviljatoodetest ja maiustustest. Eristatakse kahte tüüpi süsivesikuid: kiired ja aeglased, sõltuvalt sellest, kui palju need meie veresuhkru taset mõjutavad. Aeglased süsivesikud mõjutavad veresuhkrut vähem ja täiskõhutunne püsib kauem. Aeglaseid süsivesikuid sisaldavad täisteratooted (kaerahelbed, täisterapasta, täisteraleib jne). Kiired süsivesikud mõjutavad meie veresuhkru taset rohkem ning kiireid süsivesikuid leidub peamiselt töödeldud toiduainetes (valge suhkur, valge jahu, valge riis jne). Olulist rolli meie toitumises mängib ka tselluloos, mida me küll seedida ei suuda, kuid vajame seedimist korrashoidva ja soolestiku normaalset tööd tagava kiudainemassina.
Rasvad peaksid katma päevasest energiavajadusest umbes 25...30%. Rasvad lagunevad organismis glütserooliks ja rasvhapeteks, millest organism valmistab kehaomaseid rasvasid või kasutab energia saamiseks. Ühest grammist rasvadest saab umbes 9 kcal energiat. Rasvade allikateks toidus on nii toiduvalmistamiseks kasutatavad rasvad (oliiviõli, või, rapsiõli) kui ka toiduainetes endis sisalduvad rasvad (kala, seapekk, seemned). Tihti tekitab sõna „rasv“ inimestes teatavat kartust, kuid ka rasvade puhul on oluline tarbimise tasakaal ning seda küllastunud ja muude rasvade vahel. Väga oluline on jälgida, et tarbitaks piisavalt küllastumata rasvhappeid (oomega-3 ja oomega-6 rasvhapped) sisaldavaid toiduaineid (kala, kaunviljasid ja seemneid-pähkleid) ning vähendataks küllastunud rasvhapeterikaste toiduainete (vorstide, viinerite, peekoni, küpsetiste) tarbimist. Kindlasti ei tohi rasvasid oma menüüst välja jätta, kuna rasvade peamine roll organismis on olla energeetiliseks varuaineks.
Valgud peaksid katma päevasest energiavajadusest umbes 10...15%. Valgud lagundatakse organismis aminohapeteks ning seejärel paneb organism aminohapped kokku uuteks, kehale vajalikeks valkudeks. Need valgud koosnevad kahekümnest erinevast aminohappest, millest organism suudab kahtteist aminohapet ise sünteesida. Kaheksat ülejäänut aminohapet, mida nimetatakse ka asendamatuteks aminohapeteks, peame aga kindlasti saama toidust ja organismi ladusaks talitlemiseks piisavas koguses on neid ainult loomses valgus. Seetõttu peaks ka taimetoitlaste menüü olema äärmiselt läbimõeldult koostatud. Valgud hoolitsevad meie organismi ülesehitamise ja lihaskasvu ning ainevahetuse eest, samuti aitavad nad hoida stabiilsena hormonaalse tasakaalu kehas ning mõjutavad otseselt meie tujusid. Veel aitab valguline toit kaasa kehakaalu kontrollimisele, kuna tekitab pikemaks ajaks täiskõhutunde. Ühest grammist valkudest saab inimene umbes 4 kcal energiat. Parimateks valguallikateks on sellised toiduained nagu muna, piimatooted, kala, liha, kaunviljad, pähklid, teravijatooted.
Vitamiine on palju ja erinevaid. Neid vajab meie organism väikestes kogustes ja tasakaalustatud toitumise korral peaksime saama praktiliselt kõik vitamiinid kätte toidust. Meie kliimavöötmes on ainuke erand D-vitamiin, mida peaksime pimedal ajal toidulisandina tarvitama. Vitamiinide roll on organismi ainevahetuse reguleerimine ning seeläbi selle normaalse funktsioneerimise tagamine ja hea tervise säilitamine. Vitamiinid liigitatakse kaheks: vesilahustuvad (C-vitamiin, B-grupi vitamiinid) ja rasvlahustuvad (A-, D-, E-vitamiin).
Mineraalained on meie organismile olulised närviimpulsside edastamisel ning hammaste, luude, ensüümide ja kehavedelike koostises. Mineraalaineid saame toidust ja joogiveest erinevate ühendite koostisest. Mineraalained liigitatakse makrolelementideks: neid vajab meie keha suuremas koguses (Ca, K, Mg, Na, P, S jne) ning mikroelementideks: neid vajame tihti väga väikestes kogustes (Zn, Fe, I, Se, F jne). Olenema sellest, kas tegu on mikro- või makroelemendiga, on ühtviisi kahjulik organismile nii nende defitsiit kui ka liigne tarbimine.
8.3. Kütused
Kütused on ained, mille põletamisel eraldub palju energiat (enamasti soojusena), ning mida seetõttu kasutatakse energiaallikatena. Kütusena võib käsitleda kõiki ühendeid, mille koostises on mõni küllaltki madala oksüdatsiooniastmega element, mis saab kergesti oksüdeeruda ja nii üle minna kõrgemale oksüdatsiooniastmele. Igapäevaelus kasutatavates kütustes on salvestunud keemiline energia, mida on suhteliselt lihtne meile sobival ajal ja koguses kasutada. Erinevaid kütuseid on palju ja mõnedega neist saad tutvust teha järgneva video abil.
Allikas: https://youtu.be/zE8UiwMe1o8
Kütteväärtus
Nagu juba ülalpool mainitud, on võimalik põletada kõiki süsinikku sisaldavaid ühendeid, milles süsiniku o.a on madalam kui IV, kuid reaalselt leiavad siiski kütustena kasutust sellised ühendid, mille kütteväärtus on piisavalt suur. Kütteväärtus näitab, kui palju soojusenergiat annab kindel kogus kütust täielikul põlemisel.
Kütteväärtus sõltub
- kütuses sisalduva süsiniku o.a-st: mida madalam on süsiniku o.a, seda suurem on kütteväärtus;
- kütuse vesinikusisaldusest: mida suurem vesinikusisaldus, seda kõrgem on kütteväärtus;
- kütuse leiukohast, niiskusesisaldusest, lisanditest jne.
Näiteks põlevkivi kütteväärtus on 5...12 MJ/kg, puidu kütteväärtus on põlevkivi omale ligilähedane 7...13 MJ/kg, kuid näiteks maagaasi kütteväärtus on kordades kõrgem 45...50 MJ/kg.
Kütuste liigitamine
Kütuseid saab liigitada, lähtudes nende olekust: gaasilised, vedelad ja tahked kütused.
Gaasilised kütused on näiteks maagaas ja biogaas. Maagaas on looduslik kütus, mida saadakse puuraukudest või nafta tootmisel kõrvalproduktina. Biogaasi saab toota näiteks sõnnikust või rohelisest biomassist anaeroobsel käärimisel. Gaasilisi kütuseid on kõige mugavam kasutada ning nende transportimine torude kaudu on samuti lihtne. Gaasilised kütused põlevad täielikult.
Vedelad kütused on näiteks nafta ning sellest toodetavad bensiin ja diislikütus, aga ka bioetanool. Nafta on looduslik kütus, mida saadakse puuraukudest ning temast saab omakorda toota paljusid teisi kütustena kasutatavaid aineid (bensiini, diislikütust) ning samuti kasutatakse väga paljusid nafta destilleerimisel saadud aineid keemiatööstuses, et sünteesida nendest erinevaid saadusi. Bensiin ja diislikütus on aga juba tehiskütused, kuna nende korral on looduslikku kütust ehk naftat töödeldud. Bioetanool on tehiskütus, mida valmistatakse looduslikust toorainest, näiteks heinast, suhkruroost või metsatööstuse jääkidest. Vedelkütuste kasutamine on samuti mugav ning neid transporditakse torude kaudu või tankerite abil. Vedelkütused koosnevad peamiselt põlevatest ainetest ning sisaldavad minimaalsel hulgal mittepõlevaid tahkeid lisandeid.
Tahked kütused on näiteks põlevkivi, puit ja koks. Põlevkivi on looduslik tahke kütus, mis koosneb mittetäielikult lagunenud orgaanilistest ainetest ja mineraalidest. Eestis kasutatakse põlevkivi Narva elektrijaamas elektri tootmiseks. Puit on looduslik tahke kütus, mida saadakse metsade majandamisel. Koks kuulub tahkete tehiskütuste hulka, ta sisaldab süsinikku ja tuhka ning teda saadakse kivisöest või põlevkivist nende kuumutamisel. Tahked kütused ei põle täielikult, kuna hapnik ei pääse põlemisel kogu põlevale ainele ligi ning tahked kütused sisaldavad alati ka anorgaanilisi lisandeid, mis ei põle. Seetõttu tekib tahkete kütuste põletamisel alati jääke.
Veel saame kütuseid jaotada taastuvateks ja taastumatuteks. Taastuvad kütused on sellised kütused, mis tekivad aastate või aastakümnetega ehk nad on hiljuti tekkinud ja neid tekib ka pidevalt juurde. Üks kõige kasutatavam taastuv kütus on puit. Taastumatud kütused on kütused, mille tekkeks kulub miljoneid aastaid ning seetõttu vähenevad nende varud tarbimisel pidevalt. Taastumatud kütused on tekkinud ammu elanud loomade ja taimede jäänustest ja selliste kütustena saab tuua näiteks nafta, kivisöe ja maagaasi.
Tänapäeval, kui taastumatute kütuste varud hakkavad otsa lõppema ja nii nende kaevandamine kui ka kasutamine energia tootmiseks tekitavad keskkonnaprobleeme, on hakatud aina rohkem tähelepanu pöörama alternatiivsetele energiaallikatele nagu näiteks tuule- või päikeseenergia. Mõlemad nimetatud on taastuvad energiaallikad ning energeetikavaldkond liigub aina jõulisemalt selles suunas, et asendada taastumatud kütused taastuvenergiaallikatega.
8.4. Ekso- ja endotermilised reaktsioonid
Sa tead juba, et keemilise reaktsiooni käigus tekivad antud ainetest uued ained. Reaktsioonidega kaasneb aga alati ka energia eraldumine või neeldumine ning kui me seda teame, mõistame paremini, miks toidu seedimisel suudab meie organism säilitada mõistlikku temperatuuri või miks fotosüntees ilma päikeselt tuleva energiata ei toimu. Energia eraldumise ja neeldumisega toimuvate reaktsioonidega saad tutvuda järgmise video abil.
Allikas: https://youtu.be/LvadGckAv3U
Keemilise reaktsiooni soojusefekt
Keemilise reaktsiooni soojusefekt iseloomustab reaktsiooni käigus toimuvaid energeetilisi muutusi. Need muutused on tingitud sellest, et keemilise reaktsiooni toimumiseks tuleb kõigepealt lõhkuda lähtaine(te)s keemilised sidemed. Selleks tuleb kulutada energiat ehk selle protsessi käigus energia neeldub. Uute keemiliste sidemete tekkel saadus(t)e moodustumisel aga energia eraldub.
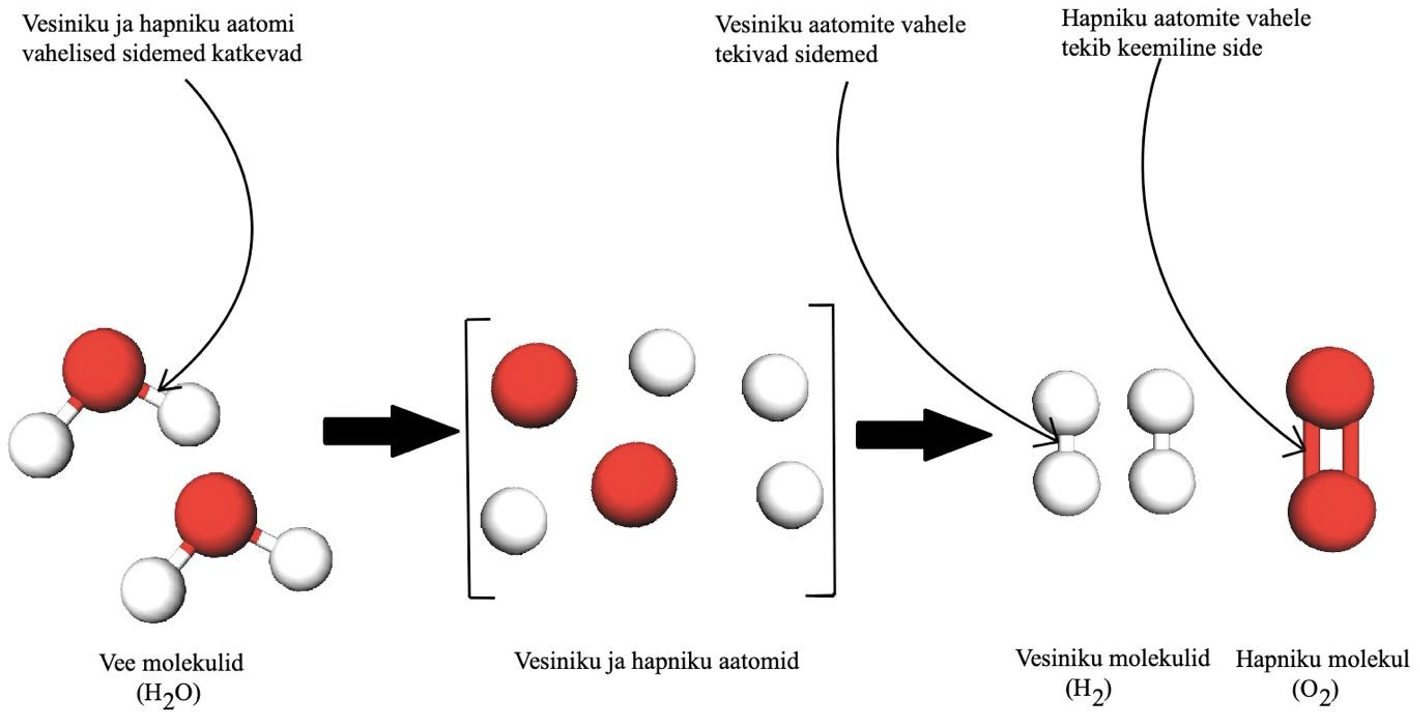
Vee elektrolüüs. Allikas: http://marshscience6.blogspot.com/2015/10/chemical-reactions.html
Jooniselt, kus on kujutatud vee elektrolüüsi, mille käigus tekivad hapnik ja vesinik, võid Sa näha, et kõigepealt tuleb vees hapniku ja vesiniku aatomite vahelised kovalentsed sidemed lõhkuda: selleks kulub energiat (kasutatakse elektrivoolu). Seejärel toimub uute sidemete tekkimine (vesiniku aatomite vahel ja hapniku aatomite vahel) ja selle protsessi käigus energiat eraldub.
Vastavalt sellele, kumb energia (kas sidemete lõhkumiseks neelduv või uute sidemete moodustumisel eralduv) on ülekaalus, saab reaktsioone liigitada soojusefekti alusel eksotermilisteks ja endotermilisteks. Eksotermiline reaktsioon on reaktsioon, mille käigus energiat eraldub. Energia eraldumine toimub reaktsioonikeskkonnast välisesse keskkonda. Tavapäraselt eraldub energia soojusena, kuid see võib eralduda ka valguse või hoopis elektrienergiana. Eksotermiliste reaktsioonide korral on lähteainete sidemete lõhkumisel neeldunud energiahulk väiksem kui uute sidemete tekkel eralduv energiahulk.
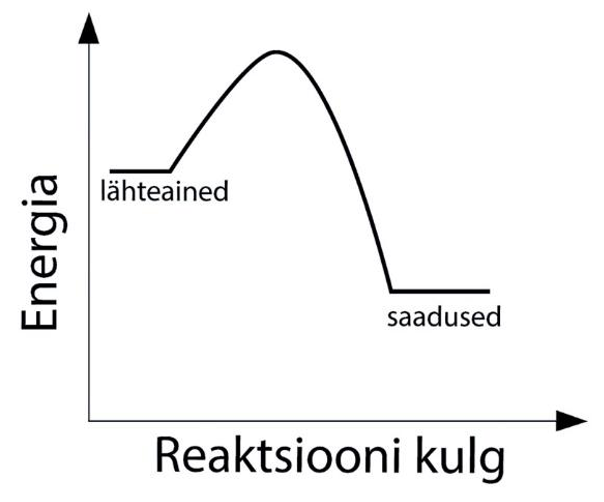
Eksotermiline reaktsioon
Eksotermilised reaktsioonid igapäevaelust on näiteks põlemine, kõdunemine, aga ka telefoni aku tühjenemine.
Endotermiline reaktsioon on reaktsioon, mille käigus energiat neeldub. Energia neeldumine toimub välisest keskkonnast reaktsioonikeskkonda. Endotermilised reaktsioonid vajavad toimumiseks valgust, soojust või elektrit (näiteks eespool toodud vee elektolüüsireaktsioon), et reaktsiooni jaoks oleks üldse piisavalt energiat. Endotermiliste reaktsioonide korral on lähteainete sidemete lõhkumisel neeldunud energiahulk suurem kui uute sidemete tekkel eralduv energiahulk.
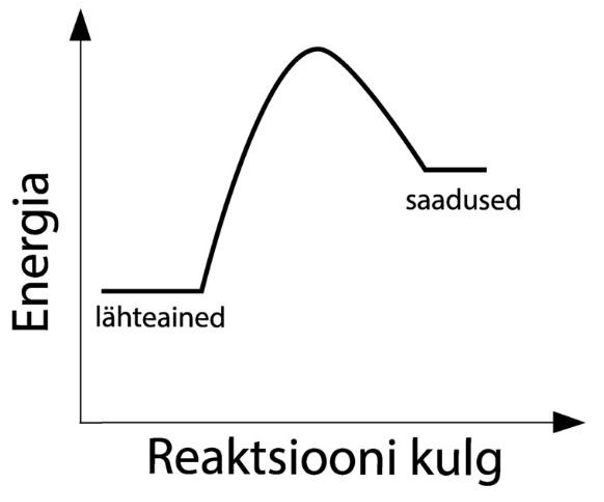
Endotermiline reaktsioon
Endotermilised reaktsioonid igapäevaelus on näiteks fotosüntees, metallide tootmine maakidest, paljud lagunemisreaktsioonid ning telefoni aku laadimine.
8.5. Polümeerid
Nii meie sees kui ka meie ümber on palju ühendeid, mille molekulid on väga suured ja kus saab tuvastada molekulist lõigu, mis terve ahela pikkuses kordub. Sellised ained on näiteks meie organismis olevad valgud, taimede ehitusmaterjaliks olev tselluloos, köögikapis leiduv tärklis, aga ka plastpakendid, pinnakattematerjalid, teflon jne. Mida polümeerid endast kujutavad, sellest annab ülevaate järgmine video.
Allikas: https://youtu.be/p6VkeP8nHOU
Polümeerid on ained, mille väga suured molekulid koosnevad paljudest üksteisega kovalentsete sidemetega seotud väikeste molekulide jääkidest.
Polümeeri tekkeks on tarvis monomeeri. Monomeer on väike molekul, mis on võimeline liituma teiste molekulidega ja moodustama pikki omavahel seotud ahelaid. Polümeeride tähistamisel tuuakse nurksulgudes ära elementaarlüli ehk korduv lüli polümeeri molekulis ja sulgude taga olev täht n (võib ulatuda kümnete ja sadade tuhandeteni) näitab monomeeride arvu, mis on omavahel ühinedes moodustanud polümeeri molekuli.
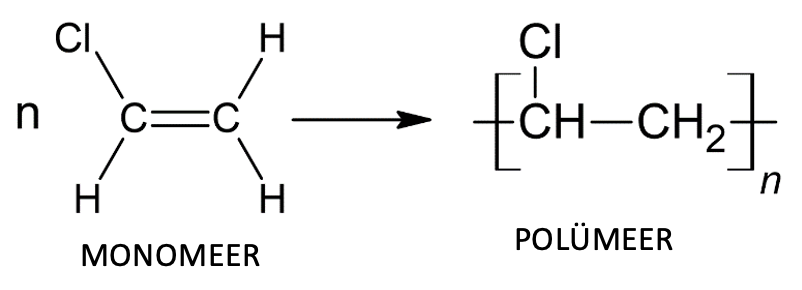
Polümeeri teke
Polümeeride tekkimine
Vaatleme näiteks sellise polümeeri nagu polüeteeni (igapäevaselt meile tuntud kui kile valmistamise tooraine) teket. Polüeteen tekib väga paljude eteeni (CH2=CH2) molekulide liitumisel. Kirjeldame protsessi kahe eteeni (monomeer) molekuli näitel. Mõlemad molekulid sisaldavad kahte süsiniku aatomit ja ühte nendevahelist kaksiksidet (lisaks ka nelja vesiniku aatomit). Kõigepealt toimub monomeerides oleva kordse sideme lõhkumine, mille tulemusena jääb üks sidet moodustav üksik elektron ühe süsiniku aatomi juurde ja teine sidet moodustav üksik elektron teise süsiniku aatomi juurde. Need elektronid on aga väga reaktsioonivõimelised, kuna soovivad leida endale paarilist, millega ühinedes moodustada keemiline side. Paarilise saavad nad teise eteeni molekuli üksiku elektroni näol ning kaks elektroni moodustavadki süsinike aatomite vahele kovalentse sideme.
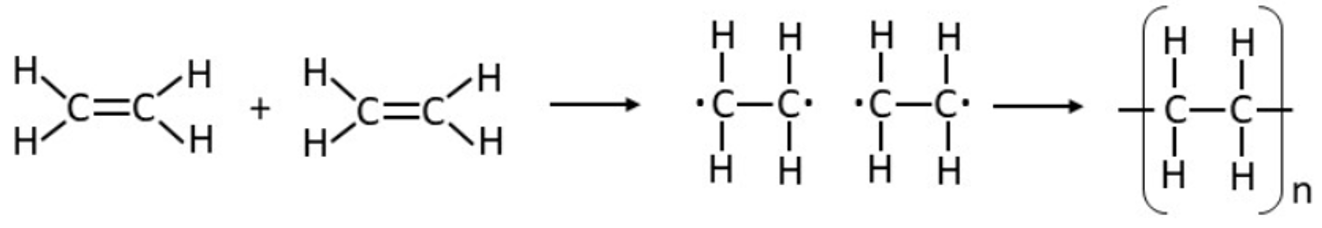
Polüeteeni teke eteeni molekulide liitumisel
Polümeeride liigitamine
Polümeere saab liigitada algmaterjali põhjal kaheks: looduslikud ja sünteetilised polümeerid.
Looduslikest polümeeridest võib välja tuua inimese organismi jaoks ühed tähtsaimad polümeerid – valgud. Valgud on ained, mis meie kehas katalüüsivad mitmeid reaktsioone, on ehitusmaterjaliks jne. Valkude korral on monomeerideks aminohapped, mis ühinedes moodustavad polümeere ja nii tekivadki valgud. Siin näiteks on toodud neljast glütsiini (aminohape) molekulist koosnev valk:
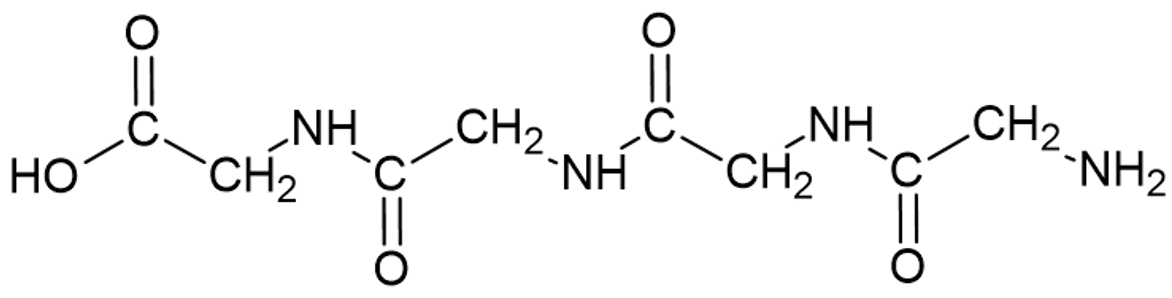
Valgu struktuur
Teiseks inimese organismi jaoks väga oluliseks polümeeriks on nukleiinhapped (DNA ja RNA). DNA on meie organismis pärilikku informatsiooni säilitav aine, RNA osaleb aga geneetilise informatsiooni tõlkijana.
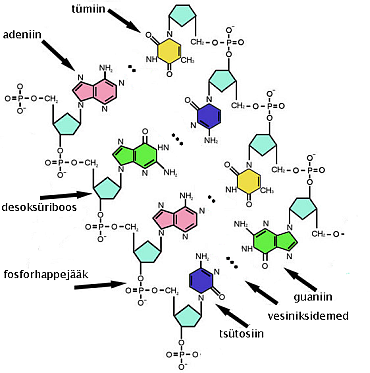
DNA struktuur. Allikas: https://et.wikipedia.org/wiki/DNA
Veel on üheks oluliseks looduslikuks polümeeriks tärklis. Tärklisega oled Sa ilmselt kokku puutunud köögis toimetades. Tärklist kasutab laialdaselt toorainena näiteks ravimi- ja paberitööstus. Taimedes on tärklis varuaine. Tärklise korral moodustavad polümeeri glükoosi molekulid.
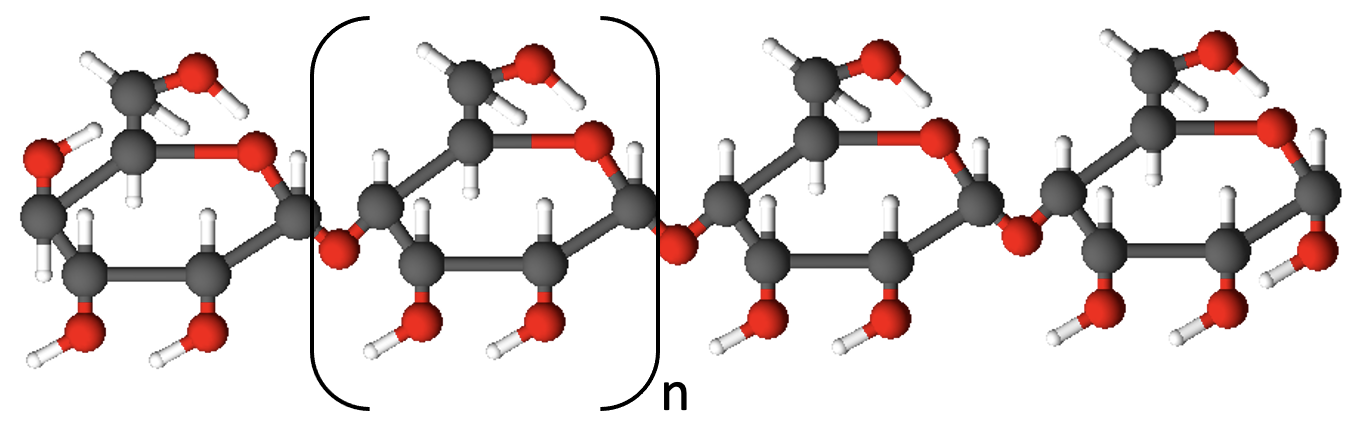
Tärklis
Ehituslikult suhteliselt sarnane tärklisega on tselluloos, mis moodustab taimedes rakukesti. Tselluloosi kasutatakse paberi ja papi, tsellofaani, tehiskiudainete (tehissiid) ja paljude keemiatööstuses valmistatavate toodete lähteainena.
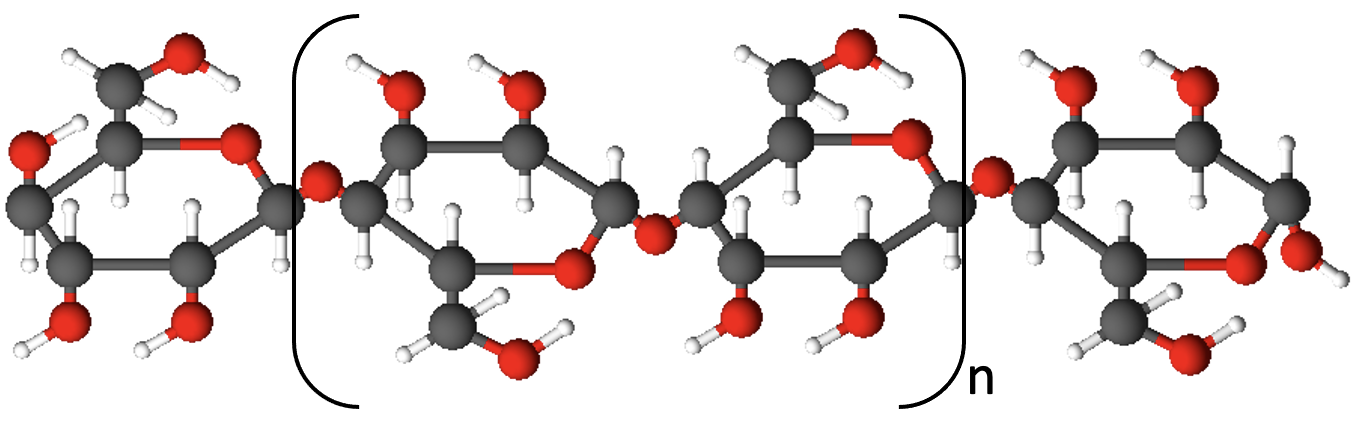
Tselluloos
Igapäevaelus tunned Sa kindlasti ka päris paljusid sünteetilisi polümeere, neist kõige tuntumad on plastmassid, kummid, liimid ja sünteetilised riidekiud.
Plastmasside maailm on väga kirju – nii oma esindajate arvukuse kui ka välimuse poolest. Pangakaartidest prügikottideni ja mänguasjadest autodetailideni – plastmassid ümbritsevad meid kõikjal. Peaaegu kõik plastmassid on toodetud naftasaadustest.
Liimide koostises kõige levinum polümeer on polüvinüülatsetaat (pakenditele märgitud kui PVA, õige lühend PVAc), mida võib leida puidu- ja paberiliimides.
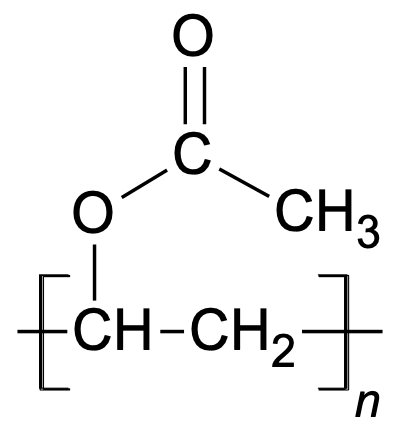
Polüvinüülatsetaat
Sünteetilistest riidekiududest oled aga kindlasti kokku puutunud polüester-, polüamiid- ja akrüülkiust valmistatud rõivaesemetega.
8.6. Tarbekeemia, plastid, kiudained
Me kasutame oma igapäevaelus väga paljusid materjale, aineid ja esemeid, mille saamiseks on pidanud rakendama oma teadmisi ja oskusi keemikud, materjaliteadlased, insenerid, tehnoloogid, disainerid jt. Meie jaoks on iseenesest mõistetav, et kui tahame pesu pesta, haarame pesupulbri või-geeli, kui tahame taimi kahjustavatest putukatest ja taimehaigustest võitu saada, kasutame taimekaitsevahendeid, kui haigestume ootamatult, kirjutab arst meile välja ravimid. Plastist toidukarp või joogipudel, hingavad ja mugavad spordirõivad, meie igapäevased T-särgid. Kõik see tundub nii enesestmõistetav, et tihti unustame asjaolu, et on olnud aeg, kus seda kõike polnud. Millised on meie igapäevaselt kasutatavad tarbekeemiatooted, plastmassid ja kiudained, tutvustab Sulle järgnev video.
Allikas: https://youtu.be/iS-6_b9DYC4
Tarbekeemiatooted
Tarbekeemiatooteid on väga palju ja nad erinevad nii oma omaduste kui ka kasutusvaldkonna poolest. Siia kuuluvad pesemisvahendid, värvid, liimid, ravimid, taimekaitse- ja putukatõrjevahendid ning veel palju muudki.
Pesemisvahendite puhul mõtleme tavapäraselt seebi, šampooni, nõudepesuvahendi või pesupulbri peale. Kõikide pesemisvahendite tööpõhimõte on sarnane. Vaatleme näiteks seepi, mida on osatud valmistada juba sajandeid rasvadest ja seebikivist ehk naatriumhüdroksiidist. Seebi molekulis saab eristada hüdrofiilsest osa ja hüdrofoobset süsivesinikahelat.
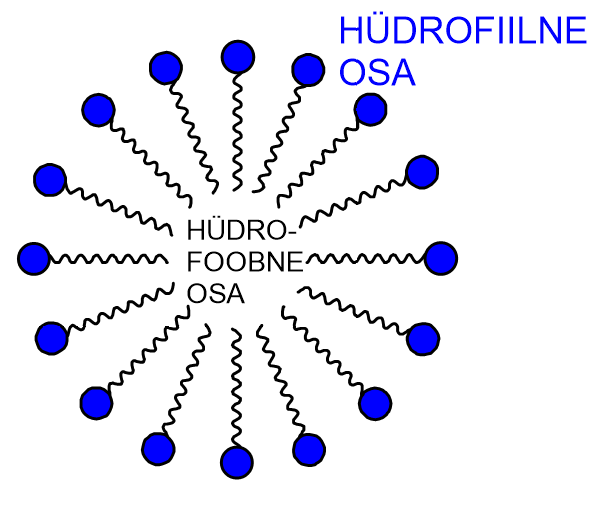
Seebi molekul
Kui seep vees lahustub, tekivad lahusesse seebi anioonid ja naatriumioonid. Seebi anioonid kogunevad mustuseosakese pinnale nii, et vett-tõrjuv osa on pööratud mustuseosakese poole ning hüdrofiilne osa temast eemale ehk vee poole.
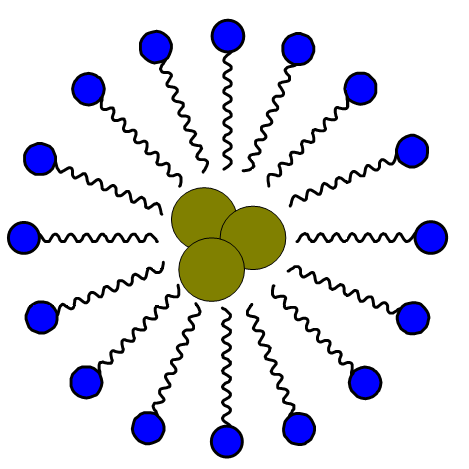
Seebi molekuli tööpõhimõte
Nii kangutab seep mustuse (hüdrofoobset päritolu) pestavalt esemelt lahti ja see uhutakse veega minema. Naturaalseebi üheks puuduseks on tema aluselisus, mistõttu on tänapäeval kasutusel erinevad sünteetilised pesuained ehk detergendid.
Igapäevaselt kasutatavad värvid, liimid ja lakid on polümeerid, mis alguses on vedelad ning kasutamise käigus kõvastuvad. Kui värve ja lakke kasutatakse pindade ilusamaks muutmise või väliskeskkonna mõjude eest kaitsmise eesmärgil, siis liimidega saab erinevaid detaile omavahel ühendada. Komponente, mida on vaja värvide, lakkide või liimide tootmiseks, on palju ja erinevaid, kuid tavaliselt sisaldavad nad mõnda orgaanilist lahustit, mis aurustub kergesti toote kuivamisel. Silmas tuleb pidada, et väga paljud kasutatavad lahustid on tuleohtlikud ja mürgised, millest tulenevalt peab neid sisaldavate toodetega töötamisel olema ruumis tagatud hea õhutus. Lisaks tuleb olla ettevaatlik lahtise tulega ja kindlasti on oluline, et sellised tooted ei satuks pärast kasutamist keskkonda. Seetõttu tuleks kasutamata jäänud värvi-, laki- ja liimijäägid viia kindlasti jäätmejaama. Märksa loodus- ja ka kasutajasõbralikumad on vesialuselised värvid, kuid aina rohkem on levima hakanud ka looduslike värvide, näiteks lubivärvi, linaõlivärvi või munaõlitempera kasutamine.
Ravimid, mida me igapäevaselt kasutame, koosnevad ühest või mitmest sünteetilisel teel toodetud raviainest ning paljudest lisanditest. Lisanditena võib leida ravimi koostisest glükoosi, et ebameeldivalt mõru maitset leevendada, erinevaid värvained, et ravimi väljanägemist atraktiivsemaks muuta või mõningaid muid lisandeid, et parandada näiteks ravimi koospüsimisvõimet. Ravimi kõige tähtsam komponent on aga raviaine, mis tihtipeale on keerulise struktuuriga ning sageli ka laguneb aja jooksul. Seetõttu on ääretult oluline järgida ravimite hoiustamisel ja kasutamisel väga kindlaid tarvitamisjuhiseid.
Taime- või putukatõrjevahendeid kasutatakse ka kodustes tingimustes (kahjurite hävitamiseks toalilledelt), kuid suurtes kogustes leiavad nad rakendust põllumajanduses. Nende ühendite puhul on oluline, et nad kaitseksid taimi haiguste eest või tõrjuksid putukaid, kes taimi kahjustavad, kuid selleks peavad nad erinevatele putukatele, viirus- või seennakkustele mõjuma mürgiselt. Samas peaksid nad pärast haigustekitajate või kahjurite hävitamist kiiresti lagunema, vältimaks ümbritseva keskkonna saastamist. Nende ainete kasutamisel on tähtis silmas pidada, et nad võivad olla mürgised nii inimestele kui ka loodusele ja seetõttu tuleb täita rangelt kasutusjuhiseid ning kanda nõutavaid kaitsevahendeid.
Plastid
Plaste ehk plastmasse leiame igalt poolt meie ümber: erinevad kiled, plastpudelid, plastist mänguasjad või kastid jne. Plastid koosnevad oma põhiosas mõnest polümeerist, kuid sisaldavad veel paljusid teisi aineid, millest kõikidel on täita mingi kindel ülesanne. Lisaks polümeerile sisaldavad plastmassid näiteks plastifikaatorit, mille ülesandeks on vähendada plasti rabedust; täiteaineid, mis parandavad ja kujundavad plasti omadusi ning tihtipeale aitavad vähendada ka kasutatava polümeeri hulka, millest tulenevalt on materjali tootmine odavam. Veel sisaldavad plastid vananemisvastaseid aineid, värvaineid ja muid lisandeid vastavalt sellele, milliste omadustega plaste soovitakse saada. Enamik plastidest toodetakse naftast või maagaasist ehk tegemist on sünteetiliste materjalidega. Need tooted on looduses väga püsivad ning nende lagunemiseks kulub sajandeid, millest tulenevalt reostavad ja kahjustavad nad elusloodust. Ilmselt oled Sa kursis, et hetkel on Euroopa Liidus keelatud ühekordselt kasutatavad plastist taldrikud, joogikõrred, söögiriistad ja muu sarnane. Vähendamaks plastireostust, liigub ühiskond aina enam biolagunevate materjalide arendamise ja tootmise suunas.
Kiudained
Kiudained on polümeerid nagu ka plastmassid. Kiudained on ülitähtsad lõnga ja kangaste tootmisel ning nendest rõivaste valmistamisel. Kiudaineid saab liigitada looduslikeks ja keemilisteks.
Looduslikeks kiudaineteks on nii taimset päritolu puuvilla-, lina- või kanepikiud (koosnevad peamiselt tselluloosist), aga ka loomse päritoluga vill ja siid (valgulist päritolu). Tihtipeale pole looduslikud kiud just eriti tugevad, kuid seevastu on nad nahasõbralikud, kuna oma hüdrofiilsete omaduste tõttu lasevad läbi niiskust ja õhku.
Keemilisi kiudaineid saadakse kas tselluloosi keemilisel töötlemisel või erinevatest naftasaadustest. Sageli on keemilised kiudained tugevamad ja kulumiskindlamad kui loodulikud kuidained ning samuti odavamad. Võrreldes looduslike kiudainetega, lasevad nad aga märksa halvemini läbi veeauru ja õhku, kuna nad on oma omadustelt hüdrofoobsed ja sellest tulenevalt ei ole nad kuigi nahasõbralikud. Samas on tehnoloogia arenenud tänapäeval juba niivõrd palju, et osatakse valmistada väga eriliste omadustega kiudmaterjale, millest valmistatud rõivad on samaaegselt nii vetthülgavad kui ka hingavad, kuid need on tihtipeale oma hinnaklassilt ka märksa kallimad.
8.7. Keskkonnaprobleemid
Inimene mõjutab oma elutegevusega paratamatult ka teda ümbritsevat keskkonda. Maavarade kaevandamine ja metallide tootmine, toidu ja tarbekaupade tootmine ning transport – kõik jätab keskkonnale oma jälje. Kuigi on olemas ka looduslikke protsesse, mis keskkonda saastavad (näiteks vulkaanipursked ja ulatuslikud maastikupõlengud), on peamine keemilise saaste allikas siiski inimtegevus. Millised on olulisemad keskkonnaprobleemid tänapäeva maailmas ja mis neid põhjustab, saadki teada sellest peatükist.
Happesademed
Happesademed on sademed, mille pH on happelisem tavalisest vihmaveest. Tavalise vihmavee pH on umbes 5,6 ning see on põhjustatud õhus olevast süsinikdioksiidist, mis reageerides vihmaveega moodustab nõrga happe: süsihappe.
CO2 + H2O  H2CO3
H2CO3
Happesademete korral võib pH langeda ka alla 5 ühiku.
Happesademed tekivad eelkõige fossiilsete kütuste põletamise tagajärjel. Fossiilsed kütused sisaldavad lisaks süsinikuühenditele ka väävli- ja lämmastikuühendeid. Väävliühendite põlemisel tekib eelkõige vääveldioksiid (SO2) ning lämmastikuühendite oksüdeerumisel tekib mitmeid lämmastikku sisaldavaid oksiide (NO, NO2). Nende oksiidide sattumisel õhku toimub oksiidi ja vee vaheline reaktsioon, mille tulemusena moodustuvad mitmesugused happed (H2SO3, H2SO4, HNO3), mis vihmaveega koos alla sajavad (nt SO2 + H2O → H2SO3).
Happesademed põhjustavad
- taimede (eriti okaspuude) kahjustumist;
- mulla ja veekogude happelisemaks muutumist, mis võib viia liigilise mitmekesisuse kahanemisele;
- ehitiste ja skulptuuride lagunemist, kui need on valmistatud karbonaatsetest kivimitest või marmorist;
- metallide ja nendest valmistatud esemete ja detailide korrosiooni kiirenemist.
Happesademete tekke vähendamiseks proovitakse asendada fossiilkütused alternatiivsete energiaallikate kasutuselevõtuga (päikese- ja tuuleenergia). Samuti rakendatakse mitmeid määrusi ja riikidevahelisi kokkuleppeid heitgaaside ja tehaste tootmistegevuse kontrollimiseks.
Veekogude saastumine
Veekogusid reostavad heitveed (nii olmest kui tööstusest), põllumajanduskemikaalid (väetised, taimekaitse- ja putukatõrjevahendid) ning nafta (nii tootmine kui transport). Keskendume siin väetiste mõjule.
Väetised sisaldavad teatavasti taimedele olulisi toiteelemente (lämmastikku, fosforit, kaaliumit). Kui me aga kasutame põldudel väetisi suuremas koguses, kui on ette nähtud, jõuavad väetusained näiteks sademete veega ka erinevatesse veekogudesse. Seal suurendavad nad veekogude toitainesisaldust, mille tulemusena hakkavad vohama taimed ja vetikad, mis omakorda rikub veekogu liigilist mitmekesisust ja väiksemate veekogude puhul võib lõpuks viia veekogu soostumise ja kinnikasvamiseni. Meres võivad hakata aga vohama sinivetikad, mis on mürgised. Samuti tarbitakse taimejäänuste lagunemisel järjest rohkem vees lahustunud hapnikku ning hapnikuvaegus võib põhjustada vee-elustiku hukkumist.
Kasvuhooneefekt
Kasvuhooneefekti põhjustavad soojuskiirgust neelavad gaasid, mida nimetatakse ka kasvuhoonegaasideks. Need gaasid lasevad läbi Päikeselt Maale liikuvat valguskiirgust, kuid ei lase Maalt tagasipeegeldunud soojuskiirgust endast läbi.
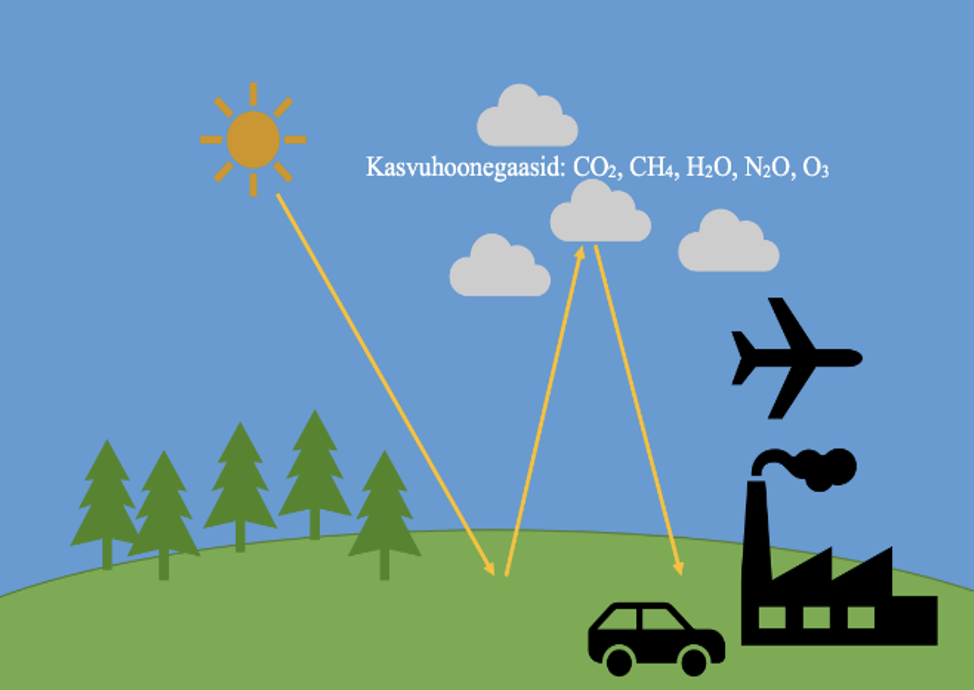
Kasvuhooneefekt
Peamised kasvuhoonegaasid on süsihappegaas (CO2), metaan (CH4) ja veeaur (H2O). Veel loetakse kasvuhoonegaaside hulka dilämmastikoksiidi (N2O) ja osooni (O3).
Süsihappegaasi eraldub atmosfääri fossiilsete kütuste põletamise käigus ning erinevatest tööstusprotsessidest. Süsihappegaasi sisaldust atmosfääris tõstab ka metsade hävitamine, kuna nii väheneb CO2 sidumine fotosünteesi käigus. Väga suur osa metaani eraldub märgaladelt (soodelt), samuti prügilatest ning põllumajandusest.
Mida rohkem satub atmosfääri kasvuhoonegaase, seda rohkem soojeneb nii õhk kui ka kliima. Kliima soojenemine omakorda tingib ühelt poolt kõrbestumist, kuid teiselt poolt ka üleujutusi madalamates piirkondades. Mõlemad nähtused toovad omakorda kaasa suuri probleeme põllumajanduses ja sellest tulenevalt elanikkonna varustamises toiduga. Paljude paikkondade elamiskõlbmatuks muutumine tingib aga ulatusliku rände ja sellest lähtuvad erinevad probleemid ning väljakutsed. Seetõttu püütaksegi saavutada riikide vahel kokkuleppeid CO2 atmosfääri paiskamise vähendamiseks. 2015. aastal sõlmis näiteks Euroopa Liit Pariisi kliimakokkuleppe, mille peamiseks eesmärgiks on hoida ülemaailmne keskmine õhutemperatuuri tõus sellel sajandil alla 2 ºC.
Osoonikihi hõrenemine
Atmosfääri ülakihtides paiknev osoon (O3) on gaas, mis on võimeline neelama Päikeselt tulevat ultraviolettkiirgust (UV-kiirgust), kaitstes nii Maal elavaid organisme UV-kiirguse kahjuliku mõju eest. Teda leidub ülemistes atmosfääri kihtides, umbes 20...30 km kõrgusel maapinnast. Seda ala nimetatakse ka osoonikihiks. Inimtegevuse tagajärjel on aga osoonisisaldus atmosfääri kõrgemates kihtides vähenenud ehk on tekkinud osooniaugud.
Osoonikihi hõrenemise põhisüüdlaseks peetakse freoone (klorofluorosüsinikud, nt CCl2F2 ja CCl3F), mida varem kasutati näiteks külmutusseadmetes ja pihustites, kuid selliste ainete kasutamine keelustati 1987. aastal Montréali protokolliga. Veel lagundavad osoonikihti erinevad lämmastikuühendid, mis enamasti satuvad õhku tööstuse heitgaasidest. Osooniaukude tõttu satub maapinnale rohkem ultraviolettkiirgust, mis kahjustab organisme. Eelkõige seostatakse UV-kiirgust nahavähi sagenemisega.