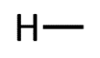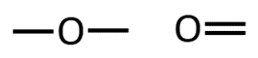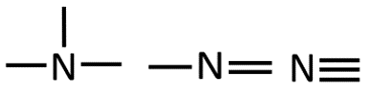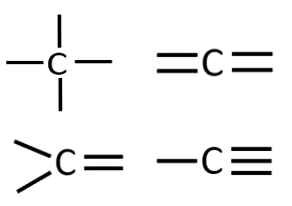7. Süsinik ja süsinikuühendid
Selles teemas tegeled süsinikuühendite maailmaga ehk alustad orgaanilise keemia õppimisega. Kõigepealt tutvud selle maailma keskse elemendi – süsiniku ning tema allotroopidega. Õpid tundma ja üksteisest eristama süsivesinikke, alkohole ja karboksüülhappeid, nende olulisemaid omadusi ning nende aineklasside lihtsamaid esindajaid. Samuti õpid selgeks süsivesinike struktuurivalemite koostamise põhimõtted.
7.1. Süsinik lihtainena
Süsinik on looduses küllaltki levinud element: teda esineb nii ehedalt kui ka ühendite koostises. Süsiniku ühendid kuuluvad kõigi organismide koostisesse ja sellest tulenevalt nimetatakse süsinikuühendeid tihti ka orgaanilisteks ühenditeks. Kuid enne süsiniku ühendite juurde jõudmist tutvume süsiniku kui lihtainega.
Allikas: https://youtu.be/jsMfqaUqGLk
 Süsinik on mittemetalliline element, mis asub perioodilisustabeli IVA rühmas 2. perioodis. Sellest tulenevat paiknevad tema aatomi elektronkattes elektronid kahes kihis, kusjuures välises elektronkihis on neli elektroni, seega saab süsinik moodustada teiste aatomitega neli kovalentset sidet.
Süsinik on mittemetalliline element, mis asub perioodilisustabeli IVA rühmas 2. perioodis. Sellest tulenevat paiknevad tema aatomi elektronkattes elektronid kahes kihis, kusjuures välises elektronkihis on neli elektroni, seega saab süsinik moodustada teiste aatomitega neli kovalentset sidet.
Kaks süsiniku tähtsamat lihtainet on teemant ja grafiit. Neid nimetatakse ka süsiniku allotroopideks. Allotroopia on nähtus, kus üks keemiline element esineb mitme erineva lihtainena.
Teemant
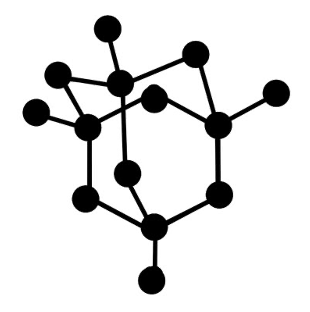 Kuna süsiniku aatom saab moodustada neli sidet, on teemandi kristallvõres iga süsiniku aatom seotud nelja naabersüsiniku aatomiga. Sidemed paigutuvad üksteisest võimalikult kaugele ja süsiniku aatomid on suunatud võrdkülgse tetraeedri tippudesse.
Kuna süsiniku aatom saab moodustada neli sidet, on teemandi kristallvõres iga süsiniku aatom seotud nelja naabersüsiniku aatomiga. Sidemed paigutuvad üksteisest võimalikult kaugele ja süsiniku aatomid on suunatud võrdkülgse tetraeedri tippudesse.
Teemandi omadused on järgmised:
- Kõige kõvem aine, mida looduses leidub. Teemandi kõvadus tuleneb sellest, et süsinikevahelised sidemed on ühesugused tugevad kovalentsed sidemed. Teemandi kõvadust kasutatakse ära lõikamis- ja lihvimistööriistade või puuriotste valmistamisel.
- Ei juhi elektrit, sest tal pole vabu elektrone. Sellest tulenevalt kasutatakse teda kallimates seadmetes isolaatorina.
- Hea soojusjuht ning tänapäeval kasutatakse teda suure võimsusega integreeritud vooluahelates.
- Värvitu ja läbipaistev ning murrab hästi valgust, mistõttu kasutatakse teda kallimates optikaseadmetes.
- Teemandi korrapärasel lihvimisel saadakse briljant, mida kasutatakse ehete valmistamisel.
Grafiit
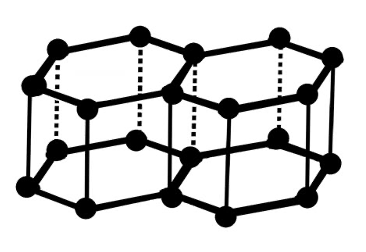 Grafiidi kristallis paiknevad süsiniku aatomid kihtidena. Kihi piires moodustavad süsiniku aatomid korrapäraseid kuusnurki. Kihid on aga omavahel seotud nõrkade jõududega, mistõttu grafiit lõheneb kergesti. Sellest tuleneb grafiidi kasutamine pliiatsisüdamikes ning tahke määrdeainena.
Grafiidi kristallis paiknevad süsiniku aatomid kihtidena. Kihi piires moodustavad süsiniku aatomid korrapäraseid kuusnurki. Kihid on aga omavahel seotud nõrkade jõududega, mistõttu grafiit lõheneb kergesti. Sellest tuleneb grafiidi kasutamine pliiatsisüdamikes ning tahke määrdeainena.
Grafiidi omadused on järgmised:
- Juhib elektrit, kuna sidemetega on seotud ainult kolm väliskihi elektroni neljast ning sellest tulenevalt esineb grafiidis vabu elektrone. Elektrijuhtivuse tõttu kasutatakse grafiiti näiteks patareides (elektroodide valmistamisel).
- Kõrge sulamistemperatuur (lihtainetest kõige kõrgem: ligikaudu 3600ºC). Seetõttu kasutatakse grafiiti tiiglite valmistamiseks, kus saab sulatada kõrge sulamistemperatuuriga metalle.
Teised allotroobid
Ekslikult on peetud süsiniku allotroobiks ka sütt, kuid süsi koosneb peamiselt väikestest grafiidikristallikestest, sisaldades ka mitmesuguseid muid lisandeid. Süsi tekib orgaaniliste ainete kuumutamisel õhu juurdepääsuta. Süsi on väga poorne ja seetõttu on tal võime siduda endasse erinevaid aineid. Kui söe poorid puhastada, saadakse aktiivsüsi, mida kasutatakse näiteks nii seedeorganites kahjulike ainete sidumiseks söetablettidena kui ka söefiltritena õhupuhastites.
Süsiniku huvitavamad lihtained on veel grafeen ja fullereen. Grafeen kujutab endast vaid ühte grafiidikihti. Fullereenid on kerakujulised süsiniku molekulid, kus süsinike aatomite arv algab mitmekümnest. Mõlemaid kasutatakse nanotehnoloogias ning kuna tegemist on orgaanilise materjaliga, käib arendustöö jõudsalt. Grafeeni proovib enda jaoks kasutuskõlblikuks muuta energiatööstus. Grafeen on väga hea elektrijuhtivuse ning läbipaistvusega, mistõttu saab grafeenist teha päikesepatareisid. Hetkel on fullereenide kõige rohkem tähelepanu saav kasutusvaldkond meditsiinis, kuna loodetakse, et fullereenide abil saab antibiootikume siduda kehas olevate vastavate bakterite külge ning nii teha ravi veelgi efektiivsemaks.
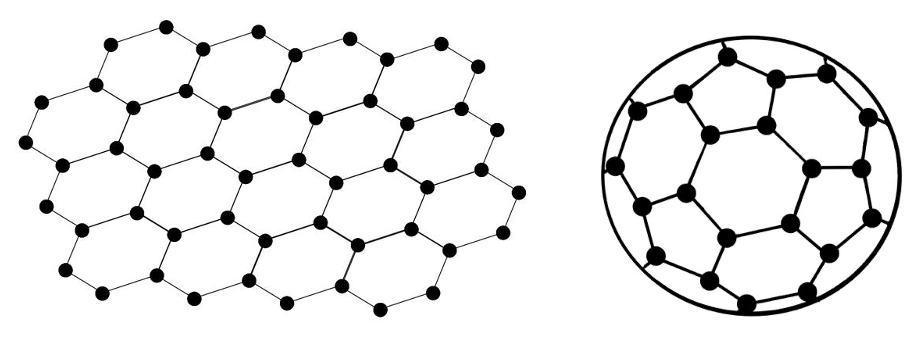
Grafeeni (vasakul) ja fullereeni (paremal) kristallstruktuur. Allikas: https://pubs.rsc.org/en/content/articlelanding/2017/ta/c7ta05387h#!divAbstrac
7.2. Süsiniku oksiidid
Süsinikul on kaks tähtsamat oksiidi: CO ja CO2, mis mõlemad tekivad süsinikuühendite põlemisel ja on laialdaselt kasutatavad tööstuses. Oma koostiselt võivad nad tunduda küll sarnased, kuid omadustelt on vägagi erinevad ained. Süsiniku oksiididest annab ülevaate järgnev video.
Allikas: https://youtu.be/qDae-Iay4Oo
Süsinikoksiid
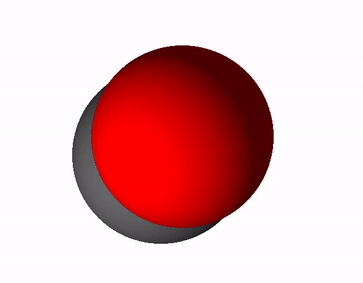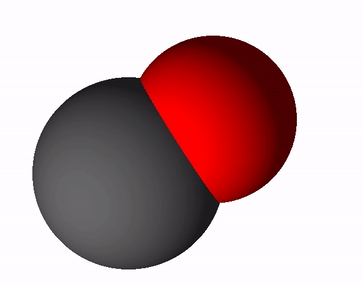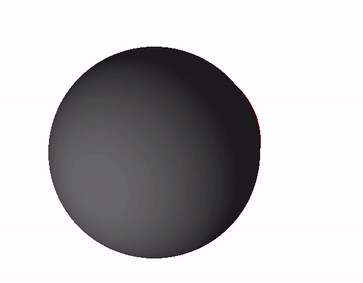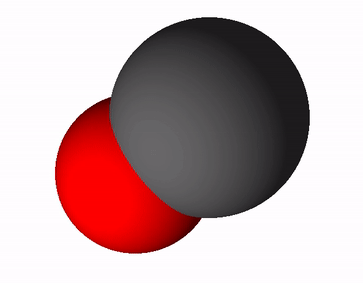 Süsinikoksiidi valem on CO ja rahvapäraselt kutsutakse teda vingugaasiks. Süsinikoksiid tekib süsiniku ja süsinikuühendite mittetäielikul põlemisel, see tähendab, et põlemisprotsessis ei jätku piisavalt hapnikku. Mittetäieliku põlemise võrrand on selline:
Süsinikoksiidi valem on CO ja rahvapäraselt kutsutakse teda vingugaasiks. Süsinikoksiid tekib süsiniku ja süsinikuühendite mittetäielikul põlemisel, see tähendab, et põlemisprotsessis ei jätku piisavalt hapnikku. Mittetäieliku põlemise võrrand on selline:
2C+ O2 → 2CO
Oma omadustelt on süsinikoksiid värvitu, lõhnatu, eluohtlikult mürgine gaas. Vingugaasi mürgisus seisneb selles, et sissehingamisel seostub CO veres oleva hemoglobiiniga. Tavapäraselt seostub hemoglobiiniga hapnik, kuid kuna süsinikoksiidi seostumine on eelistatud, ei saa hemoglobiin hapnikku siduda ning sellest tulenevalt ei kanna veri mööda keha laiali mitte hapnikku vaid vingugaasi ja selle tagajärjel organism lõpuks lämbubki.
Süsinikoksiid on vees vähe lahustuv õhuga sarnase tihedusega gaas. Õhu tihedus on umbes 1,23 kg/m3 ning süsinikoksiidi oma 1,14 kg/m3. Gaaside kogumise juures õppisime selgeks nipi, kuidas hinnata, kas gaas on õhust tihedam või hõredam. Õhu molekulmassiks loetaks 29, Mr(CO) = 12 + 16 = 30, seega saamegi öelda, et vingugaas on õhuga sarnase tihedusega.
Kuna süsinikoksiidis on süsiniku oksüdatsiooniaste II, saab ta edasi oksüdeeruda. CO oksüdeerub kahes erinevas protsessis:
-
põlemisel: 2CO + O2 → 2CO2
Selle tõttu, et ta põleb, kasutatakse teda küttegaaside koostises. -
reageerides metallioksiididega: Fe2O3 + 3CO → 2Fe + 3CO2
Antud reaktsioonivõrrand kirjeldab raua tootmist rauamaagist ja ka selles protsessis leiab süsinikoksiid laialdast kasutust.
Süsinikdioksiid
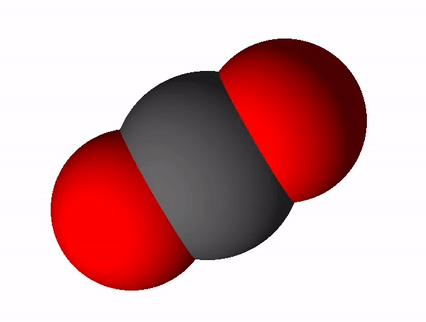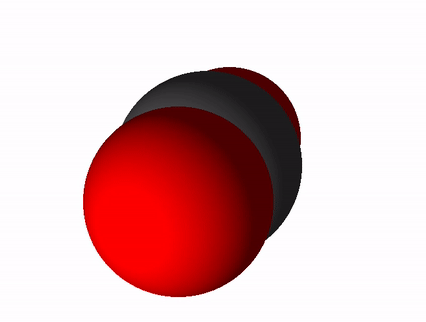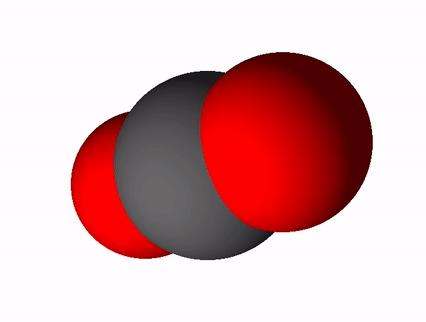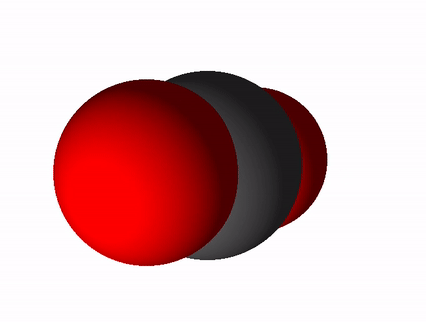 Süsinikdioksiidi valem on CO2 ja tema rahvapärane nimetus süsihappegaas. Süsinikdioksiid tekib süsiniku ja süsinikuühendite täielikul põlemisel. Täieliku põlemise saame võrrandi abil üles kirjutada nii:
Süsinikdioksiidi valem on CO2 ja tema rahvapärane nimetus süsihappegaas. Süsinikdioksiid tekib süsiniku ja süsinikuühendite täielikul põlemisel. Täieliku põlemise saame võrrandi abil üles kirjutada nii:
C + O2 → CO2
Süsihappegaasi tekib ka kõdunemisprotsessidel ja hingamisel. Maa atmosfääris leidub umbes 0,04% süsinikdioksiidi ning selles koguses ei ole süsinikdioksiid inimorganismile kahjulik, kuid suuremates kogustes (üle 1%) põhjustab süsihappegaas uimasust. Seda võib täheldada ruumides, kus on pikemat aega koos palju inimesi, aga ventilatsioon on puudulik või aknad suletud. Kui süsihappegaasi kogus õhus küündib juba 7–10% lähedale, on see eluohtlik.
Süsihappegaas on värvitu, kergelt hapuka lõhnaga gaas. Tema lahustuvus vees on keskmine ja ta on õhuga võrreldes umbes 1,5 korda suurema tihedusega gaas. Süsihappegaasi tihedus on 1,98 kg/m3 ning molekulmass Mr(CO2) = 12 + 16$\times $2 = 44. Madalamatel temperatuuridel muutub süsihappegaas tahkeks jääsarnaseks nn kuivaks jääks, mida kasutatakse toiduainete jahutamisel.
Süsinikdioksiid on happeline oksiid, mis reageerides veega moodustab nõrga ja ebapüsiva happe – süsihappe:
CO2 + H2O  H2CO3
H2CO3
Süsinikdioksiidis on süsiniku oksüdatsiooniaste IV, mis on süsiniku jaoks maksimaalne. Sellest tulenevalt süsinikdioksiid ei põle ega toeta põlemist ning leiab kasutust tulekustutites. Veel kasutatakse süsihappegaasi toiduainetetööstuses (jookide gaseerimisel, happesuse regulaatorina, toiduainete säilitamisel).
7.3. Süsivesinikud
Sa tead juba, et orgaanilise keemia kõige olulisemaks elemendiks on süsinik. Süsinikul võib olla neli ühekordset sidet. Kui need sidemed on vesiniku aatomitega, saame metaani, mis on kõige lihtsam süsivesinik. Sõna süsivesinik vihjab juba väga palju selle aineklassi olemuse kohta. Süsivesinikud on ained, mis koosnevad ainult süsinikust ja vesinikust. Süsivesinike kirevat maailma avab järgnev video.
Allikas: https://youtu.be/V_erkTqjKEg
Struktuurivalemid
Orgaanilisel keemial on täiesti oma keel. Selle jaoks, et seda keelt paremini mõista, vaata läbi järgnev video.
Allikas: https://youtu.be/aAu-nDbRUOM
Struktuurivalemeid saab liigitada järgmiselt: tasapinnaline ehk klassikaline struktuurivalem, lihtsustatud struktuurivalem ja summaarne struktuurivalem. Tasapinnaline ja lihtsustatud struktuurivalem väljendavad molekuli ehitust ehk näitavad ära, millised aatomid on omavahel keemiliste sidemetega seotud ja millises järjekorras. Tasapinnalise struktuurivalemi korral on välja joonistatud kõik keemilised sidemed.
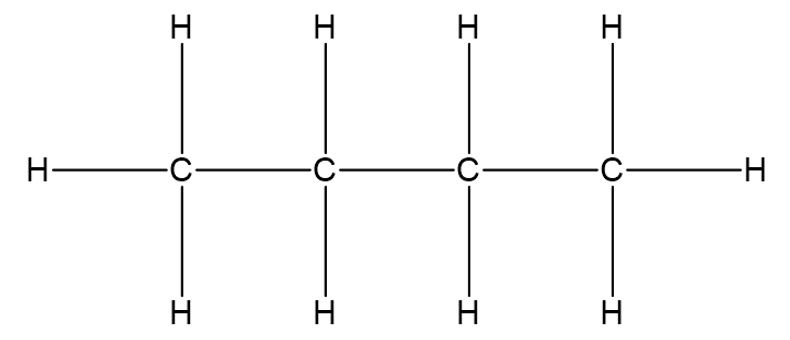
Tasapinnaline struktuurivalem
Lihtsustatud struktuurivalemi korral jäetakse süsiniku ja vesinike vahelised sidemed märkimata ning tuuakse ära vaid süsinike omavahelised keemilised sidemed.
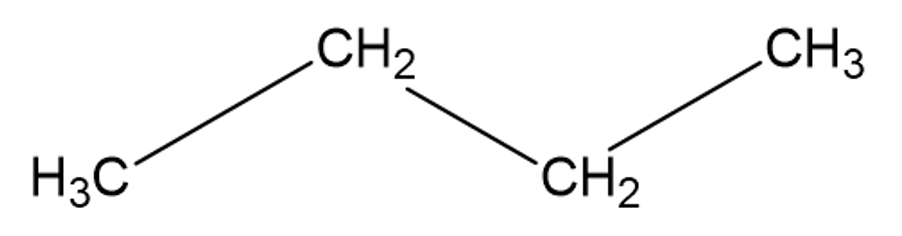
Lihtsustatud struktuurivalem
Summaarne valem ehk molekulvalem iseloomustab elemendilist koostist. Summaarse valemi korral liidetakse kokku kõik sama elemendi aatomid ning näidatakse indeksiga, mitu neid on. Näiteks eespool toodud aine summaarne valem on: C4H10.
Molekuli ehitust saab kirjeldada veel molekulmudelite abil. Molekulmudelid iseloomustavad aatomite ruumilist paiknemist molekulis.
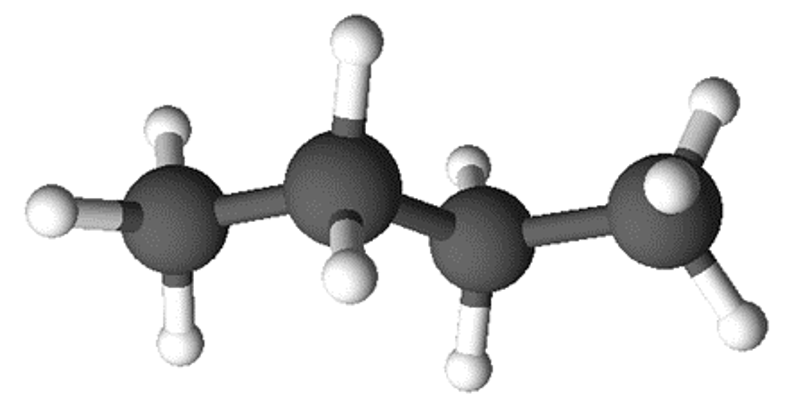
Molekulmudel
Süsinikuühendeid on äärmiselt palju, kuna süsiniku aatomid saavad moodustada väga erineva paigutusega ahelaid. Süsinikahela moodustavad üksteisega kovalentsete sidemete abil seotud süsiniku aatomid. Süsinikahel võib olla hargnemata ehk lineaarne, hargnenud või tsükliline. Lineaarse ahela puhul on süsiniku aatomid üksteisega järjestikku seotud.

Lineaarne ahel
Hargnenud ahela korral moodustub ühest või mõnest süsinikust kõrvalahel ehk hargnevus.
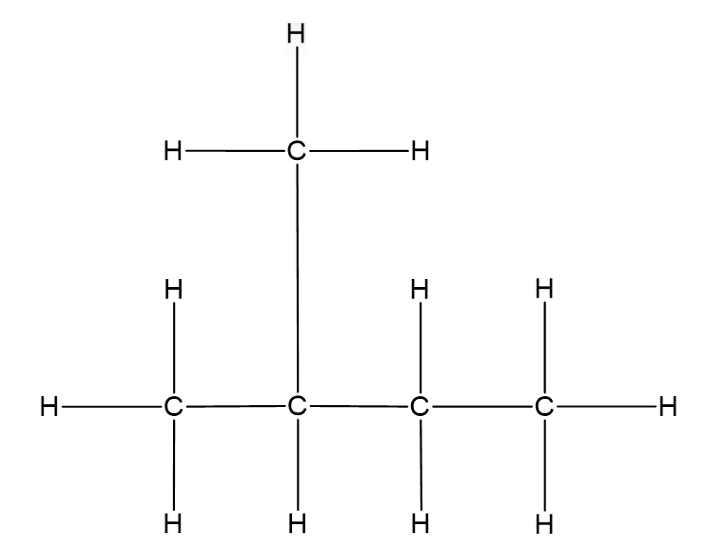
Hargnenud ahel
Tsüklilise ahela korral moodustub süsiniku aatomitest suletud kujund.
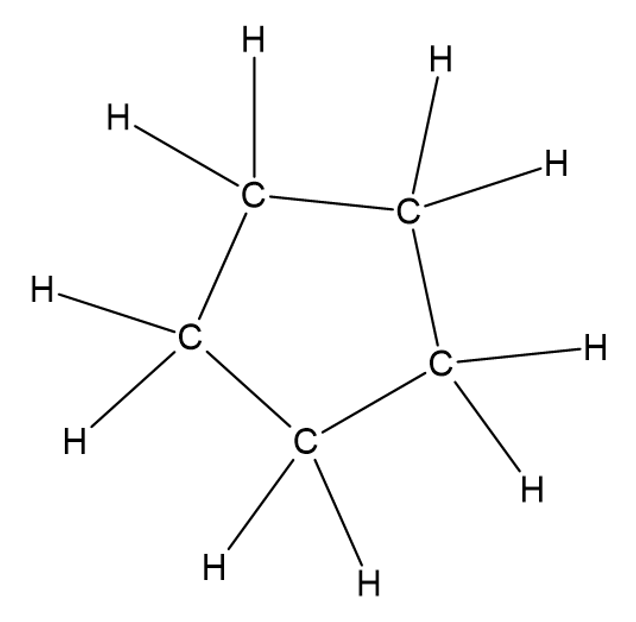
Tsükliline ahel
Orgaanilises keemias puutud Sa kokku peamiselt 4 erineva elemendiga: süsinik, vesinik, hapnik ja lämmastik. Selle jaoks, et osata koostada nimetatud aatomitest koosnevaid struktuurivalemeid, pead silmas pidama vastava elemendi aatomi sidemete arvu ja paigutamise võimalusi orgaaniliste ainete molekulides. Need võimalused on toodud järgnevas tabelis.
|
Elemendi sümbol |
Sidemete arv |
Võimalikud |
|
H |
1 |
|
|
O |
2 |
|
|
N |
3 |
|
|
C |
4 |
|
Süsivesinike omadused ja kasutusalad
Kõige lihtsam ja ka igapäevaelus üks kasutatavamaid süsivesinikke on metaan (CH4). Nagu Sa juba tead, koosneb metaan ühest süsiniku aatomist ja neljast vesiniku aatomist ning on tetraeedrilise ehitusega.
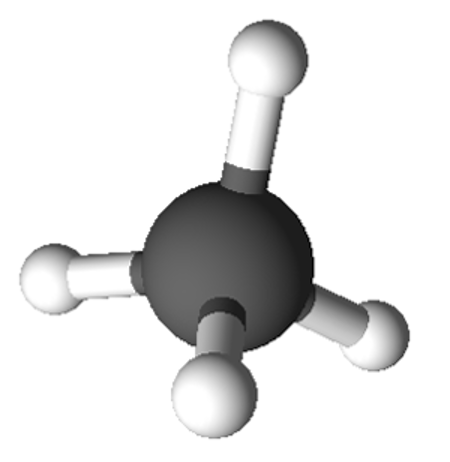
Metaani molekulmudel
Metaan on värvusetu, lõhnatu, õhust väiksema tihedusega gaas. Metaan on maagaasi peamine koostisosa ning teda kasutatakse nii tööstuses kui ka kodumajapidamistes küttegaasina. Looduses tekib metaan orgaaniliste ainete lagunemisel.
Süsivesinikke on palju ning ühiseid omadusi on raske välja tuua, küll aga kehtivad teatavad seaduspärasused. Näiteks mida suurem on süsivesiniku molekul ehk mida pikem on süsinikahel, seda kõrgem on aine sulamis- ja keemistemperatuur. Sellest tulenevalt on väiksema süsinikahelaga (1...4 süsiniku aatomit) süsivesinikud toatemperatuuril gaasilises olekus. Lisaks metaanile kasutatakse propaani ja butaani segu majapidamisgaasina ning ka balloonigaasina, näiteks matkapliitides või välgumihklites sisalduvate gaasidena. Keskmise süsinikahelaga (5...17 süsiniku aatomit) süsivesinikud on toatemperatuuril vedelas olekus. Vedelad süsivesinikud on iseloomuliku lõhnaga ning kergesti süttivad, neid leidub naftas ning naftatoodetes, näiteks bensiinis. Pikema süsinikahelaga süsivesinikud on toatemperatuuril tahkes olekus. Nad on vahajad, enamasti värvuseta või kergelt valkja alatooniga tahked ained. Igapäevaelus kõige lihtsam tahke süsivesinik on küünlavaha koostises olev parafiin.
Süsivesinikud on hüdrofoobsed ained. Hüdrofoobsed ained ei oma vastastiktoimet veega ning nad on vett-tõrjuvad. Hüdrofoobsed ained ei märgu vee toimel, vaid moodustavad vee pinnale sfäärilisi tilkasid, samuti ei lahustu nad vees. Hüdrofoobseteks aineteks on erinevad vahad, rasvad, aga ka süsivesinikud. Hüdrofiilsed ained seevastu omavad tugevat vastastiktoimet veega ning on veesõbralikud. Need ained märguvad vee toimel ning sageli nad ka lahustuvad vees. Hüdrofiilsed on näiteks sool, puit, etanool.
Süsivesinike põlemine
Süsivesinikke kasutatakse enamasti kütustena ning seetõttu on nende üheks kõige olulisemaks omaduseks põlemine. Põlemine on oksüdatsiooniprotsess, millega kaasneb intensiivne soojuse eraldumine. Põlemise jaoks on vaja hapnikku ning vastavalt hapniku juurdepääsule saab põlemist liigitada täielikuks põlemiseks ja mittetäielikuks põlemiseks. Süsivesinike täielikul põlemisel (kui hapnikku on piisavalt) tekivad süsinikdioksiid ehk süsihappegaas ja vesi. Süsivesinike mittetäielikul põlemisel (kui hapnikku ei ole piisavalt) tekivad süsinikoksiid ehk vingugaas ja vesi. Mittetäieliku põlemise korral tekib ka tahma ehk süsinikku.
Põlemisreaktsioonide korral on oluline silmas pidada
- põlemine on reaktsioon hapnikuga (O2);
- reaktsioonivõrrandi lihtsamaks tasakaalustamiseks on mõttekas kasutada süsivesinike summaarseid valemeid;
- kui reaktsiooni kirjelduses pole teisiti öeldud, eelda, et tegemist on täieliku põlemisega ehk tekivad CO2 ja H2O;
- reaktsioonivõrrandi tasakaalustamisel võib olla hapniku ees murdarvuline kordaja.
Näide 1. Kirjutame metaani täieliku põlemise võrrandi.
1) Kirjutame lähteainete ja saaduste valemid.
CH4 + O2 → CO2 + H2O
2) Tasakaalustame võrrandi.
Lähteainetes on üks süsiniku aatom ja saadustes ka üks süsiniku aatom, seega on süsinike aatomite arv tasakaalus. Lähteainetes on neli vesiniku aatomit ning saadustes 2 vesiniku aatomit, järelikult tuleb vee molekuli ette kirjutada kordaja 2, et vesiniku aatomid saaksid tasakaalu:
CH4 + O2 → CO2 + 2H2O
Edasi tuleb tegeleda hapniku aatomitega. Saaduste poolel on 4 hapniku aatomit ning seega tuleb lähteainete poole saada ka neli hapniku aatomit ehk hapniku molekuli ette tuleb kirjutada kordaja 2.
CH4 + 2O2 → CO2 + H2O
Näide 2. Kirjutame butaani täieliku põlemise võrrandi.
1) Kirjutame lähteainete ja saaduste valemid.
C4H10 + O2 → CO2 + H2O
2) Tasakaalustame võrrandi.
Lähteainetes on neli süsiniku aatomit ja saadustes üks süsiniku aatom, seega tuleb süsihappegaasi ette kordaja 4.
C4H10 + O2 → 4CO2 + H2O
Lähteainetes on 10 vesiniku aatomit ning saadustes 2 vesiniku aatomit, järelikult tuleb vee molekuli ette kirjutada kordaja 5, et vesiniku aatomid saaksid tasakaalu.
C4H10 + O2 → 4CO2 + 5H2O
Edasi tuleb tegeleda hapniku aatomitega. Saaduste poolel on 8 + 5 = 13 hapniku aatomit ning seega tuleb lähteainete poole saada ka 13 hapniku aatomit ehk hapniku molekuli ette tuleb kirjutada kordaja 13 : 2 = 6,5.
C4H10 + 6,5O2 → 4CO2 + 5H2O
7.4. Struktuurivalemid
7.4. Alkoholid
Hakkame tegelema teise ühendite klassiga orgaanilise keemia valdkonnast. Süsivesinikud on Sul juba selged ja nii ongi väga lihtne minna süsivesinikelt üle alkoholidele. Ülevaate alkoholidest annab Sulle järgmine video.
Allikas: https://youtu.be/wFFLjzf8SSA
Alkoholide mõiste, struktuur ja nimetamine
Alkoholid on süsivesinikest tuletatud ühendid, kus üks või mitu vesiniku aatomit on asendatud hüdroksüülrühmaga (-OH).
Kui võtta näiteks kõige lihtsam süsivesinik - metaan (CH4) ja asendada tema molekulis üks vesiniku aatom hüdroksüülrühmaga, siis saamegi vastava alkoholi:
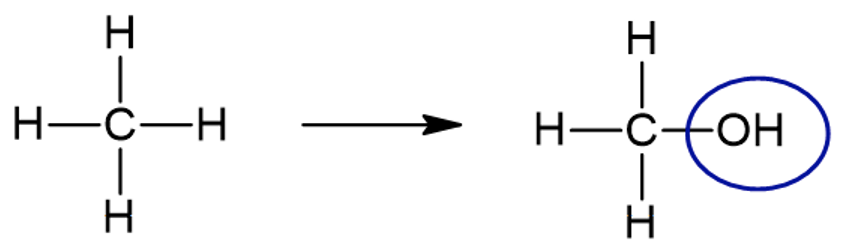
Metaanist saab metanool
Alkoholide nimetamisel lähtutakse süsivesinike nimetustest, lisades süsivesiniku nimetusele lõppliite -ool. Näiteks: propaan → propanool.
Alkoholide korral on samuti võimalik koostada nende tasapinnalisi, lihtsustatud ja summaarseid valemeid. Näiteks butanooli (4 C aatomit sisaldav alkohol) tasapinnaline struktuurivalem on järgmine:
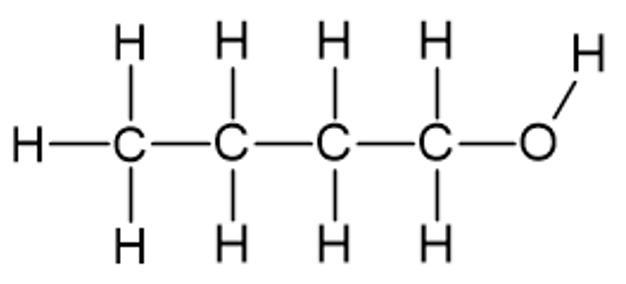
Butanool
lihtsustatud struktuurivalem selline: CH3-CH2-CH2-CH2OH
ja summaarne struktuurivalem C4H10O.
Etanool
Alkoholide kõige tuntum esindaja on etanool (CH3CH2OH), mille rahvapärane nimetus on piiritus.
Etanooli molekulmudel
Etanool on iseloomuliku maitse ja lõhnaga vedelik, mis seguneb veega igas vahekorras ning segunemist põhjustab etanooli hüdrofiilsus. Etanooli vesilahus on neutraalne (pH=7).
Etanool põleb ning tema täieliku põlemise käigus moodustuvad süsihappegaas ja vesi.
C2H5OH + 3O2 → 2CO2 + 3H2O
Etanooli saadakse protsessi käigus, mida nimetatakse alkoholkäärimiseks. Alkoholkäärimine leiab aset nii õlle kui ka veini valmistamisel, kus pärmseened muudavad lisatud suhkru etanooliks ja süsihappegaasiks:
C6H12O6 → 2CH3CH2OH + 2CO2
suhkur etanool süsihappegaas
Oluline on siinkohal meeles pidada, et kogu protsess peab toimuma hapnikuvabas keskkonnas, kuna vastasel korral ei teki mitte etanool vaid orgaaniline hape, mida rahvasuus nimetatakse äädikhappeks. Veini valmistamisel saavad pärmseened vajaliku suhkru (glükoosi) marjade või puuviljade mahlast. Ajalooliselt on Eestis valmistatud etanooli ka kartulitest ja teraviljast, kuid sel juhul on protsess natukene pikem, kuna kõigepealt lagundatakse tärklis glükoosiks ning alles seejärel toimub alkoholkäärimine.
Etanooli kasutatakse kütusena. Näiteks koolis keemiatundides katsete tegemisel kasutatavates piirituslampides on põlevaks aineks just nimelt piiritus. Ladina-Ameerika riikides kasutatakse etanooli ka mootorikütusena, kuna selle tootmine suhkruroost on niivõrd odav. Samuti kasutatakse etanooli lahustina nii koolikeemias, meditsiinis (desinfitseerivad vahendid), kosmeetikatööstuses kui ka värvide lahustamisel. Peamine etanooli kasutusvaldkond on siiski alkohoolsete jookide tootmine.
Alkoholi füsioloogiline toime
Alkohoolsete jookide tarvitamine kahjustab suurel määral inimese organismi. Väga tugevalt mõjutab etanool kesknärvisüsteemi, mis omakorda tingib kõrvalekaldeid kogu organismi töös: koordinatsioon ja liigutuste täpsus halvenevad, reaktsioonikiirus aeglustub, ilmneda võivad olukorrale mittevastavad käitumisviisid ja kõneprobleemid. Samuti kahjustab alkohol mitmeid organeid (magu, maks, süda). Suured alkoholikogused võivad viia teadvuse kaotuse ja alkoholimürgistuseni ning lõppeda ka surmaga. Kuna alkohol põhjustab sõltuvust, kujuneb pikaaegsel alkoholitarbimisel välja alkoholism. Isiklike terviseprobleemide kõrval mõjutab liigne alkoholitarbimine ka ühiskonda, põhjustades kuritegevuse kasvu, õnnetuste (tule-, vee- ja liiklusõnnetused) sagenemist ja sotsiaal- ning tervisevaldkonna kulutuste tõusu (abirahad, haigushüvitised jne).
7.5. Karboksüülhapped
Igapäevaselt oled Sa endale seda teadvustamata kokku puutunud nii mõnegi karboksüülhapete aineklassi kuuluva ühendiga: söögiäädikaga köögis kokates, piimhappega keefiris, sidrunhappega sidruniga teed nautides või oblikhappega rabarbereid või jänesekapsaid süües. Mida aga karboksüülhapped endast täpsemalt kujutavad, sellest saad ülevaate videost.
Allikas: https://youtu.be/GWiNuLIFDuk
Karboksüülhapete mõiste, struktuur ja nimetamine
Karboksüülhapped on orgaanilised ühendid, mis sisaldavad oma struktuuris karboksüülrühma (-COOH).
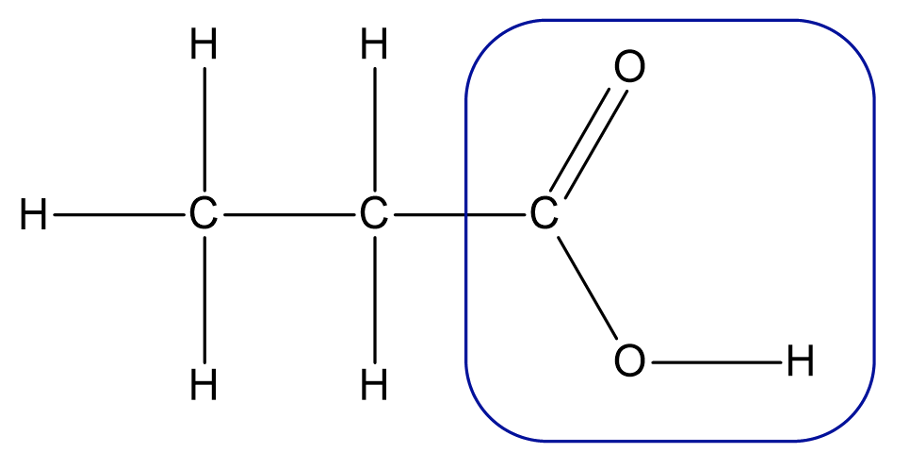
Karboksüülrühm karboksüülhappes
Karboksüülrühm on alati seotud süsinikahela otsmise süsinikuga ja neid võib olla molekulis ainult üks, nagu on näiteks etaan- ehk äädikhappes
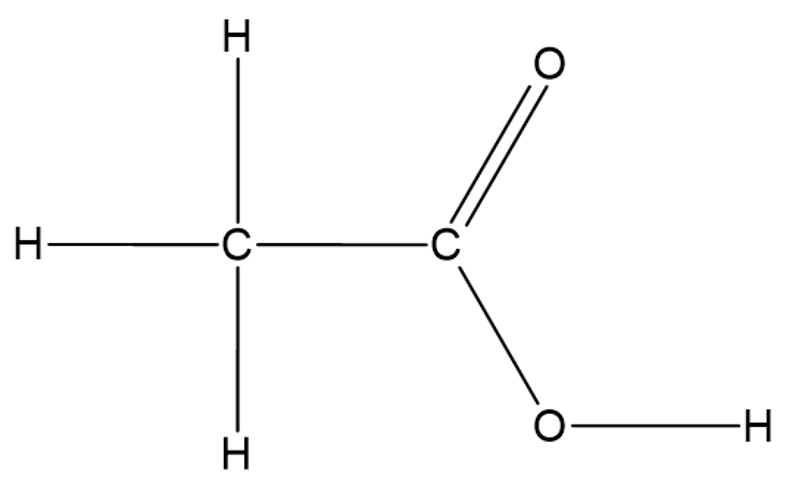
Etaanhape ehk äädikape
või mitu, nagu näiteks etaandihappes ehk oblikhappes
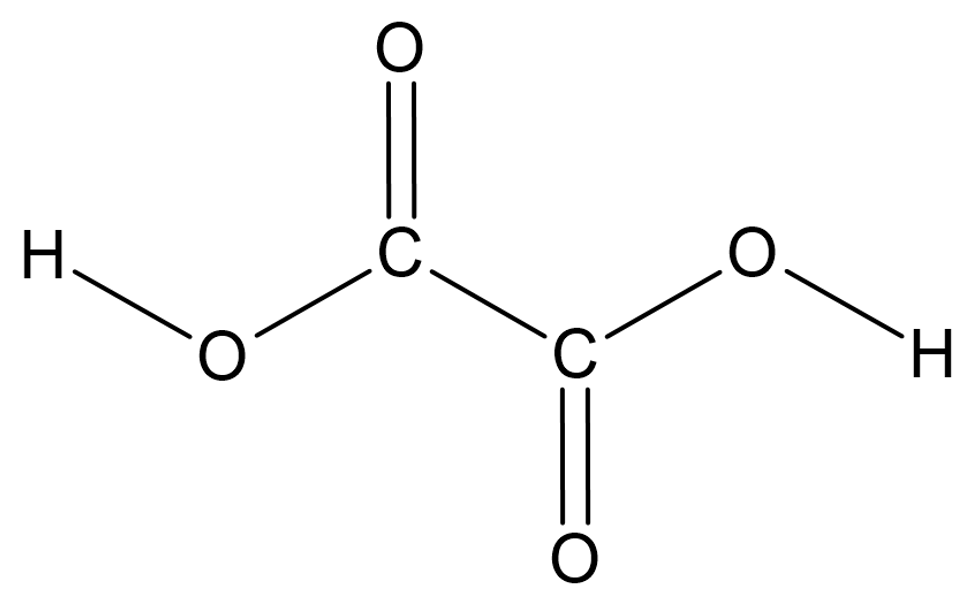
Etaandihape ehk oblikhape
Karboksüülhapete korral on samuti võimalik koostada nende tasapinnalisi, lihtsustatud ja summaarseid valemeid. Näiteks butaanhappe (sisaldab 4 C aatomit) tasapinnaline struktuurivalem on selline:
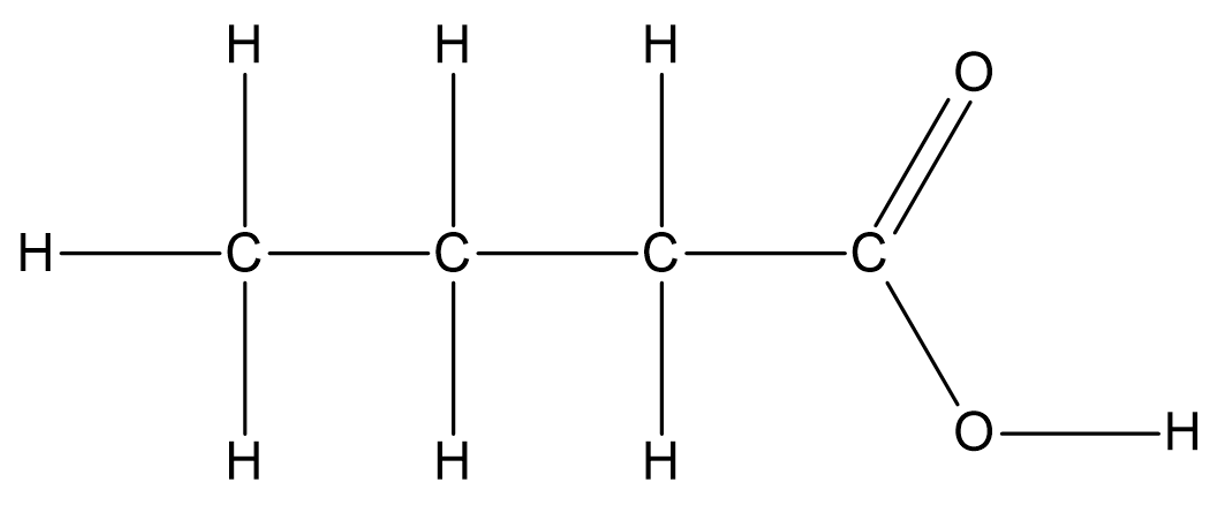
Butaanhape
lihtsustatud struktuurivalem on CH3-CH2-CH2-COOH
ja summaarne struktuurivalem C4H8O2.
Karboksüülhapete nimetamisel lähtutakse vastava süsinike aatomite arvuga süsivesinike nimetusest, lisades sellele lõppliite -hape.
Näiteks: metaan → metaanhape, propaan → propaanhape.
Karboksüülhapete happelisus ja keemilised omadused
Anorgaanilises keemias oled Sa juba õppinud, et happed on ained, mis annavad vesilahusesse vesinikioone ehk prootoneid (H+). Karboksüülhapped annavad samuti vesilahusesse vesinikioone ning on oluline meeles pidada, et karboksüülhapete korral asub happeline vesinik karboksüülrühmas. Näiteks etaanhape jaguneb vees etaanhappe happejääkiooniks ja vesinikiooniks:
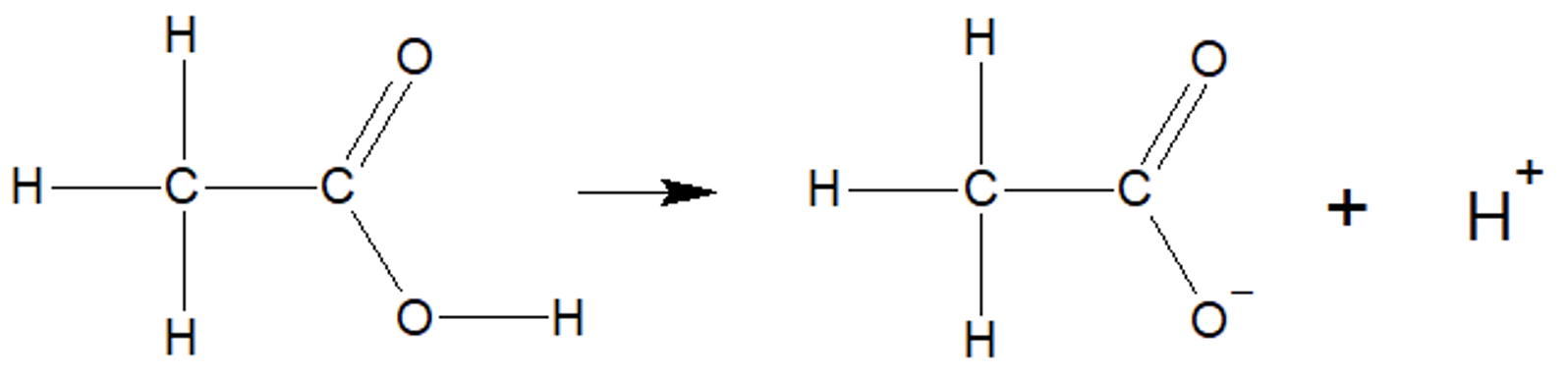
Etaanhappe jagunemine vees etaanhappe happejääkiooniks ja vesinikiooniks
Kuigi karboksüülhapped annavad vesilahusesse vesinikioone ja neil on olemas kõik hapetele iseloomulikud omadused, on nad nõrgad happed.
Karboksüülhapped reageerivad alustega, aluseliste oksiididega ning aktiivsete ja keskmise aktiivsusega metallidega.
KARBOKSÜÜLHAPE + ALUS → SOOL + H2O
1. Karboksüülhappe reaktsioonil alustega tekivad sool ja vesi.
CH3CH2COOH + NaOH → CH3CH2COONa + H2O
2CH3COOH + Ca(OH)2 → (CH3COO)2Ca + 2H2O
See reaktsioon toimub alati ning seda nimetatakse ka neutralisatsioonireaktsiooniks.
KARBOKSÜÜLHAPE + ALUSELINE OKSIID → SOOL + H2O
2. Karboksüülhappe reaktsioonil aluseliste oksiididega tekivad sool ja vesi.
2CH3CH2COOH + CaO → (CH3CH2COO)2Ca + H2O
2CH3COOH + Na2O → 2CH3COONa + H2O
See reaktsioon toimub samuti alati.
KARBOKSÜÜLHAPE + METALL → SOOL + H2↑
3. Karboksüülhape reaktsioonil aktiivsete ja keskmise aktiivsusega metallidega tekivad sool ja vesinik.
2CH3CH2COOH + Zn → (CH3CH2COO)2Zn + H2↑
2CH3COOH + 2Na → 2CH3COONa + H2↑
See reaktsioon ei toimu alati – täpselt nagu anorgaaniliste hapetega, reageerivad ka karboksüülhapetega ainult vesinikust aktiivsemad metallid ehk need metallid, mis asuvad metallide elektrokeemilises aktiivsusreas vesinikust vasakul ehk vesinikust eespool.

Tähtsamad karboksüülhapped
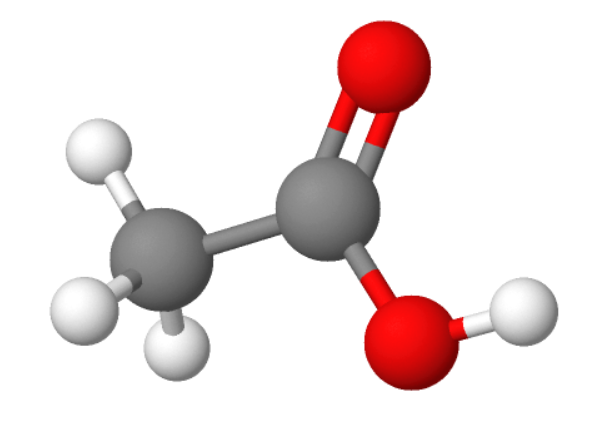 1. Metaanhape ehk sipelghape HCOOH
1. Metaanhape ehk sipelghape HCOOH
Metaanhape on terava lõhna ja maitsega, söövitav hape. Metaanhapet leidub sipelgate eritistes, nõgese kõrvekarvakestes ning vähesel määral ka kuuse- ja männiokastes.
Metaanhapet kasutatakse tekstiili- ja nahatööstuses, konservandina silo tegemisel ja desinfitseerimisvahendina toiduainetetööstuses.
2. Etaanhape ehk äädikhape CH3COOH
Kõige tuntum karboksüülhape igapäevaelus. Etaanhape on terava lõhna ja maitsega, vees hästi lahustuv ning kange lahuse korral söövitav vedelik.
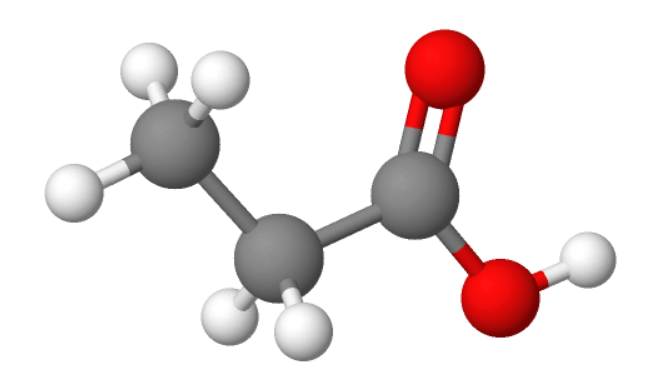 Puhast (99%-list) etaanhapet nimetatakse jää-äädikhappeks, sest alla 16 ºC moodustuvad vedeliku sisse jääsarnased kristallid.
Puhast (99%-list) etaanhapet nimetatakse jää-äädikhappeks, sest alla 16 ºC moodustuvad vedeliku sisse jääsarnased kristallid.
Etaanhapet kasutatakse konservandina (nt seente või kurkide marineerimisel), samuti maitseainena (nt süldi kõrvale). Keemiatööstus kasutab etaanhapet lahustina. Igapäevaelus kasutatakse äädikhapet kõige rohkem katlakivi eemaldamiseks või küpsetiste kergitamiseks koos soodaga.
3. Piimhape CH3CH(OH)COOH
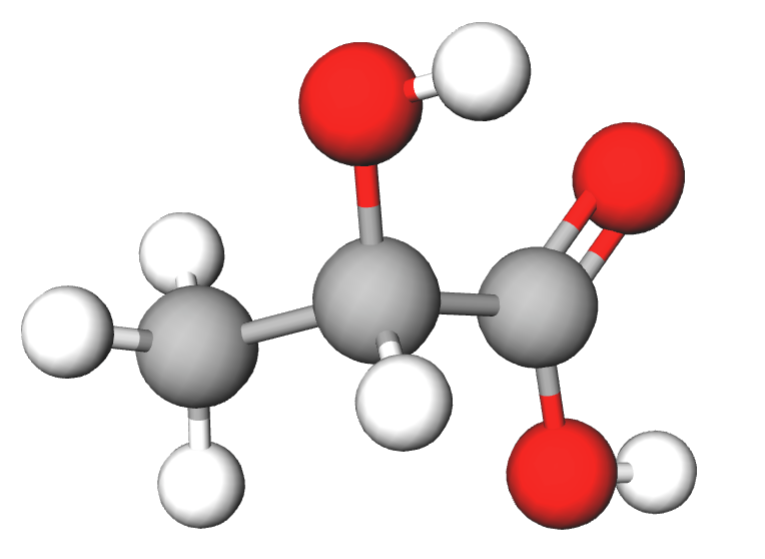 Piimhape tekib piimas oleva suhkru käärimisel piimhappebakterite juuresolekul.
Piimhape tekib piimas oleva suhkru käärimisel piimhappebakterite juuresolekul.
Piimhapet leidub hapupiimas, keefiris ja teistes hapendatud piimatoodetes. Piimhape tekib ka kurkide, kapsaste ja juustu käärimisel hapniku juuresolekuta. Sportlane teab piimhappe mõju lihastele väga hästi: piimhape tekib lihastes veresuhkru lagunemisel ilma hapnikuta ja põhjustab valutunnet pärast pikaajalist intensiivset lihastreeningut.