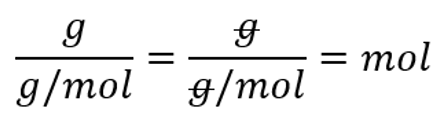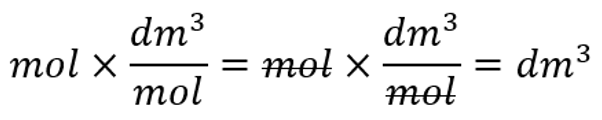6. Moolarvutused
Mool on keemikute jaoks väga oluline suurus. Selle teema läbimisel saad teada, mis on mool ning kuidas on ta seotud aineosakeste arvu, aine massi ning aine ruumalaga. Samuti õpid lahendama moolidega seotud arvutusülesandeid reaktsioonivõrrandite põhjal.
6.1. Aine hulk, mool
Oma igapäevaelus oled ilmselt harjunud mõõtma asju grammides ja kilogrammides või mõõtma pikkust meetrites ja kilomeetrites. Keemias räägitakse aga ainete osakeste arvust ehk ainehulgast, mida väljendavad ka keemilise reaktsiooni võrrandid. Ainehulk väljendab seal sisalduvate aineosakeste arvu. Mis on mool ning kuidas teha arvutusi ainehulga ja Avogadro arvuga, saad vaadata järgmisest videost.
Mis on ainehulk?
Ainehulk on aine kogus moolides.
$n=\frac{N}{N_{A}}$
n - ainehulk (ühik mol)
N - aineosakeste arv (ühik aineosake)
NA - Avogadro arv
(6,02 × 1023 aineosakest/mol)
Vaatame ühte keemilist reaktsiooni, kus hapniku ja vesiniku ühinemisel tekib vesi. Saame kirja panna järgneva reaktsioonivõrrandi:
2H2 + O2 → 2H2O
Sellest reaktsioonivõrrandist järeldub, et kahe vesiniku molekuli ja ühe hapniku molekuli omavahelisel reageerimisel tekib kaks molekuli vett. Tegelikus elus on aga aineosakesi, mis omavahel reageerivad, väga palju rohkem ning seetõttu kasutatakse aine hulga ühikuna mooli. Ainehulk on aine kogus moolides, tähis n. Ühes moolis on 6,02 ×1023 osakest. Osake võib olla nii molekul, aatom kui ka ioon.
Jäta meelde, et
1 mol = 1000 mmol
1 kmol = 1000 mol
Ainehulk on avaldatav osakeste arvu ja Avogadro arvu kaudu: $n=\frac{N}{N_{A}}$, kus n tähistab ainehulka (ühik mool, lühend mol), N aineosakeste arvu (ühik aineosake) ning NA on Avogadro arv, mille väärtus on 6,02 $\times $ 1023 aineosakest/mol.
Analoogiliselt meetri, kilomeetri ja millimeetri teisendustega on võimalik ka mooli teisendada kilomooliks ja millimooliks.
Ülesanne 1
Teisenda ühikud.
Kuidas loendada aatomeid?
Kui võtame näiteks taaskord vee molekuli H2O, siis ühes moolis vees on 2 vesiniku aatomit ja 1 hapniku aatom. Kuna mool on hulga loendamise ühik, siis ühes moolis vees on 2 mooli vesiniku aatomeid ja 1 mool hapniku aatomeid. Võttes aga 2 mooli vett, kahekordistub ka aatomite arv. Seega kahes moolis vees on 4 mooli vesiniku aatomeid ja 2 mooli hapniku aatomeid. Kümnes moolis vees oleks 20 mooli vesiniku aatomeid ja 10 mooli hapniku aatomeid.
Arvutusülesannete lihtsamaks lahendamiseks võid eeskujuks võtta järgnevad sammud:
- Loe ülesande tekst mõttega läbi.
- Jooni tekstis alla kõik arvud.
- Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel.
- Kirjuta välja andmed ning otsitav suurus.
- Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus.
- Asenda valemitesse arvud ning teosta arvutused.
Ole valmis, et mõnikord tuleb ühikuid teisendada.
Teeme koos läbi kaks näidisülesannet.
Näidisülesanne 1. Aine hulga leidmine
| 1. Loe ülesande tekst mõttega läbi. | Mitu mooli on 2$\times $1023 süsiniku aatomit? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Mitu mooli on 2$\times $1023 süsiniku aatomit? |
| 3. Omista arvule kindel füüsikaline suurus. | 2$\times $1023 süsiniku aatomit näitab osakeste arvu. |
| 4. Kirjuta välja andmed. Samuti on alati teada Avogadro arv. Otsitav suurus on hetkel moolide arv, järelikult n = ? |
N = 2$\times $1023 aatomit NA= 6,02$\times $1023 aatomit/mol |
| 5. Kirjuta välja valemid. Kuna antud juhul on vajalik ainehulk, siis valemist mõnda muud suurust avaldama ei pea. | $n=\frac{N}{N_{A}}$ |
| 6. Asenda arvud ja teosta arvutused. |
$n=\frac{N}{N_{A}}=\frac{2\times10^{23}\,aatomit}{6,02\times10^{23}\,aatomit/mol}\approx 0,3322\, mol=0,33\,mol$
Ülesanne 3
Näidisülesanne 2. Osakeste arvu leidmine
| 1. Loe ülesande tekst mõttega läbi. | Mitu aatomit on 6 moolis naatriumis? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Mitu aatomit on 6 moolis naatriumis? |
| 3. Omista arvule kindel füüsikaline suurus. | 6 mol näitab ainehulka. |
| 4. Kirjuta välja andmed. Samuti on alati teada Avogadro arv. Otsitav suurus on hetkel aatomite arv, järelikult N = ? |
n = 6 mol NA = 6,02$\times $1023 aatomit/mol |
| 5. Kirjuta välja valemid. |
Kuna antud juhul on vajalik aatomite ehk osakeste arv, siis tuleb valemist avaldada N: N = n $\times $ NA |
| 6. Asenda arvud ja teosta arvutused. | N = n $\times $ NA = 6 mol $\times $ 6,02$\times $1023 aatomit/mol = 3,612$\times $1024 aatomit |
Ülesanne 4
6.2. Molaarmass ja selle seos massiga
Mool on küll keemikute seas väga laialt kasutatav ühik, aga otseselt ei saa kasutada ühtegi mõõteriista moolide mõõtmiseks. Samuti ei osta Sa tavapäraselt lahtiseid komme mitte moolides vaid grammides. Selleks, et aine hulgalt üle minna aine massile, kasutatakse molaarmassi. Milline on mooli ja massi seos ning kuidas leida molaarmassi ning molaarmassi kaudu aine massi, saad vaadata järgmisest videost.
Allikas: https://youtu.be/g1s_JY9rcJs
Molaarmass on ühe mooli aineosakeste mass.
Molaarmassi tähiseks on M ning keemias kõige kasutatavamaks molaarmassi ühikuks g/mol. Selleks, et leida konkreetse ühendi molaarmassi, tuleb liita aine koostises olevate elementide ümardatud aatommassid. Sealjuures tuleb arvestada ka aatomite arvusid ühendis.
Näide 1. Arvuta vee molaarmass.
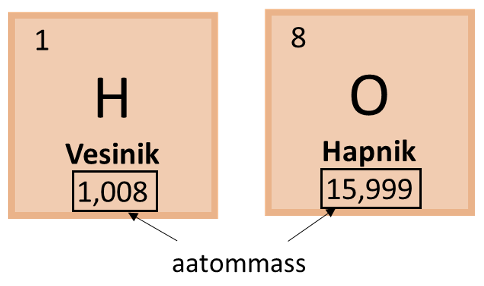 Vee keemiline valem on H2O. Molaarmassi leidmiseks kasutame perioodilisustabelis toodud aatommasse, kuid ümardame need täisarvuks. Vesiniku aatommass on 1,008 ehk ümardatuna täisarvuks 1 ning hapniku aatommass on 15,999 ehk ümardatuna täisarvuks 16. Kuna vee molekulis on 2 vesiniku aatomit, tuleb seda ka arvutuskäigu puhul jälgida ning vee molaarmassi leidmiseks oleks arvutuskäik järgmine:
Vee keemiline valem on H2O. Molaarmassi leidmiseks kasutame perioodilisustabelis toodud aatommasse, kuid ümardame need täisarvuks. Vesiniku aatommass on 1,008 ehk ümardatuna täisarvuks 1 ning hapniku aatommass on 15,999 ehk ümardatuna täisarvuks 16. Kuna vee molekulis on 2 vesiniku aatomit, tuleb seda ka arvutuskäigu puhul jälgida ning vee molaarmassi leidmiseks oleks arvutuskäik järgmine:
M(H2O) = 2 $\times $1 + 16 = 18 g/mol
Järgnevalt on välja toodud veel mõningate ühendite molaarmassid koos arvutuskäiguga. Kontrolli, kas said sama tulemuse.
M(K) = 39 g/mol
M(Al2O3) = 2 $\times $ 27 + 3 $\times $16 = 102 g/mol
M(H2SO3) = 2 $\times $ 1 + 32 + 3 $\times $ 16 = 82 g/mol
M(NaCl) = 23 + 35,5 = 58,5 g/mol
Nagu viimasest näitest selgub, on ka aatommasside ümardamisel erandid. Jäta meelde, et kloori aatommassi väärtus on 35,5 ning vase oma 63,5.
Vali õige molaarmass.Ülesanne 1
Molaarmassi seos ainehulgaga
$n=\frac{m}{M}$
n - ainehulk (ühik mol)
m - aine mass (ühik g)
M - molaarmass (ühik g/mol)
Molaarmassi kasutades on võimalik arvutada aine hulka või massi. Ainehulk on avaldatav kui $n=\frac{m}{M}$
kus n tähistab ainehulka (ühik mool, lühend mol), m aine massi (ühik gramm) ning M on molaarmass (ühik g/mol).
Arvutusülesannete lahendamise käiguga oled Sa juba tuttav, kuid kordame selle üle.
Arvutusülesannete lihtsamaks lahendamiseks võid eeskujuks võtta järgnevad sammud:
- Loe ülesande tekst mõttega läbi.
- Jooni tekstis alla kõik arvud.
- Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel.
- Kirjuta välja andmed ning otsitav suurus.
- Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus.
- Asenda valemitesse arvud ning teosta arvutused.
Ole valmis, et mõnikord tuleb ühikuid teisendada.
Teeme koos läbi kaks ülesannet.
Näidisülesanne 1. Ainehulga leidmine
| 1. Loe ülesande tekst mõttega läbi. | Mitu mooli on 9,3 grammis naatriumoksiidis? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Mitu mooli on 9,3 grammis naatriumoksiidis? |
|
3. Omista arvule kindel füüsikaline suurus. |
9,3 grammi näitab aine massi. |
| 4. Kirjuta välja andmed. |
m = 9,3 g Samuti on hetkel teada, et aineks on naatriumoksiid, mille valem on Na2O. Igale ainele, mille valemit Sa tead, saab leida molaarmassi. M(Na2O) = 2 $\times $ 23 + 16 = 62 g/mol Otsitav suurus on hetkel moolide arv, järelikult n = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{m}{M}$ Kuna antud juhul on vajalik ainehulk, siis valemist mõnda teist suurust avaldama ei pea. |
| 6. Asendame arvud ja teostame arvutused. | $n=\frac{m}{M}=\frac{9,3\ g}{62\ g/mol}=0,15\ mol$ |
Ülesanne 2
Leia ainehulk.
Näidisülesanne 2. Aine massi leidmine
| 1. Loe ülesande tekst mõttega läbi. | Arvuta 3 mol kaaliumnitraadi mass. |
| 2. Jooni alla kõik arvud, mis on tekstis. | Arvuta 3 mol kaaliumnitraadi mass. |
| 3. Omista arvule kindel füüsikaline suurus. | 3 mol näitab ainehulka. |
| 4. Kirjuta välja andmed. |
n = 3 mol Samuti on hetkel teada, et aineks on kaaliumnitraat, mille valem on KNO3. Igale ainele, mille valemit Sa tead, saab leida molaarmassi. M(KNO3) = 39 + 14 + 3 $\times $ 16 = 101 g/mol Otsitav suurus on hetkel mass, järelikult m = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{m}{M}$ Kuna antud juhul on vajalik mass, siis mass avaldub: m = n $\times $ M |
| 6. Asenda arvud ja teosta arvutused. |
m = 3 mol $\times $ 101 g/mol = 303 g Ka ühikutega saad siin sama tehte teha mol × g/mol, moolid taanduvad maha ning alles jääb massi ühik g. |
Ülesanne 3
6.3. Gaasi molaarruumala
Vedelike või tahkete ainete massi on mugav mõõta kaalumise teel. Gaasiliste ainete massi leidmine on aga küllaltki keeruline protseduur. Palju lihtsam on mõõta gaasiliste ainete ruumala ehk mahtu. Gaasilise aine hulga ja ruumala seob omavahel molaarruumala.
Molaarruumala on ühe mooli aineosakeste ruumala. Molaarruumala tähis on Vm ja ühik dm3/mol.
Eri gaasid sisaldavad ühesugustel tingimustel võrdse ruumala korral võrdse arvu molekule. Sellest tulenevalt on eri gaaside molaarruumalad ühesugustel tingimustel võrdsed. Normaaltingimustel on kõikide gaaside molaarruumala 22,4 dm3/mol. Kuidas molaarruumala leida ning seda erinevates arvutustes kasutada, saad vaadata videost.
Allikas: https://youtu.be/taWb_GV6NXM
Ainehulk on avaldatav ruumalade kaudu, kui $n=\frac{V}{V_{m}}$
Molaarruumala kasutades on võimalik arvutada gaasilise aine hulka või ruumala. Ainehulk on avaldatav ruumala kaudu, kui
$n=\frac{V}{V_{m}}$,
kus n on ainehulga tähis (ühik mool, lühend mol), V on aine ruumala (ühik dm3) ning Vm on molaarruumala (väärtus 22,4 dm3/mol).
Ülesanne 1
Normaaltingimustel on temperatuur 0ºC ja rõhk 1 atm.
Gaaside ruumala arvutamise korral, tuleb alati arvestada temperatuuri ja rõhku. Seetõttu kasutatakse keemias tihti väljendit normaaltingimused (lühendina nt).
Arvutusülesannete lahendamise käiguga oled Sa juba tuttav, kuid kordame selle üle.
Arvutusülesannete lihtsamaks lahendamiseks võid eeskujuks võtta järgnevad sammud:
- Loe ülesande tekst mõttega läbi.
- Jooni tekstis alla kõik arvud.
- Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel.
- Kirjuta välja andmed ning otsitav suurus.
- Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus.
- Asenda valemitesse arvud ning teosta arvutused.
Ole valmis, et mõnikord tuleb ühikuid teisendada.
Teeme koos läbi kolm ülesannet.
Näidisülesanne 1. Ainehulga leidmine
| 1. Loe ülesande tekst mõttega läbi. | Mitu mooli on 60 dm3 hapnikku (nt.)? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Mitu mooli on 60 dm3 hapnikku (nt.)? |
| 3. Omista arvule kindel füüsikaline suurus. | 60 dm3 näitab aine ruumala. |
| 4. Kirjuta välja andmed. |
V = 60 dm3 Samuti on teada gaasi molaarruumala. Vm = 22,4 dm3/mol Otsitav suurus on hetkel moolide arv, järelikult n = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{V}{V_{m}}$ Kuna antud juhul on vajalik leida ainehulk, siis valemist mõnda teist suurust avaldama ei pea. |
| 6. Asendame arvud ja teostame arvutused. | $n=\frac{V}{V_{m}}=\frac{60\ dm^{3}}{22,4\ dm^{3}/mol}\approx 2,7\ mol$ |
Ülesanne 2
Leia ainehulk.
Näidisülesanne 2. Aine ruumala leidmine
| 1. Loe ülesande tekst mõttega läbi. | Arvuta 8 mol süsihappegaasi ruumala. |
| 2. Jooni alla kõik arvud, mis on tekstis. | Arvuta 8 mol süsihappegaasi ruumala. |
| 3. Omista arvule kindel füüsikaline suurus. |
8 mol näitab ainehulka. |
| 4. Kirjuta välja andmed. |
n = 8 mol Samuti on teada gaasi molaarruumala. Vm = 22,4 dm3/mol Otsitav suurus on hetkel ruumala, järelikult V = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{V}{V_{m}}$ Kuna antud juhul on vajalik ruumala, siis see avaldub: V = n $\times $ Vm |
| 6. Asenda arvud ja teosta arvutused. | V = 8 mol $\times $ 22,4 dm3/mol = 179,2 dm3 |
Ülesanne 3
Näidisülesanne 3. Aine ruumala leidmine aine massi kaudu
| 1. Loe ülesande tekst mõttega läbi. | Kui suur ruumala on 23 grammil vesinikul (nt)? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Kui suur ruumala on 23 grammil vesinikul (nt)? |
| 3. Omista arvule kindel füüsikaline suurus. | 23 g on aine mass. |
| 4. Kirjuta välja andmed. |
m = 23g Samuti on teada gaasi molaarruumala. Vm = 22,4 dm3/mol Otsitav suurus on hetkel ruumala, järelikult V = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{V}{V_{m}}$ Kuna antud juhul on vajalik ruumala, siis see avaldub: V = n $\times $ Vm Ruumala leidmise valemis on ainehulk, mille saad leida valemist: $n=\frac{m}{M}$ Aine molaarmassi saad arvutada aatommasside kaudu, võttes appi perioodilisuse tabeli. |
| 6. Asenda arvud ja teosta arvutused. |
M(H2)=2 g/mol $n=\frac{m}{M} = \frac{23\ g}{2\ \frac{g}{mol}}=11,5\ mol$ V = n $\times $ Vm= 11,5 mol $\times $ 22,4 dm3/mol=257,6 dm3 Kontrolliks või ülesande läbi teha ka ühikutega. Ainehulga puhul pead vastuse saama moolides:
Ruumala arvutades peaksid vastuse saama ruumala ühikutes (cm3, dm3, m3):
|
Ülesanne 4
Vihjed:
Süsinikdioksiid ja süsinikoksiidi korral saad gaasi ruumala arvutada sama skeemi alusel. Aine massist arvuta ainehulk: $n=\frac{m}{M}$. Edasi saad leida gaasi ruumala: V = n$\times $Vm. Seejärel võrdle, kumma aine ruumala tuli suurem. Gaasi ruumala kaudu arvuta aine moolide arv $n=\frac{V}{V_{m}}$. Seejärel arvuta aine mass, m = n$\times $M. Jälgi ühikuid!
6.4. Arvutused reaktsioonivõrrandi põhjal
Keemias tuleb sageli teha arvutusi reaktsioonivõrrandite põhjal. Selleks tuleks eelnevalt kirjutada rekatsioonivõrrand ja see ka tasakaalustada. Reaktsioonivõrrandis olevad kordajad näitavad reageerivate ja tekkivate ainete hulka moolides. Kuidas reaktsioonivõrrandi kordajaid arvutustes kasutada ning milliseid arvutusi reaktsioonivõrrandi alusel võib teha, saad vaadata järgmisest videost.
Allikas: https://youtu.be/m-orM45x_iw
Reaktsioonivõrrandi kordajad väljendavad reageerivate ainete hulkade suhet moolides.
Selleks, et teha arvutusi reaktsioonivõrrandite põhjal, tuleb kõigepealt aru saada, et reaktsioonivõrrandi kordajad väljendavad reageerivate ainete hulkade suhet moolides.
Võttes aluseks lihtsa keemilise reaktsiooni, kus hapniku ja vesiniku ühinemisel tekib vesi, saame kirja panna järgneva reaktsioonivõrrandi:
2H2 + O2 → 2H2O
See reaktsioonivõrrand näitab, et kaks mooli vesinikku reageerib ühe mooli hapnikuga ning tekib kaks mooli vett. Oletame, et meil on vaja saada aga 10 mooli vett. Tasakaalus reaktsioonivõrrandi kohaselt on meil aga kaks mooli vett. Selleks, et saada 10 mooli vett, tuleb võtta viiekordne kogus aineid. Seega saame öelda, et 10 mooli vee saamiseks on vaja:
vesinikku 5 $\times $ 2 mol = 10 mol
hapnikku 5 $\times $ 1 mol = 5 mol
Arvutusülesannete lihtsamaks lahendamiseks võid juhinduda järgnevatest sammudest:
- Loe ülesande tekst mõttega läbi ning pane paika lähteained ja saadused.
- Kirjuta tekstile vastav reaktsioonivõrrand ning tasakaalusta see.
- Kirjuta välja andmed ja otsitav.
- Lähteainete mass või ruumala tuleb ümber arvutada moolideks.
- Kasutades moolsuhet (reaktsioonivõrrandi kordajaid) leia otsitava aine hulk moolides.
- Vajadusel arvuta otsitava aine moolid ümber massiks või ruumalaks.
Tuleta varasemast meelde ka järgmised valemid, mida arvutustes võib vaja minna. Ainehulga leidmise valemid:
$n=\frac{m}{M}$
n - ainehulga tähis (ühik mool, lühend mol)
m - aine massi (ühik gramm)
M - molaarmass (ühik g/mol).
$n=\frac{N}{N_{A}}$
n - ainehulga tähis (ühik mool, lühend mol)
N - aineosakeste arv (ühik aineosakene)
NA - Avogadro arv, mille väärtus on 6,02 ×1023 aineosakest/mol.
$n=\frac{V}{V_{m}}$
n - ainehulga tähis (ühik mool, lühend mol)
V - aine ruumala (ühik dm3)
Vm - molaarruumala (väärtus 22,4 dm3/mol)
Näidisülesanne 1. Moolilt moolile üleminek
| 1. Loeme teksti läbi ning paneme kirja lähteained, milleks hetkel on vesinik ja hapnik. | Mitu mooli hapniku kulub reageerimiseks 12 mol vesinikuga? |
| 2. Kirjutame ja tasakaalustame tekstile vastava reaktsioonivõrrandi. | 2H2 + O2 → 2H2O |
| 3. Kirjutame välja andmed ja otsitava. |
n(H2) = 12 mol n(O2) = ? |
| 4. Antud hetkel on vaja leida ühe aine moolid teise aine moolide järgi. Seega ei pea üle minema ei massile ega ruumalale, vaid lihtsalt arvestama moolsuhet. |
Tasakaalustatud reaktsioonivõrrandist on näha, et H2 ja O2 moolsuhe on 2:1. Kirjutame välja järgneva seose: 2 – 1 12 mol – x mol |
| 5. Avaldame hapniku moolid. |
$n(O_{2})=\frac{12\ mol\times 1}{2}= 6\ mol$ Kui Sa ei soovi seost välja kirjutada, võid ka mõelda, et vesinikku on hetkel 2 korda rohkem kui hapniku, järelikult peab olema hapniku 2 korda vähem võrreldes vesinikuga ning sellest tulenevalt saad arvutada n(O2) = 12 mol / 2 = 6 mol |
Näidisülesanne 2. Moolilt massile üleminek
| 1. Loeme teksti läbi ning paneme kirja, et nii vesinik kui ka hapnik on hetkel lähteained ning tekib vesi. | Mitu grammi vett tekib, kui hapnik reageerib 2 mol vesinikuga? |
| 2. Kirjutame ja tasakaalustame tekstile vastava reaktsioonivõrrandi. | 2H2 + O2 → 2H2O |
| 3. Kirjutame välja andmed ja otsitava. |
n(H2) = 2 mol m(H2O) = ? |
| 4. Antud hetkel on vaja leida ühe aine mass teise aine moolide järgi. Seega tuleb kõigepealt leida vee moolid, arvestades moolsuhet. | Tasakaalustatud reaktsioonivõrrandist on näha, et H2 ja H2O moolsuhe on 2:2 ehk moolide arvud on võrdsed. Sellest saame järeldada, et ka n(H2O) = 2 mol. |
|
5. Meie käest küsiti aga vee massi. Moolid ja massid sidus järgnev valem: |
$n=\frac{m}{M}$ |
| 6. Avaldame valemist massi. | m = n $\times $ M |
| 7. Leiame H2O molaarmassi. | M(H2O) = 2 $\times $ 1 + 16 = 18 g/mol |
| 8. Leiame H2O massi. | m = n $\times $ M = 2 mol $\times $ 18 g/mol = 36 g |
Näidisülesanne 3. Moolilt ruumalale üleminek
| 1. Loeme teksti läbi ning paneme kirja, et nii vesinik kui ka hapnik on hetkel lähteained. |
Mitu kuupdetsimeetrit hapnikku reageerib 3 mol vesinikuga? |
| 2. Kirjutame ja tasakaalustame tekstile vastava reaktsioonivõrrandi. | 2H2 + O2 → 2H2O |
|
3. Kirjutame välja andmed ja otsitava. |
n(H2) = 3 mol V(O2) = ? |
| 4. Antud hetkel on vaja leida ühe aine ruumala teise aine moolide järgi. Seega tuleb kõigepealt leida hapniku moolid, arvestades moolsuhet. | Tasakaalustatud reaktsioonivõrrandist on näha, et H2 ja O2 moolsuhe on 2:1 ehk hapniku on 2 korda vähem. Sellest saame järeldada, et n(O2) = 3 mol / 2 = 1,5 mol. |
| 5. Meie käest küsiti aga hapniku ruumala. Moolid ja ruumala sidus järgnev valem: | $n=\frac{V}{V_{m}}$ |
| 6. Avaldame valemist ruumala. | V = n $\times $ Vm |
| 7. Leiame hapnikku ruumala. | V = n $\times $ Vm = 1,5 mol $\times $ 22,4 dm3/mol = 33,6 dm3 |
Näidisülesanne 4. Massilt ruumalale üleminek
| 1. Loeme teksti läbi ning paneme kirja, et nii vesinik kui ka hapnik on hetkel lähteained. | Mitu kuupdetsimeetrit hapnikku reageerib 6 grammi vesinikuga? |
| 2. Kirjutame ja tasakaalustame tekstile vastava reaktsioonivõrrandi. | 2H2 + O2 → 2H2O |
| 3. Kirjutame välja andmed ja otsitava. |
m(H2) = 6 g V(O2) = ? |
| 4. Siinkohal tuleb meeles pidada, et moolide hulk seob reaktsioonivõrrandis kahte ainet omavahel. |
Seega tuleb kõigepealt leida moolide arv ainele, mille kohta algandmetes on infot. Kuna vesiniku mass on antud, saab leida ka vesiniku moolide arvu, kasutades valemit: $n=\frac{m}{M}$ M(H2) = 2 $\times $ 1 = 2 g/mol $n(H_{2})=\frac{6\ g}{2\ g/mol}= 3\ mol$ |
| 5. Kui me teame vesiniku moolide arvu, saame leida ka hapniku moolide arvu. |
Tasakaalustatud reaktsioonivõrrandist on näha, et H2 ja O2 moolsuhe on 2:1 ehk hapniku on 2 korda vähem. Sellest saame järeldada, et n(O2) = 3 mol / 2 = 1,5 mol. |
| 6. Meie käest küsiti aga hapniku ruumala. | Moolid ja ruumala sidus järgnev valem: $n=\frac{V}{V_{m}}$ |
| 7. Avaldame valemist ruumala. | V = n $\times $ Vm |
| 8. Leiame hapniku ruumala. | V = n $\times $ Vm = 1,5 mol $\times $ 22,4 dm3/mol = 33,6 dm3 |