5. Metallid
Metallid ümbritsevad meid kõikjal ning nendest valmistatakse nii konstruktsioonidetaile, ehteid kui ka tarbeesemeid. Selles peatükis tutvud metallide oluliste omaduste ning kasutusvaldkondadega. Saad teada, miks hävivad metallid keskkonna toimel ja kuidas toimub redoksreaktsioon. Samuti oskad pärast selle peatüki läbimist selgitada, millest sõltub keemilise reaktsiooni kiirus.
5.1. Metallide omadused
Oma igapäevaelus puutud Sa kokku väga paljude metallidega, näiteks hõbedast ja kullast valmistatakse ehteid, rauast erinevaid konstruktsioonidetaile, vasest elektrijuhtmeid. Metallide üldiseloomustuse leiad järgnevast videost.
Allikas: https://youtu.be/Bei8q6d46RE
Metallid on keemilised elemendid, millel on metallilised omadused.
Metallide füüsikaliste omadustega (kõvadus, tugevus, plastilisus, metalne läige, tihedus, hea elektri- ja soojusjuhtivus) oled Sa juba tuttav. Samuti tead, et metallide lihtainetes esineb metalliline side, mis hoiab metalli kristallivõret koos. Olulised metallide füüsikalised omadused (elektri- ja soojusjuhtivus, plastilisus) ongi tingitud just metallilisest sidemest. Metalliline side tekib metallikristallis paiknevate positiivsete ioonide ja ioonide vahel liikuvate ühiste elektronide vastastikusel tõmbumisel.

Metallide kasutamine igapäevaelus lähtub just suuresti nende füüsikalistest omadustest, aga kindlasti tuleb arvestada ka keemiliste omadustega. Kuidas reageerivad metallid lihtainetega ja hapetega ning millest nende reaktsioonivõime sõltub, selle kordamegi nüüd üle.
Allikas: https://youtu.be/xLBQO2PDpoM
Metallide keemilised omadused
Metallid reageerivad teiste ainetega erineva kiirusega, seda aitab iseloomustada metallide aktiivsusrida. Üldjoontes saab jagada aktiivsusreas paiknevad metallid kolmeks: aktiivsed metallid, keskmise aktiivsusega metallid ja väheaktiivsed metallid, mis asuvad vesinikust paremal.

Aktiivsete metallide hulka kuuluvad leelismetallid (IA rühma metallid) ja leelismuldmetallid (IIA rühma (alates Ca-st) metallid). Mg on metall, mis on aktiivsete ja keskmise aktiivsusega metallide piiril. Keskmise aktiivsusega on metallid, mida kindlasti kohtame igapäevaelus kõige sagedamini. Need on suuresti siirdemetallid: B-rühmade metallid. Väheaktiivsete metallide hulka kuuluvad kõik väärismetallid (Ag, Au, Pt).
Metallid reageerivad hapnikuga ning selle reaktsiooni tulemusel tekib metallioksiid. Selle reaktsiooni kohta peaksid teadma, et väärismetallid hapnikuga ei reageeri, aktiivsete metallide reaktsioonid hapnikuga kulgevad tavatingimustel ja keskmise aktiivsusega metallid on tavatingimustel hapniku suhtes üpris vastupidavad (nende pinnale tekib õhuga kokkupuutel tihe ja kaitsev oksiidikiht, mis takistab edasist reageerimist), kuid reageerivad aktiivselt kuumutamisel.
METALL + HAPNIK → OKSIID
Näiteks kaltsiumi reageerimisel hapnikuga tekib kaltsiumoksiid:
2Ca + O2 → 2CaO
Kui plii reageerib hapnikuga, tekib plii(II)oksiid:
2Pb + O2 → 2PbO
Nagu näed, on metallide ja hapniku vaheline reaktsioon ühinemisreaktsioon.
Hapnik ei ole ainus mittemetall, millega metallid võivad reageerida. Nad reageerivad ka näiteks väävliga, andes sulfiide (tekib sool):
2Na + S → Na2S
Ja veel reageerivad nad ka klooriga, tekivad kloriidid (samuti soolad):
2K + Cl2 → 2KCl
Ülesanne 2
Metallid reageerivad ka hapete lahustega. Taas pead silmas pidama, et kõik metallid (pingereas H-st tagapool asuvad metallid) hapetega ei reageeri.
Metallide reaktsioonil hapete lahustega tekib sool ja eraldub vesinik.
METALL + HAPE → SOOL + H2↑
Paneme näiteks magneesiumi reageerima vesinikkloriidhappe lahusega:
Mg + 2HCl → MgCl2 + H2↑
Ja alumiiniumi reageerima väävelhappe lahusega:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Metalli ja happe vaheline reaktsioon on asendusreaktsioon, kus metall tõrjub happest vesiniku välja ehk asendab vesiniku. Selliseid reaktsioone nimetatakse asendusreaktsioonideks. Asendusreaktsioon on reaktsioon, kus üks aatom või aatomite rühm asendab teise aine molekulis mingi aatomi või aatomite rühma.
Nagu juba mainitud, H-st paremal asuvad metallid hapetega ei reageeri ja taolised võrrandid lõpetame nii:
Cu + HCl 
5.2. Redoksreaktsioonid
Meie igapäevaelus kulgeb väga palju keemilisi muundumisi, mida saame liigitada redoksreaktsioonide hulka. Redoksreaktsioonid on näiteks õuna lõikepinna tumenemine õhu käes, meie igapäevane nii märkamatu tegevus nagu hingamine, hõbeehete tuhmumine aja jooksul, küünla põlemine jne. Redoksreaktsioone selgitab Sulle siinolev video.
Allikas: https://youtu.be/OH5M-kREEJk
Redoksreaktsioon on reaktsioon, mille käigus muutub vähemalt kahe keemilise elemendi oksüdatsiooniaste, kuna toimub elektronide üleminek ühelt aineosakeselt teisele. Redoksreaktsiooni puhul toimuvad paralleelselt kaks protsessi: oksüdeerumine ja redutseerumine. Oksüdeerumine on protsess, kus aineosake loovutab elektrone ning selle käigus elemendi oksüdatsiooniaste kasvab. Redutseerumine on vastandprotsess: aineosake liidab elektrone ning seetõttu elemendi oksüdatsiooniaste kahaneb. Osake, mis liidab elektrone, on oksüdeerija, ning osake, mis loovutab elektrone, on redutseerija.
Et Sul oleks lihtsam neid uusi mõisteid meelde jätta ja nendega tegutseda, jäta meelde järgmine seos: redutseerija reedab elektrone (annab elektrone ära). Kuna elektron on negatiivse laenguga, siis negatiivset laengut ära andes muutub aineosake ise positiivsemaks ehk elektrone loovutava keemilise elemendi oksüdatsiooniaste suureneb. Protsess, mis redutseerijaga toimub, on oksüdeerumine. Seega oksüdeerumine on elektronide loovutamise protsess ning siit edasi saad oksüdeerija ja redutseerumise mõistete tähendused juba ise tuletada.
Kuidas teha kindlaks, kas tegemist on redoksreaktsiooniga?
Selleks tuleb analüüsida toimuva reaktsiooni võrrandit, leides selles kõikide elementide oksüdatsiooniastmed. Võtame näiteks neutralisatsioonireaktsiooni võrrandi, kus omavahel reageerivad naatriumhüdroksiid ja vesinikkloriidhape:
NaOH + HCl → NaCl + H2O
Määrame kõikide elementide o.a-d.
I -II I I -I I -I I -II
NaOH + HCl → NaCl + H2O
Kui vaadata nüüd leitud o.a-sid, näeme, et mitte ühegi elemendi o.a ei muutunud ja saame teha järelduse, et see reaktsioon pole redoksreaktsioon.
Analüüsime magneesiumi põlemisreaktsiooni võrrandit.
0 0 II -II
2Mg + O2 → 2MgO
Selles võrrandis elementide o.a-d muutuvad ja seetõttu on tegemist redoksreaktsiooniga. Määrame reaktsioonis elemendi, mis on oksüdeerijaks, ja elemendi, mis on redutseerijaks, ning elemendi, mis oksüdeerub, ja elemendi, mis redutseerub. Selleks on meil abi vastavatest mõistetest.
0 II
Mg$\xrightarrow[]{-2e^{-}}$Mg
Nagu näed, magneesiumi o.a suureneb, järelikult ta loovutab elektrone: sellest lähtuvalt on ta redutseerija ja ise oksüdeerub.
0 -II
O$\xrightarrow[]{+2e^{-}}$O
Siin näed, et hapniku o.a väheneb, seega ta liidab elektrone ja järelikult on oksüdeerija ning ise redutseerub. Jäta meelde, et metallide reageerimisel hapnikuga käituvad metallid redutseerijana ja hapnik oksüdeerijana.
Analüüsime järgmisena kaltsiumi ja väävelhappe vahelise reaktsiooni võrrandit.
Alustuseks määrame taas kõikide elementide o.a-d.
0 I VI -II II VI -II 0
Ca + H2SO4 → CaSO4 + H2↑
Nagu näed, muutuvad ka selles reaktsioonis kahe elemendi o.a-d.
0 II
Ca$\xrightarrow[]{-2e^{-}}$Ca
Kaltsiumi o.a suureneb: ta loovutab elektrone. Järelikult on ta redutseerija ja ise oksüdeerub.
I 0
H$\xrightarrow[]{+1e^{-}}$H
Näeme, et vesiniku o.a väheneb, seega ta liidab elektrone. Sellest tulenevalt on ta oksüdeerija ja ise redutseerub.
Taas saad meelde jätta, et metallide reaktsioonidel hapetega käitub metall redutseerijana ja oksüdeerijaks on vesinikioonid.
5.3. Keemilise reaktsiooni kiirus
Tööstus ja tänapäeva ühiskond sooviksid, et reaktsioonid toimuksid võimalikult kiiresti, sest aeg on raha. Kuidas aga mõjutada keemilise reaktsiooni kiirust? Vastused peituvad järgnevas videos.
Allikas: https://youtu.be/E0MlY2Y7MQ0
Selleks, et keemiline reaktsioon saaks toimuda ehk saaks toimuda ainete muundumine teisteks aineteks, peavad olema täidetud kaks tingimust:
- aineosakesed peavad kokku põrkama;
- reageerivatel ainetel peab olema piisavalt energiat, et aatomite vahelised sidemed paigutuksid ümber ehk lähteainetest tekiksid saadused.
Keemilise reaktsiooni kiirust määratakse selle järgi, kui kiiresti lähteained ära reageerivad või kui kiiresti tekivad saadused. Selle jaoks, et keemilist reaktsiooni kiirendada, on mitmeid võimalusi, näiteks
- temperatuur – mida kõrgem on temperatuur, seda kiirem on reaktsioon;
- lahuse kontsentratsioon (kangus) – mida suurema kontsentratsiooniga on reageeriv lahus, seda kiirem on reaktsioon;
- tahke aine peenestatus – mida suurem on tahke aine peenestusaste, seda kiirem on reaktsioon;
- aine iseloom – näiteks aktiivsemate metallidega toimuvad reaktsioonid kiiremini kui keskmiste või väheaktiivsete metallidega;
- segamine – segamine kiirendab reaktsiooni, kuna nii suureneb reageerivate ainete kokkupõrkamise tõenäosus;
- katalüsaator – katalüsaatori kasutamine kiirendab reaktsiooni.
5.4. Tähtsamad metallid ja sulamid
Metallid on meie igapäevaelus asendamatud materjalid. Neist valmistatakse väga palju erinevaid tarbeesemeid alates tööriistadest ja lauanõudest kuni autode, erinevate tööstusseadmete ja konstruktsioonimaterjalideni. Ülevaate levinumatest metallidest ning nende sulamitest ja kasutamisest igapäevaelus annab järgnev video.
Allikas: https://youtu.be/CGAeWeG2Kus
Raud ja tema sulamid
Raud on kahtlemata üks olulisematest ja enam kasutatavatest metallidest. Oma levikult maakoores on ta neljandal kohal hapniku, räni ja alumiiniumi järel (metallilistest elementidest teisel kohal). Looduses leidub rauda ehedal kujul äärmiselt vähe, eelkõige raudmeteoriitides, siiski on teda mitmete ühendite koostises, näiteks savides, looduslikus vees ja kivimites. Samuti leidub elemendilist rauda elusorganismide veres hemoglobiini koostises.
Raua füüsikalised omadused on järgmised:
- hõbehall läikiv metall,
- suhteliselt raske (ρ = 7,9 g/cm3),
- kõrge sulamistemperatuur (1540oC),
- plastne (hästi töödeldav),
- suhteliselt kõva (Mohri skaalal 4,5),
- magnetiliste omadustega.
Rauda toodetakse rauamaakidest, millest tähtsamad on punane rauamaak ehk hematiit (Fe2O3) ning must rauamaak ehk magnetiit (Fe3O4).


Punane rauamaak ehk hematiit (vasakul) ja must rauamaak ehk magnetiit (paremal)
Nimetus magnetiit tuleneb tema magnetilistest omadustest. Rauatoodang moodustab metallide kogutoodangust üle 90% ning kuna raud on küllaltki odav ja heade füüsikaliste omadustega metall, on sellel ka palju kasutusvaldkondi. Samas on täiesti puhas raud võrdlemisi pehme, mistõttu kasutatakse esemete valmistamisel tema sulameid: malmi ja terast. Sulam on materjal, mis koosneb mitmest metallist või metallist ja mittemetallist. Seega on sulam segu, mis tihti saadakse mitme erineva aine kokkusulatamisel.
Malm on raua ja süsiniku sulam, kus süsiniku sisaldus on umbes 2...5%. Veel sisaldub malmis näiteks räni ja fosforit. Sulamalm on voolav, mistõttu saab teda kergesti näiteks vormi valada. Malm on võrreldes rauaga kõvem, kuid hapram materjal. Malmist valmistatakse näiteks radiaatoreid, malmpotte ja -panne ning pliidiraudasid ja kaminasüdamikke.


Malm (vasakul) ja teras (paremal)
Teine raua sulam on teras, mis lisaks rauale sisaldab samuti süsinikku nagu malmgi. Kui malmis on süsiniku sisaldus umbes 2...5%, siis terase süsinikusisaldus on väiksem, teras sisaldab umbes 0,002...2% süsinikku. Tulenevalt väiksemast süsiniku sisaldusest on teras paremini töödeldav. Teda kasutatakse näiteks naelte, auto- või laevakerede, tööriistade, lauanõude ja teraskonstruktsioonide valmistamisel. Nii malm kui ka teras on sulamid, mis on keemiliselt suhteliselt vähe vastupidavad. Näiteks õhus ja vees hävivad nad ümbritseva keskkonna toimel ehk roostetavad. Selle vältimiseks lisatakse terasele näiteks kroomi, et saada uus sulam, mida nimetatakse roostevabaks teraseks ning mis on palju vastupidavam väliskeskkonna toimele.
Alumiinium ja tema sulamid
 Alumiinium on raua kõrval tähtsuselt teine ning looduses kõige levinum metall. Kuna alumiinium on küllaltki aktiivne metall, ei leidu teda looduses ehedalt.
Alumiinium on raua kõrval tähtsuselt teine ning looduses kõige levinum metall. Kuna alumiinium on küllaltki aktiivne metall, ei leidu teda looduses ehedalt.
Alumiiniumi füüsikalised omadusedon järgmised:
- hõbevalge läikiv metall,
- suhteliselt kerge (ρ = 2,7 g/cm3),
- suhteliselt madal sulamistemperatuur (660oC),
- hea elektri- ja soojusjuht,
- plastne (hästi töödeldav),
- üpris pehme (Mohri skaalal 2,5…3).
Tähtsaimaks alumiiniumiühendiks on boksiit, mis koosneb peamiselt alumiiniumoksiidist (Al2O3) ja millest toodetakse puhast alumiiniumi.
 Hoolimata sellest, et alumiinium on keemiliselt aktiivne ning reageerib kergesti õhus oleva hapnikuga, on alumiiniumist valmistatud esemed õhuhapniku suhtes vastupidavad, kuna nende pinnale moodustub hapnikuga reageerimisel tihe ja kaitsev oksiidikiht, mis hoiab ära esemete edasise kahjustumise.
Hoolimata sellest, et alumiinium on keemiliselt aktiivne ning reageerib kergesti õhus oleva hapnikuga, on alumiiniumist valmistatud esemed õhuhapniku suhtes vastupidavad, kuna nende pinnale moodustub hapnikuga reageerimisel tihe ja kaitsev oksiidikiht, mis hoiab ära esemete edasise kahjustumise.
4Al + 3O2 → 2Al2O3
Tänu sellele, et alumiinium on väikese tihedusega ning vastupidav õhu ja vee toimele, kasutatakse teda näiteks nõude ja joogipurkide valmistamisel. Lisaks on alumiiniumil hea peegeldusvõime, mistõttu kasutatakse teda peeglites peegeldava kihina. Alumiiniumi kõige tuntum sulam on duralumiinium, mis sisaldab lisandina umbes 4% vaske ning väikestes kogustes ka magneesiumi, mangaani ja räni. Duralumiinium on tugev, kuid väikese tihedusega materjal, mida kasutatakse näiteks lennukiehituses kerede valmistamisel, aga ka laevadetailide tootmisel.
Vask ja tema sulamid
 Vask on elementide levikult maakoores alles 26. kohal, kuid inimkond on kasutanud vaske juba antiikajast. Ehedalt leidub vaske looduses väga harva.
Vask on elementide levikult maakoores alles 26. kohal, kuid inimkond on kasutanud vaske juba antiikajast. Ehedalt leidub vaske looduses väga harva.
Vase füüsikalised omadusedon järgmised:
- punakaspruuni värvusega,
- väga hea elektri- ja soojusjuht,
- suhteliselt raske (ρ = 7,9 g/cm3),
- plastne (kergesti töödeldav),
- kõrge sulamistemperatuur (1083oC),
- suhteliselt pehme (Mohri skaalal 3).
Vaske toodetakse vasemaakidest, millest tähtsamad on vaskläik (Cu2S) ning kalkopüriit (CuFeS2). Tänu oma keemilisele püsivusele ning väga heale elektrijuhtivusele, kasutatakse vaske laialdaselt elektrijuhtmetes ning elektroonikas.


Vaskläik (vasakul) ja kalkopüriit (paremal)
Vasel on kaks tähtsat sulamit: pronks ja messing. Pronks on punaka või kollaka värvusega vase ning tina sulam. Pronksi saab hästi valada ning tegemist on vastupidava ja kõva materjaliga, mistõttu kasutatakse seda näiteks skulptuuride, monumentide, aga ka kirikukellade valmistamisel. Vase teine sulam on messing ehk valgevask. Messing on oma värvuselt helekollane sulam, mis lisaks vasele sisaldab kuni 40% tsinki. Messingit kasutatakse tema välimuse tõttu erinevate nipsasjakeste, aga ka uksenuppude ja toruliitmike valmistamiseks. Veel kasutatakse messingit puhkpillide valmistamisel. Lisaks eelpool nimetatud valdkondadele kasutatakse vasesulameid laialdaselt müntide ja sentide tootmisel, kuna tegemist on hästi töödeldava, küllaltki odava ja keemiliselt stabiilse materjaliga.


Pronks (vasakul) ja messing (paremal)
5.5. Metallide korrosioon
Korrosiooniga oled Sa kindlasti oma elus kokku puutunud: roostes naelad või rattakett, rohekasmusta paatinakihiga kaetud vaskne kirikutorn, hõbedast ehete tumenemine jne. Ülevaate korrosioonist annab allolev video.
Allikas: https://youtu.be/EwiL-4H361U
Korrosioon on protsess, mille käigus toimub metalli hävimine ümbritseva keskkonna toimel. Korrosiooni korral toimub redoksreaktsioon, mille käigus metallid oksüdeeruvad ehk loovutavad elektrone mõnele keskkonnas leiduvale oksüdeerijale (enamasti on selleks õhus leiduv hapnik) ja nii tekib metallist kui lihtainest metalliühend. Tekkival metalliühendil on madalam energia kui puhtal metallil ja seetõttu on ta ka palju püsivam. Kuna korrosiooni korral läheb metall püsivamasse ehk madalama energiaga olekusse (reeglina tekib temast metalli oksiid), siis saamegi järeldada, et korrosioon toimub vastavates keskkonnatingimustes iseeneslikult, selle toimumiseks pole tarvis lisaenergiat.
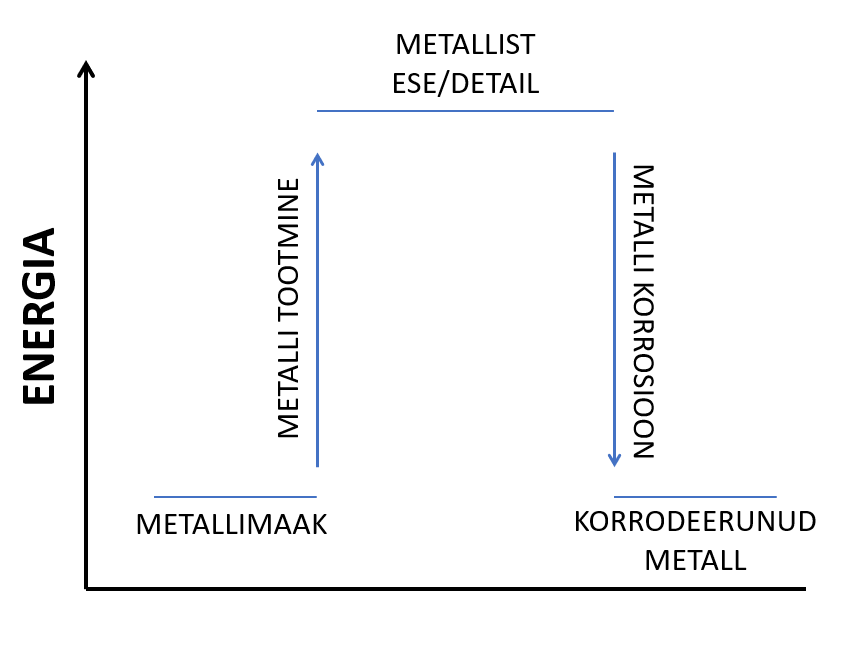
Metallide korrodeerumine
Kuna metallide aktiivsus on küllaltki erinev, kulgeb ka eri metallide korrodeerumine väga erinevalt. Näiteks alumiiniumi, tsingi või nikli pinnale moodustub hapnikuga reageerimise tulemusel tihe ja õhuke oksiidikiht, mis kaitseb metalli edasise oksüdeerumise eest, kuna takistab niiskuse ja hapniku jõudmist metalli pinnani. Seevastu raua pinnale moodustub hapnikuga reageerimisel pudenev rauarooste kiht, mis ei kaitse metalli edasise keskkonnamõju eest, ning seetõttu võivad rauast detailid ümbritseva keskkonna toimel täielikult hävida.
Raua roostetamine
Raua korrosiooni tuntakse igapäevaelus kui raua roostetamist. Raua roostetamine on küllaltki keeruline protsess, kuid lihtsustatult võime seda vaadelda kui raua reaktsiooni hapnikuga, mille tulemusel moodustub punakaspruuni värvusega raud(III)oksiid:
4Fe + 3O2 → 2Fe2O3
Kuna väga paljud inimese jaoks olulised detailid ja esemed on valmistatud rauast või tema sulamitest, on oluline mõista, millised tegurid soodustavad raua roostetamist ja kuidas kaitsta rauast detaile korrosiooni eest.
Raua korrosiooni soodustavad
- niiskus;
- happeline keskkond;
- lahuses esinevad erinevad soolad (sageli kloriidid);
- kõrgem temperatuur;
- kontakt vähemaktiivse metalliga.
Järelikult kui tahame kaitsta rauasulamitest valmistatud esemeid korrosiooni eest, peame tagama, et kuidagi oleks kõrvaldatud korrosiooni soodustavad tegurid ehk peaksime püüdma vähendada kaitstava metalli kontakti väliskeskkonnaga. Seda saab teha näiteks metalli pinna katmisel kas värvi või lakiga, aga ka mõne püsivama metalli kihi või plastikuga. Näiteks jalgratta raam kaetakse värviga, aiamööbli korral kasutatakse plastikust katteid või autode veljed kaetakse kroomiga. Veel kasutatakse korrosiooni tõrjumiseks erisulamite valmistamist. Näiteks selleks, et takistada raua roostetamist, on võimalik valmistada raua ja süsiniku sulam, milles kasutatakse lisandina kroomi. Saadud sulamit nimetatakse roostevabaks teraseks ja see on vastupidav nii niiskuse kui ka õhuhapniku toimele, sest kroomi aatomite oksüdeerumise tulemusel moodustub tugev ja kaitsev oksiidikiht. Korrosiooni takistamiseks kasutatakse ka ohverdusmetalli ehk see metall, mida soovitakse kaitsta väliskeskkonna eest, viiakse kontakti aktiivsema metalliga, mis siis ise oksüdeerub ehk käitub korrosiooni ohvrina. Sellist meetodit kasutatakse näiteks laevade puhul, kus terasest laevakerega ühendatakse näiteks tsingist valmistatud plaadikesed. Kuna tsink on rauaga võrreldes aktiivsem metall, korrodeerub tema enne ja kaitseb nii terasest laevakeret roostetamise eest. Seejuures peab olema tähelepanelik ja asendama tsinkplaadid enne, kui need täielikult oksüdeeruvad.