3. Anorgaaniliste ainete põhiklassid
Selles peatükis saad ülevaate anorgaaniliste ühendite maailmast: õpid tundma oksiide, happeid, aluseid ja soolasid. Pärast materjali läbitöötamist peaksid oskama ka aineklasside omavahelisi seoseid reaktsioonivõrranditena üles kirjutada. Samuti saad teada, mida kujutab endast pH ja kuidas selle järgi lahuse keskkonda määrata.
2.4. Oksüdatsiooniaste vale
3.1. Oksiidid
Oksiidide peatükis räägime, mis on oksiidid, kuidas oksiide nimetatakse ning nende keemilisi valemeid koostatakse. Vaatame, kuidas oksiide saab liigitada ja kuidas tekivad oksiidid.
Kõige üldisemalt saame defineerida, et oksiidid on ained, mis koosnevad kahest elemendist, millest üks on hapnik. Oksiide leidub kõikjal meie ümber. Üks levinumaid oksiide on näiteks vesi ehk divesinikoksiid (H2O). Suur osa maakoorest koosneb tahketest oksiididest, mis tuleneb sellest, et elemendid on reageerinud õhuhapniku või veega. Samuti on enamik metalle, mis puutuvad kokku hapnikuga või veega, kaetud oksiidi või oksiidide kihiga.
Järgnev video võtab kokku kõik olulisemad oksiidide nimetamise, saamise ja keemiliste omaduste reeglid.
Allikas: https://www.youtube.com/watch?v=mPn6iPeGfwk&list=PLDWTb1SlW-s0UQDpn7rtAmyba3HoLd2xu
Nimetamine
Oksiidide nimetamisel tuleks esmalt teada, kas tegemist on metallioksiidiga või mittemetallioksiidiga. Metallioksiid on oksiid, mis koosneb metallilisest elemendist ja hapnikust (nt CaO, Na2O). Mittemetallioksiid on oksiid, mis koosneb mittemetallilisest elemendist ja hapnikust (nt H2O, CO2).
 Korda videost üle, kuidas määrata oksüdatsiooniastet ja tasakaalustada ühendit.
Korda videost üle, kuidas määrata oksüdatsiooniastet ja tasakaalustada ühendit.
Metallioksiidide nimetamisel tuleb eelnevalt teada, kas metall on püsiva või muutuva oksüdatsiooniastmega. Sellest tulenevalt on kaks metallioksiidide nimetamise reeglit:
1. metalli nimi + oksiid, kui oksiidi koostises oleval metallilisel elemendil on püsiv oksüdatsiooniaste (IA, IIA ja IIIA rühma metallilised elemendid):
nt CaO - kaltsiumoksiid, Na2O - naatriumoksiid, Al2O3 - alumiiniumoksiid;
2. metalli nimi + (o.a) + oksiid, kui oksiidi koostises oleval metallilisel elemendil on muutuv oksüdatsiooniaste (ülejäänud metallillised elemendid), mis tuleb kõigepealt valemis määrata ning siis ka nimetamisel kasutada, nt
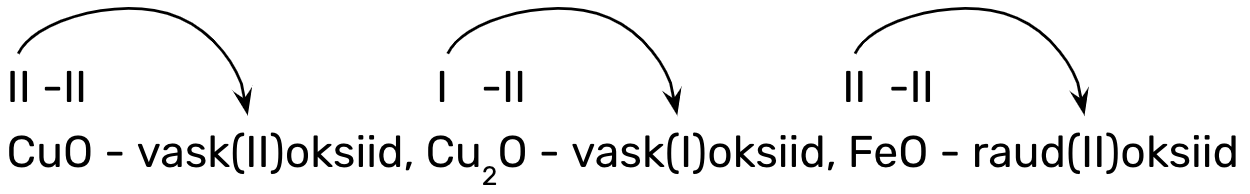
Mittemetallioksiidide nimetamisel kasutatakse kreekakeelseid eesliiteid:
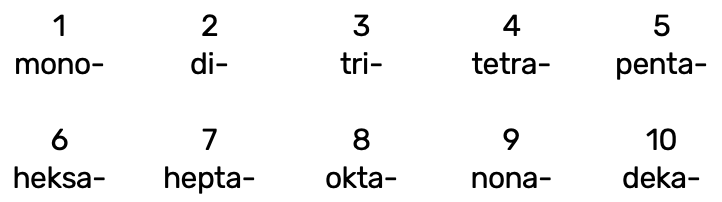
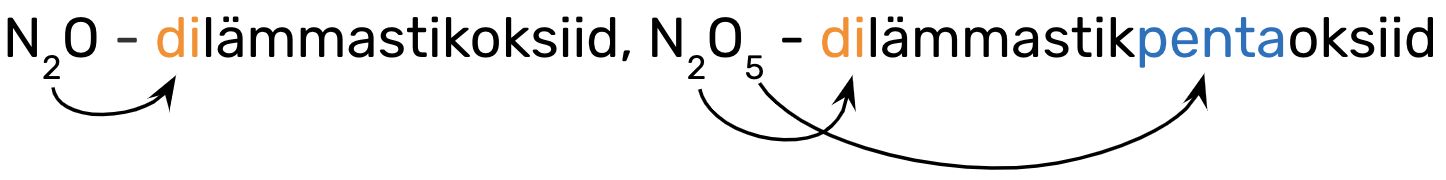
Eesliide käib selle mittemetallilise elemendi nimetuse ette, mille aatomite arvu ta näitab, nt
Ülesanne 1
Vali oksiidi õige nimetus.
Valemite koostamine
Oksiidide valemite koostamisel tuleks lähtuda järgmistest reeglitest:
- kirjuta kõrvuti oksiidi moodustava metallilise või mittemetallilise elemendi ja hapniku sümbolid;
- kui on tegemist mittemetallilise elemendiga, jälgi eesliiteid ja kirjuta need vastava elemendi sümboli järele indeksiks;
- kui on tegemist metallilise elemendiga, märgi elementide sümbolite kohale oksüdatsiooniastmed ja tasakaalusta vajadusel valem.
Näide 1. Koostame divesinikoksiidi valemi.
- Kõigepealt märgi kõrvuti vesiniku ja hapniku sümbolid: HO.
- Kuna tegemist on mittemetallioksiidiga arvesta eesliiteid.
- Kuna eesliide on vesiniku ees ja "di" tähendab kahte, siis on molekulis 2 vesiniku aatomit ning molekuli valemi saame kirjutada: H2O.
Näide 2. Koostame liitiumoksiidi valemi.
- Kõigepealt märgi kõrvuti liitiumi ja hapniku sümbolid: LiO.
-
Tegemist on metallioksiidiga, märgi elementide kohale oksüdatsiooniastmed:
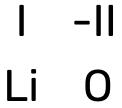
- Kuna oksüdatsiooniastmed on erineva väärtusega, tuleb valem tasakaalustada.
- Hetkel on molekulis üks positiivne osa ja kaks negatiivset osa, et molekuli laeng oleks tervikuna null, peab võtma ka positiivseid osasid 2 tükki, seega tuleb võtta 2 liitiumi aatomit ja see kirjutatakse alla indeksiks.
- Sellest tulenevalt kujuneb liitiumoksiid valemiks: Li2O.
Ülesanne 2
Milline on oksiidi õige valem?
Liigitamine
Oksiide jaotatakse metallioksiididideks ja mittemetallioksiidideks. Samas on võimalik neid liigitada ka happelisteks ja aluselisteks oksiidideks.
Happelised oksiidid on hapetele vastavad oksiidid. Tuntuimad happelised oksiidid on mittemetallioksiidid, nt SO2, CO2.
Aluselised oksiidid on alustele vastavad oksiidid. Tavaliselt on aluselised oksiidid metallioksiidid, nt CaO, Li2O. Aluselisi oksiide liigitatakse omakorda tugevalt aluselisteks oksiidideks ja nõrgalt aluselisteks oksiidideks. Tugevalt aluselised oksiidid on need oksiidid (IA ja IIA alates Ca-st metalliliste elementide oksiidid), mille reageerimisel veega moodustub leelis.
|
ALUSELISED |
HAPPELISED |
|
Li2O liitiumoksiid |
SO2 vääveldioksiid |
|
Na2O naatriumoksiid |
SO3 vääveltrioksiid |
|
CaO kaltsiumoksiid |
NO2 lämmastikdioksiid |
|
FeO raud(II)oksiid |
P4O10 tetrafosfordekaoksiid |
Ühinemisreaktsioon
Sa tead juba, et oksiidid on ained, mis koosnevad kahest elemendist, millest üks on hapnik. Kuidas oksiidid tekivad? Selle jaoks, et saaksime õige pea minna oksiidide tekkimise juurde, vaata läbi video, mis aitab Sul mõista, kuidas kirjutatakse reaktsioonivõrrandeid ning kuidas tekivad oksiidid.
Allikas: https://youtu.be/BvZQu-lJuCQ
Keemilise reaktsiooni võrrand on reaktsiooni üleskirjutus valemite abil ning annab informatsiooni reageerivatest ja tekkivatest ainetest ehk lähteainetest ja saadustest. Lähteained on reaktsioonis omavahel reageerivad ained ning saadused reaktsiooni käigus tekkivad ained. Reaktsioonivõrrandis kirjutatakse lähteained reaktsioonivõrrandi vasakule poole ning nende vahele pannakse „+“ märk näitamaks, et need ained reageerivad omavahel. Saadused kirjutatakse reaktsioonivõrrandi paremale poole ning lähteainete muundumist saadusteks näidatakse noolega.
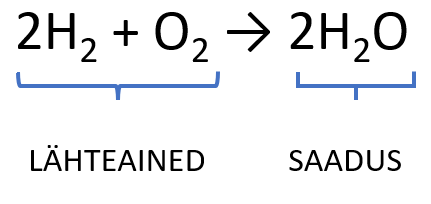
Nagu Sa ülaltoodud jooniselt näed, siis vesiniku ja hapniku omavahelisel ühinemisel tekib vesi. Ilmselt panid ka tähele, et ainete üleskirjutamisel kasutatakse alaindekseid. Indeks paigutatakse vastava elemendi sümboli alla paremale ning see väljendab molekulis olevate aatomite arvu.
Ülesanne 4
Eelmisel joonisel näed veel, et vesiniku ja vee valemi ees on numbrid. Need on olulised, kuna reaktsioonivõrrand peab olema tasakaalus ehk ühe ja sama elemendi aatomite arv reaktsioonivõrrandi vasakul ja paremal pool peab olema sama. Kui see nii ei ole, tuleb võrrandit tasakaalustada. Tasakaalustamise juures võid Sa reaktsioonivõrrandis aine valemite ette kirjutada kordajaid ehk koefitsiente. Kordaja näitab reaktsioonis osalevate osakeste arvu.
Proovime kirjutada naatriumi ja hapniku omavahelise keemilise reaktsiooni võrrandi.
1. Paneme kirja lähteainete valemid ning nende vahele „+“ märgi:
Na + O2
2. Kuna naatrium ja hapnik reageerivad omavahel, andes uue aine, kirjutame võrrandisse vastava sümbolina “→”:
Na + O2 →
3. Selle reaktsiooni käigus tekib naatriumoksiid. Naatriumoksiidi valemi koostamisel kasutame oksüdatsiooniastmeid (kuna tegu on metallioksiidiga):
I -II
Na + O2 → Na2O
4. Nüüd kontrollime, kas reaktsioonivõrrand on tasakaalus ning näeme, et antud hetkel see nii ei ole. Võrrandi vasakul pool on 1 naatriumi aatom ning 2 hapniku aatomit, kuid reaktsioonivõrrandi paremal pool on 2 naatriumi aatomit ja 1 hapniku aatom. Reaktsioonivõrrandi tasakaalustamiseks proovime kõigepealt mõlemale poole saada kaks hapniku aatomit, seega kirjutame naatriumoksiidi ette kordajaks 2:
Na + O2 → 2Na2O
5. Nüüd on paremal pool neli naatriumi aatomit (kordaja ja indeks korrutatakse) ning selle jaoks, et ka vasakul pool oleks neli naatriumi aatomit, tuleb naatriumi ette kirjutada kordajaks 4:
4Na + O2 → 2Na2O
Sellega ongi naatriumi ja hapniku omavahelise reaktsiooni võrrand kirjutatud ja tasakaalustatud.
Ülesanne 5
Oksiidide saamine
Oleme käsitlenud juba vesiniku ja hapniku ning naatriumi ja hapniku omavahelist reaktsiooni. Mõlemad on ühinemisreaktsioonid. Ühinemisreaktsioon on reaktsioon, mille käigus ained ühinevad, moodustades uue aine. Üks võimalus oksiidide saamiseks ongi just ühinemisreaktsioonil.
Oksiidid tekivad lihtaine reageerimisel hapnikuga. Reaktsiooni hapnikuga nimetatakse ka põlemisreaktsiooniks. Näiteks baariumi reageerimist hapnikuga, mille tulemusel tekib baariumoksiid, kirjeldab järgnev reaktsioonivõrrand:
2Ba + O2 → 2BaO
Alumiiniumi ja hapniku ühinemise reaktsioonivõrrand näeb aga välja selline:
4Al + 3O2 → 2Al2O3
Veel on oluline mõista, et metallide põlemisel tekivad metallioksiidid ning mittemetallide põlemisel tekivad mittemetallioksiidid. Seega näiteks süsiniku ja hapniku omavahelisel reaktsioonil tekib süsinikdioksiid:
C + O2 → CO2
Ülesanne 6
Oksiidid ei ole aga ainsad ained, mis tekivad lihtainete ühinemisel. Niimoodi tekivad ka sulfiidid ja kloriidid (soolade aineklassi kuuluvad ained).
Näiteks kaltsiumi ja kloori vahelisel reaktsioonil tekib kaltsiumkloriid:
Ca + Cl2 → CaCl2
Liitiumi ja väävli vahelisel reaktsioonil tekib aga liitiumsulfiid:
2Li + S → Li2S
Oksiidide keemilised omadused
Sõltuvalt sellest, kas tegemist on happelise või aluselise oksiidiga, on neil erinevad keemilised omadused.
1. Happelise oksiidi reageerimisel veega moodustub hape.
HAPPELINE OKSIID + H2O → HAPE
SO3 + H2O → H2SO4
CO2 + H2O  H2CO3
H2CO3
P4O10 + 6H2O → 4H3PO4
N2O5 + H2O → 2HNO3
Jäta meelde, et SiO2 ei reageeri veega! (SiO2 on liiva põhikomponent.)
Oluline on meeles pidada, et oksiidis ja talle vastavas happes peab mittemetallilisel elemendil olema sama oksüdatsiooniaste (o.a). Happelised oksiidid ja neile vastavad happed on toodud tabelis 1:
Tabel 1. Happelistele oksiididele vastavad happed
|
HAPPELINE OKSIID |
VASTAV HAPE |
HAPPE NIMETUS |
|
SO2 |
H2SO3 |
väävlishape |
|
SO3 |
H2SO4 |
väävelhape |
|
CO2 |
H2CO3 |
süsihape |
|
P4O10 |
H3PO4 |
fosforhape |
|
N2O5 |
HNO3 |
lämmastikhape |
2. Aluselise oksiidi reageerimisel veega moodustub tugev alus ehk leelis.
ALUSELINE OKSIID + H2O → TUGEV ALUS
CaO + H2O → Ca(OH)2
Na2O+ H2O → 2NaOH
Veega reageerivad ainult IA rühma ja alates kaltsiumist (alates Ca-st) IIA rühma metallide oksiidid.
3. Aluselise oksiidi reageerimisel happelise oksiidiga moodustub sool.
ALUSELINE OKSIID + HAPPELINE OKSIID → SOOL
CaO + CO2 → CaCO3
6Li2O + P4O10 → 4Li3PO4
See reaktsioon toimub alati ning tekib happelisele oksiidile vastava happe sool. Happelisele oksiidile vastava happe leiad tabelist 1.
4. Happeline oksiid reageerib alusega, moodustub sool ja vesi.
HAPPELINE OKSIID + ALUS → SOOL + H2O
SO2 + 2NaOH → Na2SO3 + H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
See reaktsioon toimub alati.
5. Aluseline oksiid reageerib happega, moodustub sool ja vesi.
ALUSELINE OKSIID + HAPE → SOOL + H2O
2 HNO3 + CaO → Ca(NO3)2 + H2O
2HCl + Na2O → 2NaCl + H2O
See reaktsioon toimub alati.
3.2. Happed
Selles peatükis käsitleme järgmist anorgaanilise keemia aineklassi – happeid. Happed mängivad meie igapäevaelus väga suurt rolli. Happeid leiad Sa nii puuviljadest, köögikapist kui ka majapidamisruumist.
Allolevast videost saad teada, kuidas happeid nimetada, kuidas happeid saada ning millised on hapete keemilised omadused.
Allikas: https://youtu.be/aYWA4Od8nhU
 Happed on aineid, mis annavad vesilahusesse vesinikioone (H+). Üks tuntuim hape on vesinikkloriidhape (HCl). HCl rahvapäraseks nimetuseks on soolhape. Vesinikkloriidhapet leidub maohappe koostises, kus tal on oluline roll toidu ja joogi keemilisel lagundamisel. HCl kasutatakse ka basseinivee puhastamisel ja erinevates puhastustoodetes.
Happed on aineid, mis annavad vesilahusesse vesinikioone (H+). Üks tuntuim hape on vesinikkloriidhape (HCl). HCl rahvapäraseks nimetuseks on soolhape. Vesinikkloriidhapet leidub maohappe koostises, kus tal on oluline roll toidu ja joogi keemilisel lagundamisel. HCl kasutatakse ka basseinivee puhastamisel ja erinevates puhastustoodetes.
Hapete juures tuleb silmas pidada, et mõned neist on väga söövitava toimega. Näiteks juba väike tilk väävelhapet söövitab riidesse suure augu.
Nimetamine ja valemite koostamine
Happed koosnevad vesinikust ja happejääkioonist. Selleks, et hapete valemite kirjutamine läheks ladusamalt, õpi selgeks tabelis 1 toodud happejääkioonid ja nende nimed.
Tabel 1. Mõningate anorgaaniliste hapete ning vastavate happejääkioonide (happeanioonide) valemid ja nimetused
|
Hape |
Happejääkioon |
||
|
Valem |
Nimetus |
Valem |
Nimetus |
|
HCl |
vesinikkloriidhape (kasutatakse ka nimetust soolhape) |
Cl- |
kloriid |
|
H2S |
divesiniksulfiidhape |
S2- |
sulfiid |
|
H2SO3 |
väävlishape |
SO32- |
sulfit |
|
H2SO4 |
väävelhape |
SO42- |
sulfaat |
|
HNO3 |
lämmastikhape |
NO3- |
nitraat |
|
H2CO3 |
süsihape |
CO32- |
karbonaat |
|
H3PO4 |
fosforhape |
PO43- |
fosfaat |
|
H2SiO3 |
ränihape |
SiO32- |
silikaat |
Liigitamine
1. Tugevuse järgi
1) Tugevad happed on vesilahuses täielikult ioonideks jagunenud, nt HCl, HNO3, H2SO4.
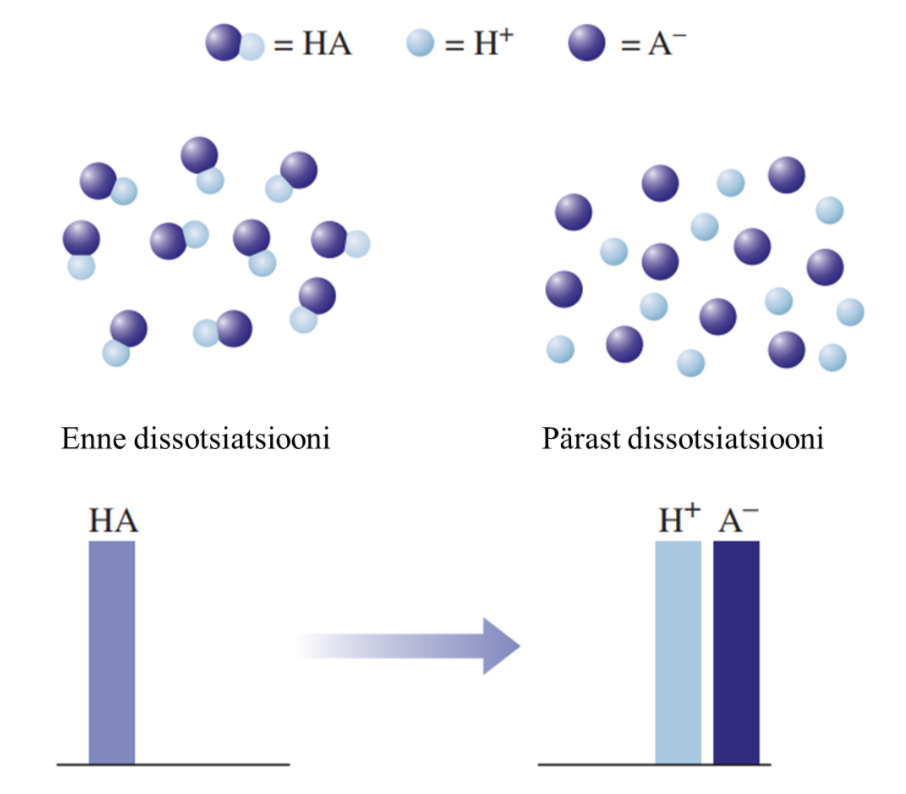
Graafiline esitus tugeva happe käitumise kohta vees: HA tähistab hapet, H+ vesinikioone, ja A- happejääkioone. Tugeva happe korral on näha, et hape on täielikult jagunenud ioonideks.
2) Nõrgad happed on vesilahuses vaid osaliselt ioonideks jagunenud (kõik happed, välja arvatud tugevad happed), nt H3PO4, H2SO3, H2S, H2CO3, H2SiO3.
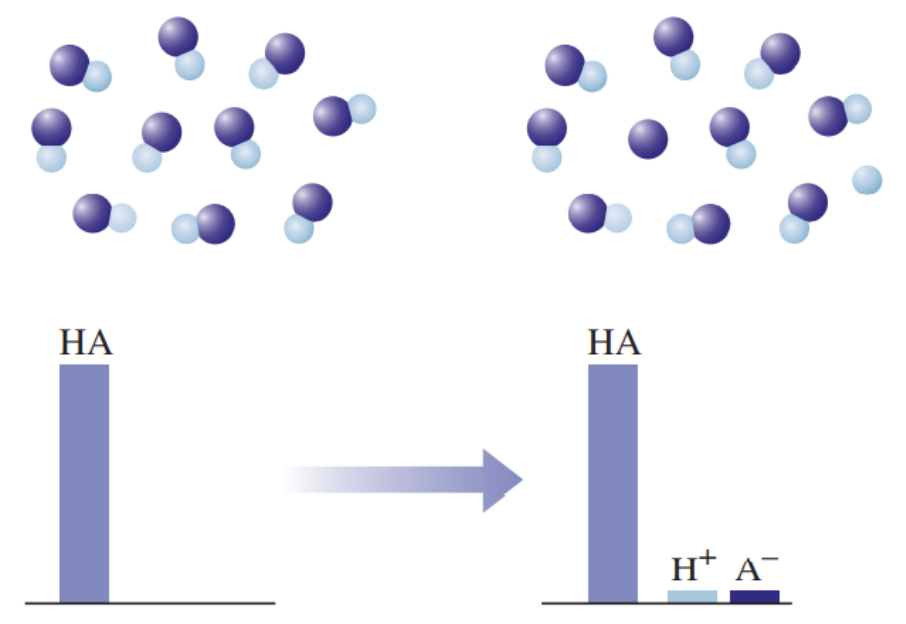
Graafiline esitus nõrga happe käitumise kohta vees: HA tähistab hapet, H+ vesinikioone, ja A- happejääkioone. Nõrga happe korral on näha, et ainult väga väike osa happest on jagunenud ioonideks.
Joonisel on välja toodud tugeva ja nõrga happe vesilahuste erinevuse mudel. Nõrga happe vesilahuses on olemas nii negatiivse laenguga happeanioonid, positiivse laenguga vesinikioonid kui ka happe molekulid, st happe molekulid on vaid osaliselt ioonideks jagunenud. Seevastu tugeva happe vesilahuses happemolekule ei ole, lahuses on vaid negatiivse laenguga happeanioonid ja positiivse laenguga vesinikioonid.
2. Prootonite arvu järgi
1) Üheprootonilised happed sisaldavad ühte vesinikiooni, nt HCl, HNO3.
2) Mitmeprootonilised happed sisaldavad mitut vesinikiooni, nt H2SO4, H3PO4.
3. Hapniku sisalduse järgi
1) Hapnikhapped sisaldavad hapniku aatomeid, nt H2SO4, H2SiO3.
2) Hapnikuta happed ei sisalda hapniku aatomeid, nt H2S, HCl.
Hapete keemilised omadused
HAPE + ALUS → SOOL + H2O
1. Hape reageerib alusega, tekivad sool ja vesi.
HCl + NaOH → NaCl + H2O
H2SO4 + 2LiOH → Li2SO4 + 2H2O
HAPE + METALL → SOOL + H2↑
2. Hape reageerib metalliga, tekivad sool ja vesinik.
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Zn + 2HCl → ZnCl2 + H2 ↑

Tsingi, magneesiumi, raua ja alumiiniumi reaktsioon 18%-lise HCl-lahusega
Kõik metallid ei reageeri hapetega ühtmoodi. Metallide võimet hapete lahustest vesinikku välja tõrjuda iseloomustab metallide pingerida:

Lahjendatud hapete lahustega reageerivad vesinikust aktiivsemad metallid (metallid, mis asuvad pingereas vesinikust vasakul pool).
HAPE + ALUSELINE OKSIID → SOOL + H2O
3. Hape reageerib aluselise oksiidiga, tekivad sool ja vesi.
See reaktsioon toimub alati.
2HCl + BaO → BaCl2 + H2O
CuO + H2SO4 → CuSO4 + H2O
3.3. Alused
Igapäevaelus kohtame aluseid harvemini kui happeid. Aluseid sisaldavad näiteks kodused puhastusvahendid. Alused on ained, mis annavad vesilahusesse hüdroksiidioone (OH--ioone). Tuntumad alused on hüdroksiidid, mis koosnevad metalli katioonist ja hüdroksiidioonist.
Kuidas aluseid nimetatakse ja millised on aluste keemilised omadused, vaata järgnevast videost.
Allikas: https://youtu.be/ANIUet7khb8
Nimetamine ja valemite koostamine
Aluste nimetuse üldkuju: metalli nimi + (o.a) + hüdroksiid
Aluste nimetamisel tuleb eelnevalt teada, kas alust moodustaval metallil on püsiv või muutuv oksüdatsiooniaste. Sellest tulenevalt on aluste nimetamiseks kaks võimalust:
1. Kui metallilisel elemendil on püsiv oksüdatsiooniaste, antakse nimetus järgmiselt: metalli nimi + hüdroksiid.
nt NaOH - naatriumhüdroksiid, Al(OH)3 - alumiiniumhüdroksiid
2. Kui metallilisel elemendil on muutuv oksüdatsiooniaste, määratakse kõigepealt metalli o.a ning siis antakse nimetus järgmiselt: metalli nimi + (o.a) + hüdroksiid.
nt CuOH - vask(I)hüdroksiid, Fe(OH)2 - raud(II)hüdroksiid.
Aluse valemi koostamist vaatame kaltsiumhüdroksiidi näite põhjal.
1. Valemi koostamisel kirjuta kõigepealt üksteise kõrvale metalli katioon ning seejärel hüdroksiidioon,
nt Ca2+ OH-.
2. Kuna ühend tervikuna peab olema neutraalne (kogu laeng peab = 0), tuleb "2+" laengule kõrvale võtta "2-" laengut. Seega tuleb hüdroksiidioone võtta 2 tükki. Tähtis on meeles pidada, et hüdroksiidioon on liitioon, mis koosneb hapnikust ja vesinikust, sellepärast pane OH--rühm sulgudesse.
Kogu eelnevat arutelu arvesse võttes on kaltsiumhüdroksiidi valem Ca(OH)2.
Liigitamine
Aluseid saab liigtada kaheks: tugevad ja nõrgad alused.
Tugevad alused ehk leelised on vees hästi lahustuvad hüdroksiidid. Tugevad alused on IA rühma ja IIA rühma alates Ca-st metallide hüdroksiidid (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2).
Nõrgad alused on vees mittelahustuvad hüdroksiidid, nt Fe(OH)2, Al(OH)3.
Aluste keemilised omadused
ALUS + HAPE → SOOL + H2O
1. Alused reageerivad hapetega, tekivad sool ja vesi.
NaOH + HCl → NaCl + H2O
2LiOH + H2SO4 → Li2SO4 + 2H2O
Seda reaktsiooni nimetatakse ka neutralisatsioonireaktsiooniks.
Vaata täpsemalt hapete peatükist.
ALUS + HAPPELINE OKSIID → SOOL + H2O
2. Alused reageerivad happeliste oksiididega, moodustuvad sool ja vesi.
2LiOH + CO2 → Li2CO3 + H2O
Ca(OH)2 + SO3 → CaSO4 + H2O
Pea meeles, et moodustuv sool koosneb aluse katioonist ja happelisele oksiidile vastava happe anioonist, mis on toodud hapete peatükis olevas tabelis.
ALUS $\xrightarrow[]{temp.}$ ALUSELINE OKSIID + H2O
3. Vees lahustumatud alused lagunevad kuumutamisel, tekivad aluseline oksiid ja vesi.
Fe(OH)2 $\xrightarrow{temp.}$ FeO + H2O
Cu(OH)2 $\xrightarrow{temp.}$ CuO + H2O
Ülesanne 3
3.4. Lahuste keskkond
Aluste ja hapete vesilahused on enamasti läbipaistvad. Kuidas saame neid siis üksteisest eristada? Siinkohal tulevad meile appi indikaatorid ning lahuste keskkond.
Allikas: https://youtu.be/YGIzUrZKzGQ
Lahus on ühtlane segu, mis koosneb lahustist ja vähemalt ühest seal lahustunud ainest, aga seda Sa juba teadsid. Lahuse keskkond võib olla happeline, aluseline või nende vahepealne ehk neutraalne. Happelist keskkonda põhjustavad vesilahuses olevad vesinikioonid (H+) ning aluselist keskkonda hüdroksiidioonid (OH−). Lahuse happelisuse või aluselisuse iseloomustamiseks kasutatakse suurust, mida nimetatakse pH. Lahuse pH väljendab vesinikioonide sisaldust lahuses. Vesilahuste korral jäävad pH väärtused vahemikku
0…14 ning pH-d saab kujutada skaalana, kus otspunktideks ongi 0 ja 14 ning keskkohaks 7.
Neutraalses lahuses on vesinikioone ja hüdroksiidioone sama palju ning neutraalse lahuse pH = 7. Neutraalne lahus on näiteks puhas vesi.
Happelises lahuses on vesinikioone rohkem kui hüdroksiidioone ning happelise lahuse pH < 7. Happeline lahus on näiteks söögiäädikas.
Aluselises lahuses on rohkem hüdroksiidioone kui vesinikioone ning aluselise lahuse pH > 7. Aluseline lahus on näiteks kanalisatsiooni puhastusvahend Torusiil.
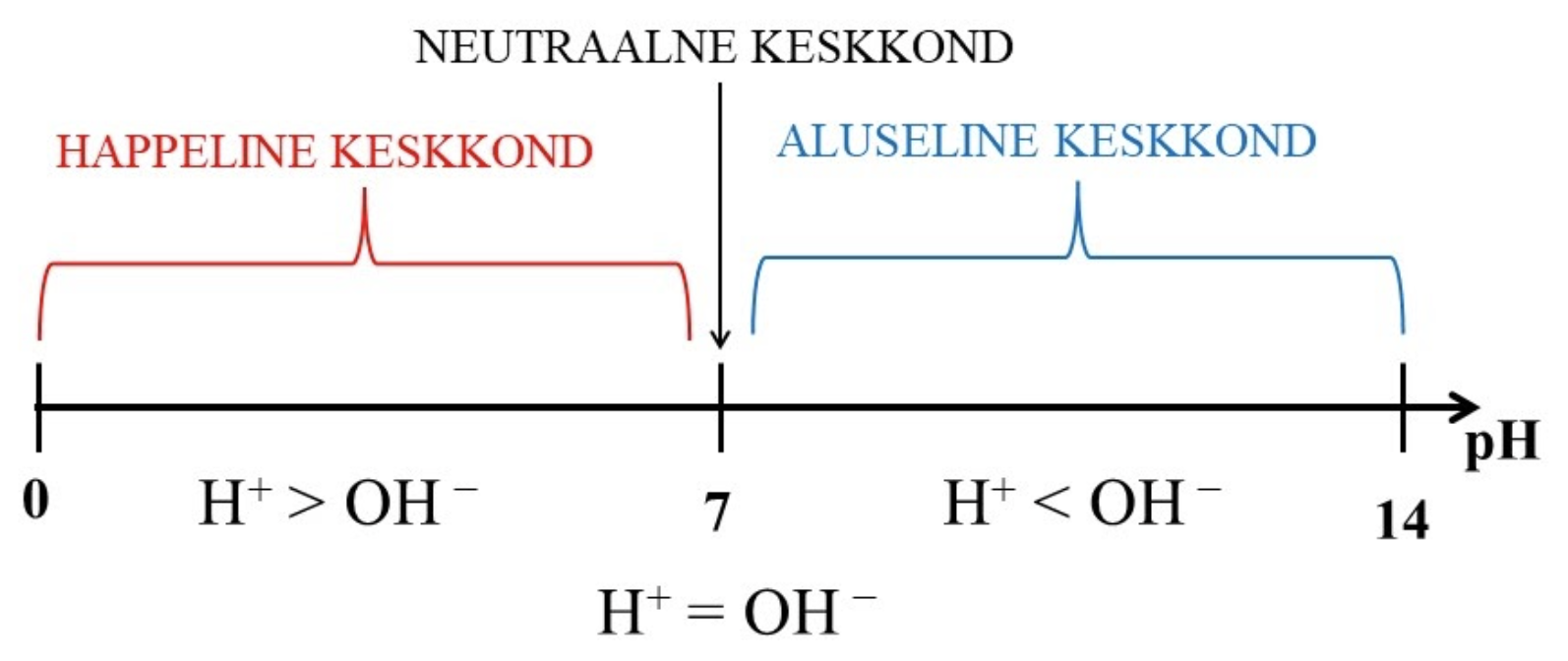
Siinkohal on oluline mõista, et mida väiksem on lahuse pH väärtus, seda happelisema lahusega on tegemist ja mida suurem on lahuse pH väärtus, seda aluselisem on lahus.
Kuidas määrata pH-d?
Lahuse pH määramiseks kasutatakse indikaatoreid. Indikaator on selline aine, mille värvus sõltub lahuse keskkonnast. Koolikeemias kõige kasutatavamad indikaatorid on metüüloranž, fenoolftaleiin ja universaalindikaator. Joonisel näed, millised on indikaatorite värvused erinevates keskkondades.
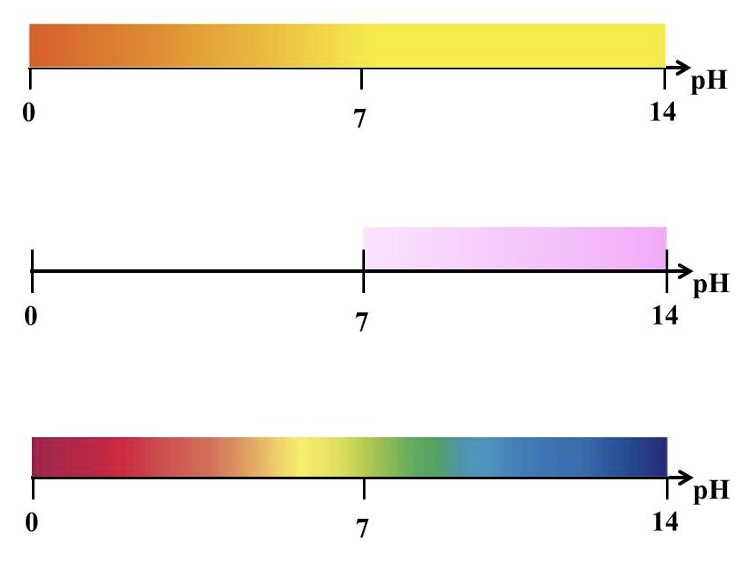
Üleval metüüloranž, keskel fenoolftaleiin ja all universaalindikaator
Universaalindikaatorit kasutades saad määrata lahuse ligikaudse pH, kuid pH täpsemaks määramiseks kasutatakse pH-meetrit – digitaalset seadet, mis mõõdab lahuse pH väärtuse.
3.5. Soolad
Soolad on igapäevaelus väga laialdaselt kasutuses. Näiteks toitu saad maitsetada soolaga, siin mõeldakse peamiselt naatriumkloriidi ehk NaCl. Kooki saad kergitada vesiniksoola ehk naatriumvesinikkarbonaadiga ehk NaHCO3-ga. Naatriumkloriidi ja kaaliumkloriidi (KCl) sisaldub mineraalvees Värska Originaal.
Soolad on ained, mis koosnevad metalli katioonist ja happejääkioonist ehk happeanioonist. Kuidas soolasid nimetada ja kuidas soolad tekivad, saada vaadata järgmisest videost.
Allikas: https://youtu.be/TQ-110H2mL8
Nimetamine
Soolade nimetamise üldkuju:
katiooni nimi + (o.a) + happejääkiooni nimi
Soolade nimetamisel tee kindlaks, millise metalli katioonist ja millise happe anioonist sool koosneb.
Soolade nimetamise üldkuju: katiooni nimi + (o.a) + happejääkiooni nimi
Happejääkioonide nimed on toodud hapete teema tabelis.
Soolade nimetamisel vaata eelnevalt, kas metalliiooni oksüdatsiooniaste on püsiv või muutuv. Sellest tulenevalt on kaks nimetamise reeglit.
1. Kui soola koostises oleval metallilisel elemendil on püsiv oksüdatsiooniaste, antakse nimetus järgmiselt: metalli nimi + happejääkiooni nimi,
nt NaCl - naatriumkloriid, AlBr3 - alumiiniumbromiid.
2. Kui soola koostises oleval metallilisel elemendil on muutuv oksüdatsiooniaste, antakse nimetus nii: metalli nimi + (o.a) + happejääkiooni nimi,
nt CuCO3 - vask(II)karbonaat, Fe2(SO4)3 - raud(III)sulfaat.
Valemite koostamine
Soola valemi koostamist vaatame kahe näite põhjal.
1. näide. Kirjuta kaltsiumkloriidi valem
- Kirjuta kõigepealt üksteise kõrvale metalli katioon ning seejärel happejääkioon: Ca2+ Cl-.
- Võrdsusta positiivsed ja negatiivsed laengud, et ühend oleks tervikuna neutraalne. Antud näites tuleb anioone võtta 2 tükki.
- Eelnevat arvesse võttes on kaltsiumkloriidi valem CaCl2.
2. näide. Kirjuta raud(III)sulfaadi valem.
- Kirjuta kõigepealt üksteise kõrvale metalli katioon ning seejärel happejääkioon: Fe3+ SO42-.
-
Võrdsusta positiivsed ja negatiivsed laengud, et ühend oleks tervikuna neutraalne. Antud näites tuleb katioone võtta 2 ja anioone võtta 3 tükki.
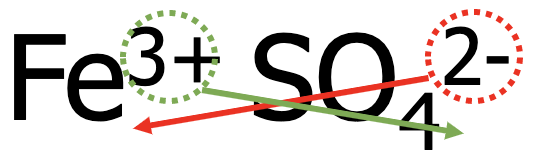
- Eelnevat arvesse võttes on raud(III)sulfaadi valem: Fe2(SO4)3.
Ülesanne 2
Liigitamine
Lihtsoolad koosnevad metalliioonist ja „tavalisest“ happejääkioonist (vt hapete teema tabelit).
Vesiniksoolad koosnevad metalliioonist ja happejääkioonist, mis sisaldab ka vesinikku. Vesinikku sisaldavaid happejääkioone annavad lahusesse mitmeprootonilised happed. Tuntuim vesiniksool on naatriumvesinikkarbonaat (NaHCO3) ehk söögisooda. Vesiniksoolad tekivad aluse ja happe vahelisel reaktsioonil, kui alust ei ole piisavalt happe täielikuks neutraliseerimiseks. Näiteks süsihappe ja kaaliumhüdroksiidi vahelise reaktsiooni tulemusena võib moodustuda nii kaaliumkarbonaat kui ka kaaliumvesinikkarbonaat.
H2CO3 + KOH → KHCO3 + H2O
kaalimvesinikkarbonaat - vesiniksool
H2CO3 + 2KOH → K2CO3 + 2H2O
kaaliumkarbonaat - lihtsool
Nagu näha, kulub ühe osa kaaliumkarbonaadi tekkimiseks 2 osa kaaliumhüdroksiidi, kuid kaaliumvesinikkarbonaadi tekkimiseks kulub vaid üks osa kaaliumhüdroksiidi.
Happed, mis tekitavad vesiniksoolasid ning hapetele vastavad happejääkioonid
|
Hape |
-1 H+ |
-2 H+ |
-3 H+ |
|
H2CO3 |
HCO3- vesinikkarbonaatioon |
CO32- karbonaatioon |
- |
|
H3PO4 |
H2PO4- divesinikfostaatioon |
HPO42- vesinikfostaatioon |
PO43- fosfaatioon |
|
H2SO3 |
HSO3- vesiniksulfitioon |
SO32- sulfitioon |
- |
Neutralisatsioonireaktsioon
Sa oled tuttav juba aluste ja hapete aineklassiga. Mis aga juhtub siis, kui aluse ja happe lahus kokku valada?
Allikas: https://youtu.be/LTnw48BpkwM
Happe ja aluse vaheline reaktsioon on neutralisatsioonireaktsioon. Sa tead juba, et happed on ained, mis annavad vesilahusesse vesinikioone ning alused annavad lahusesse hüdroksiidioone. Siinkohal tähendabki neutraliseerimine olukorda, kus happele on lisatud nii palju alust, et lahuses olevate vesinikioonide happelist mõju vähendatakse hüdroksiidioonidega ning lahus muutub neutraalseks (süsteem toimib ka vastupidi – alusele hapet lisades).
Aluse ja happe vaheline reaktsioon toimub alati, olenemata alusest või happest, mida kasutatakse.
Neutralisatsioonireaktsioon on vahetusreaktsioon, mis tähendab seda, et aluse ja happe samalaengulised ioonid vahetavad kohad. Võttes näiteks liitiumhüdroksiidi ja väävelhappe vahelise reaktsiooni, vahetame positiivsete ioonide asukohad.
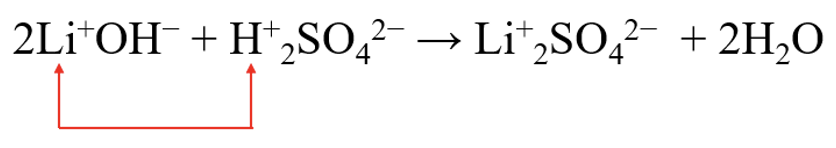
Seega tekivad meile saadustena liitiumsulfaat ja vesi.
2LiOH + H2SO4 → Li2SO4 + 2H2O
Samamoodi toimime kaltsiumhüdroksiidi ja vesinikkloriidhappe vahelise reaktsioonivõrrandi kirjutamisel ehk vahetame kaltsiumiooni ja vesinikiooni asukohad ning selle tulemusel tekivad kaltsiumkloriid ja vesi.
Ca(OH)2 + 2HCl → CaCl2 + H2O
Soolade saamine
Keemilisi reaktsioone, mille käigus soolad moodustuvad, oleme juba oksiidide, hapete ja aluste osas käsitlenud, aga olgu need siin kokkuvõtlikult uuesti kirjas.
1. HAPE + ALUS → SOOL + H2O
HCl + NaOH → NaCl + H2O
See reaktsioon toimub alati.
2. HAPE + METALL → SOOL + H2↑
3H2SO4 + 2Al → Al2(SO4)3 + 3H2↑
See reaktsioon ei toimu alati. Lahjendatud hapetega reageerivad vaid need metallid, mis on vesinikust aktiivsemad ehk asuvad metallide elektrokeemilise aktiivsuse reas vesinikust eespool ehk vesinikust vasakul pool (vt hapete teemat).
3. HAPE + ALUSELINE OKSIID → SOOL + H2O
2HNO3 + CaO → Ca(NO3)2 + H2O
See reaktsioon toimub alati.
4. ALUS + HAPPELINE OKSIID → SOOL + H2O
2LiOH + CO2 → Li2CO3 + H2O
See reaktsioon toimub alati.
5. ALUSELINE OKSIID + HAPPELINE OKSIID → SOOL
CaO + CO2 → CaCO3
See reaktsioon toimub alati ning tekib happelisele oksiidile vastava happe sool.
Ülesanne 5
3.6. Aineklasside vahelised seosed
Kuidas saada happest soola või aluselisest oksiidist alust? Anorgaaniliste ainete vahelistest seostest saad ülevaate järgmisest videost.
Allikas: https://youtu.be/vTmaYTCx-sk
Seoseid aineklasside vahel nägid juba eelmistes teemades. Toome need siin veelkord ära, nüüd kokkuvõtlikult tabelina.
|
Reaktsioon |
Näited |
|
LIHTAINE + HAPNIK → OKSIID |
C + O2 → CO2 2Ca + O2 → 2CaO |
| Selgitus: Toimub peaaegu alati. Hapnikuga ei reageeri väärismetallid (Au, Pt), väärisgaasid. | |
|
HAPPELINE OKSIID + VESI → HAPE |
CO2 + H2O → H2CO3 SO2 + H2O → H2SO3 |
| Selgitus: Erandina ei reageeri veega SiO2. Happelise oksiidi ja happe koostises oleva mittemetallilise elemendi o.a ei muutu (nt CO2, H2CO3 – mõlemas aines on C o.a IV). | |
|
ALUSELINE OKSIID + VESI → LEELIS |
CaO + H2O → Ca(OH)2 Na2O + H2O → 2NaOH |
| Selgitus: Veega reageerivad ainult tugevalt aluselised oksiidid. Tugevalt aluselised oksiidid on IA rühma metallide ja IIA rühma metallide oksiidid, välja arvatud BeO ja MgO. Reaktsiooni tulemusel tekib tugev alus ehk leelis. | |
|
ALUS + HAPE → SOOL + VESI |
NaOH + HCl → NaCl + H2O Ca(OH)2 + H2SO4 → CaSO4 + 2H2O |
| Selgitus: Tegemist on neutralisatsioonireaktsiooniga. Toimub alati. | |
|
HAPPELINE OKSIID + ALUS → SOOL + VESI |
SO2 + Ca(OH)2 → CaSO3 + H2O CO2 + 2NaOH → Na2CO3 + H2O |
| Selgitus: Tekib happelisele oksiidile vastava happe sool. Happelise oksiidi ja happe koostises oleva mittemetallilise elemendi o.a ei muutu (nt CO2, H2CO3 – mõlemas aines on C o.a IV). Toimub alati. | |
|
ALUSELINE OKSIID + HAPE → SOOL + VESI |
Li2O + H2SO4 → Li2SO4 + H2O CaO + 2HCl → CaCl2 + H2O |
| Selgitus: Tugevalt aluseliste oksiididega toimub reaktsioon energiliselt, nõrgalt aluseliste puhul võib olla vajalik kuumutamine. Toimub alati. | |
|
ALUSELINE OKSIID + HAPPELINE OKSIID → SOOL |
BaO + CO2 → BaCO3 Na2O + SO2 → Na2SO3 |
| Selgitus: Aktiivsemate oksiididega toimub reaktsioon kiiremini, vähemaktiivsetega on vajalik kuumutamine. Tekib happelisele oksiidile vastava happe sool. Toimub alati. | |
| METALL + HAPE → SOOL + VESINIK |
Ca + H2SO4 → CaSO4 + H2↑ 2Na + 2HCl → 2NaCl + H2↑ |
| Selgitus: Lahjendatud hapetega reageerivad metallide elektrokeemilises aktiivsuse reas vaid vesinikust aktiivsemad metallid (st vesinikust eespool). | |
| ALUS $\xrightarrow{temp.}$ OKSIID + VESI |
Fe(OH)2 $\xrightarrow{temp.}$ FeO + H2O Cu(OH)2 $\xrightarrow{temp.}$ CuO + H2O |
| Selgitus: Kuumutamisel lagunevad vaid vees lahustumatud hüdroksiidid. IA rühma hüdroksiidid ei lagune kuumutamisel. Mida väiksema aktiivsusega on metall, seda kergemini tema hüdroksiid kuumutamisel laguneb. | |