2. Keemia keel
2.1. Aatomitest aineteni
Keemia uurimisobjektiks on ained ja nendega toimuvad muundumised. Ained koosnevad aineosakestest ja just aineosakesed kujundavad ainete omadused ning põhjustavad nende muundumisi. Seetõttu tulebki õppida aineosakesi tundma ja selles aitab Sind allolev video.
Allikas: https://youtu.be/DTwdlVdi1pM
Ained koosnevad aineosakestest. Aineosakesed võivad olla aatomid, molekulid või ioonid. Aatom on väikseim aineosake, mis koosneb aatomituumast ja elektonkattest. Aatomituum omakorda koosneb prootonitest ja neutronitest, elektonkatte moodustavad aga elektronkihtidel paiknevad elektronid.
|
AATOM |
|
|
Aatomituum |
Elektronkate |
|
Prootonid (laeng +1, mass 1 amü) Neutronid (laeng 0, mass 1 amü) |
Elektronid (laeng -1, mass ≈ 0,0005 amü) |
 Elektrone ja prootoneid on aatomis sama palju ja seetõttu on aatom tervikuna neutraalne.
Elektrone ja prootoneid on aatomis sama palju ja seetõttu on aatom tervikuna neutraalne.
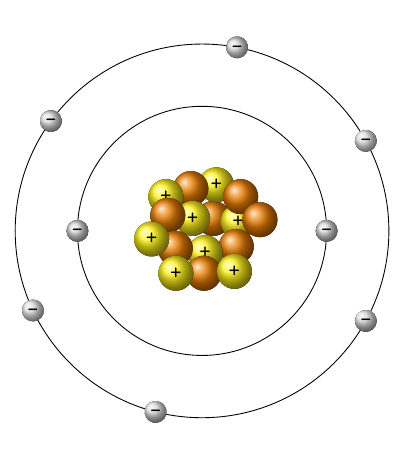
Näiteks hapniku aatomit kirjeldab kõrvalolev mudel. Sellelt saad näha, et hapniku aatomituumas paikneb 8 prootonit (joonisel kollased pallikesed) ja 8 neutronit (joonisel oranžid pallikesed) ning elektronkatte kahes kihis kokku 8 elektroni (joonisel hallid pallikesed): 1. elektronkihil 2 ja välimisel kihil 6 elektroni.
Aatomite massi väljendatakse aatommassiühikutes (amü). Üks aatommassiühik võrdub 1/12 süsiniku aatomi massist. Kuna elektronide mass on niivõrd väike, kuid prootonite ja neutronite mass on võrdne ühe aatommassiühikuga, saab öelda, et aatomi mass on koondunud tema tuuma.
Ühte liiki aatomitest moodustub keemiline element. Kõik keemilised elemendid on paigutatud keemiliste elementide perioodilisustabelisse. Perioodilisustabelis on liigitatud elemendid kahte gruppi, lähtuvalt nende lihtainete keemilistest omadustest: metallilised elemendid ja mittemetallilised elemendid. Tabeli vasakul pool on metallilised ja paremal mittemetallilised elemendid.
Metalliliste elementide lihtainetel on metallidele iseloomulikud omadused. Metallide kasutamine igapäevaelus lähtubki just nende omadustest. Näiteks
|
Füüsikaline omadus |
Kasutusvaldkond |
|
Hea elektrijuhtivus |
Elektrijuhtmete valmistamiseks (vask) |
|
Hea soojusjuhtivus |
Radiaatorite ja sööginõude valmistamiseks (malm) |
|
Metalne läige |
Peeglite valmistamiseks (alumiinium) |
|
Plastilisus ja hea töödeldavus |
Alumiiniumfooliumi, traadi (nikkel), masinaosade (teras) valmistamiseks |
Mittemetallidel puuduvad metallidele iseloomulikud omadused ja omavahel on nad vähem sarnased kui metallid, aga siiski saab välja tuua, et mittemetallid reeglina ei juhi elektrit, on halvad soojusjuhid ning neil puudub metalne läige. Argielus kasutatakse mittemetalle metallidest vähem. Mõned näited: hapnik - hingamiseks ja põlemisprotsessides; vesinik - kütusena; kloor - basseinivee desinfitseerimiseks.
 Korda videost enam kasutatavate elementide nimetusi ja sümboleid.
Korda videost enam kasutatavate elementide nimetusi ja sümboleid.
Selle jaoks, et keemia maailmas paremini hakkama saada, tuleb teada enam kasutatavate elementide nimetusi ja sümboleid.
Aatomi ehituse kohta leiad vajalikku informatsiooni perioodilisustabelist, kui tead järgmisi seoseid:
- elemendi aatomnumber (Z) = tuumalaeng (+) = prootonite arv (p) tuumas = elektronide arv (e-) elektronkattes;
- elemendi massiarv = täisarvuks ümardatud aatommass = prootonite arv + elektronide arv;
- eelmisest seosest tuleneb: neutronite arv = massiarv – prootonite arv;
- perioodi number = elektronkihtide arv elektronkattes;
- rühma number (A-rühmades) = väliskihi elektronide arv. B-rühmade elementide väliskihil on reeglina 2 elektroni.
Aatomite elektronkatte ehituse kirjeldamiseks kasutatakse elektronskeeme. Selleks, et elektronskeemi koostada, pead teadma järgmist:
- 1. elektronkihis saab olla kuni 2 elektroni.
- 2. elektronkihis saab olla kuni 8 elektroni.
- 3. elektronkihis saab olla kuni 18 elektroni.
- 4. elektronkihis saab olla kuni 32 elektroni.
- väliskihis saab olla alati kuni 8 elektroni.
Näiteks magneesiumi elektronskeem on järgmine:
Mg:+12|2)8)2)
Arseenil: As:+33|2)8)18)5)
Molekulid on aineosakesed, mis koosnevad aatomitest. Molekuli koostist kirjeldab molekulivalem, mis näitab, milliste elementide aatomitest (väljendab elemendi sümbol valemis) ja kui paljudest (väljendab indeks) molekul koosneb.
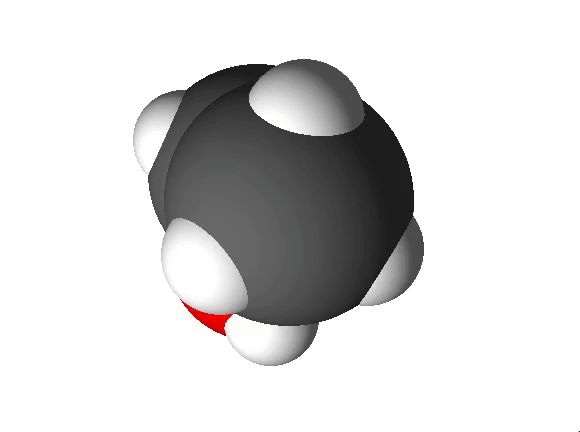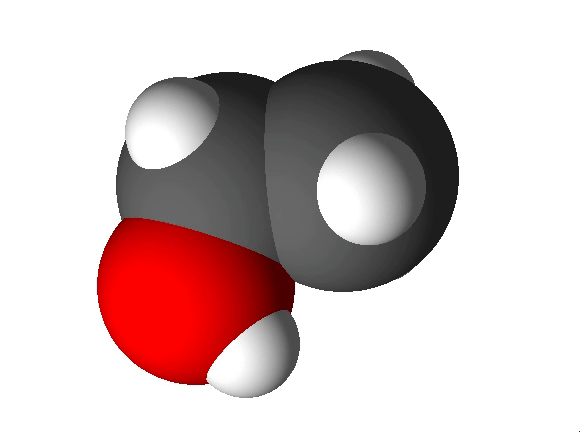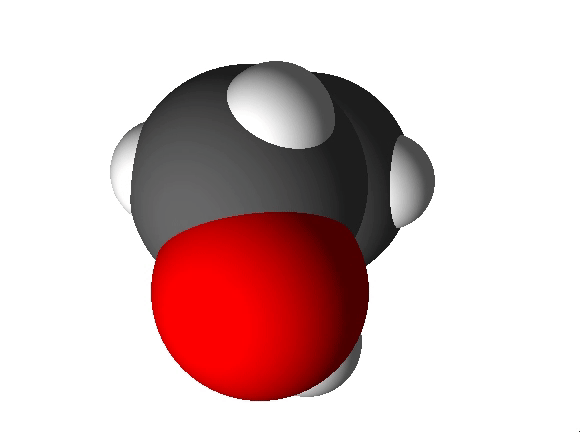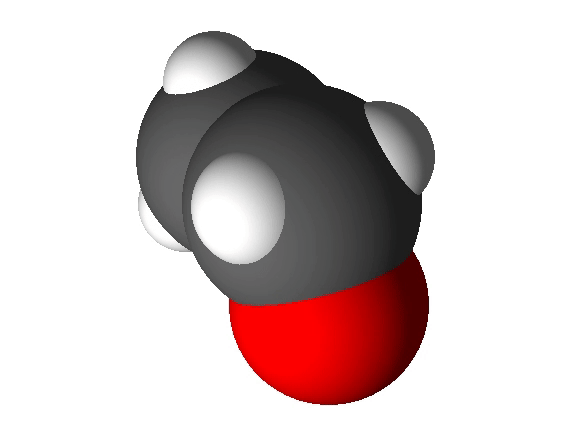 Näiteks näitab etanooli molekulivalem (C2H5OH), et molekul koosneb kolme erineva elemendi aatomitest: 2 süsiniku aatomist, 6 vesiniku aatomist ja 1 hapniku aatomist.
Näiteks näitab etanooli molekulivalem (C2H5OH), et molekul koosneb kolme erineva elemendi aatomitest: 2 süsiniku aatomist, 6 vesiniku aatomist ja 1 hapniku aatomist.
Aatomite ja molekulide kõrval esineb ka kolmas liik aineosakesi – ioonid. Ioon on laetud (laenguga) aineosake. Ioonid tekivad aatomitest elektronide liitmise või loovutamise teel. Liidetakse või loovutatakse nii mitu elektroni, et välises elektronkihis oleks 8 elektroni (maksimaalselt täidetud välimine elektronkiht). Need elemendid, mille välimises elektronkihis on vähe elektrone (1-3 e-), loovutavad need ja nii tekib positiivse laenguga ioon ehk katioon. Elemendid, mille välises elektronkihis on aga palju elektrone (5-7 e-), liidavad elektrone, omandades seejuures negatiivse laengu ja tekib anioon.
Kirjeldame näiteks aniooni teket väävli aatomist:
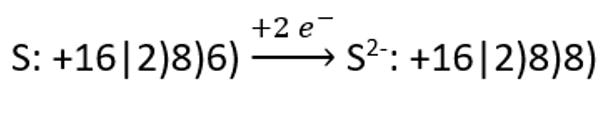
ja katiooni teket alumiiniumi aatomist:
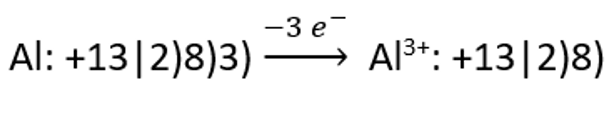
2.2. Aineosakesed
Meid ümbritsevate ainete maailm on väga mitmekesine: metallid esinevad lihtainetena, vesi ja süsihappegaas on aga liitained. Nende terminite mõistmiseks vaata läbi järgnev video.
Allikas: https://youtu.be/MnXnHY4tOjA
Selle alusel, kas ainet moodustavad aatomid on samasugused või erinevad, jaotatakse kõik ained liht- ja liitaineteks. Lihtaine koosneb sama elemendi aatomitest (näiteks N2, O3, S8). Liitaine koosneb erinevate elementide aatomitest (näiteks CO2, H2SO4, C6H12O6).

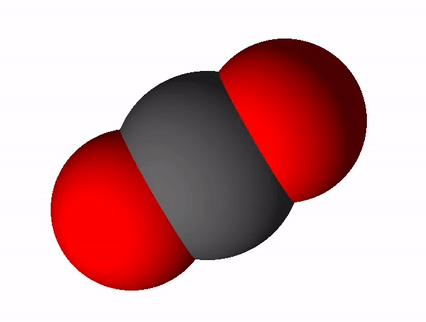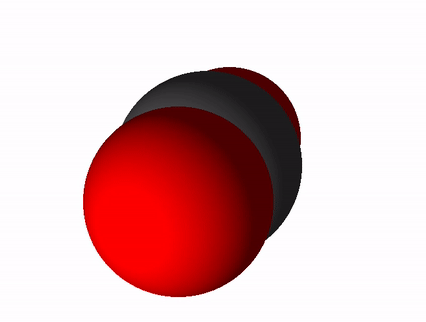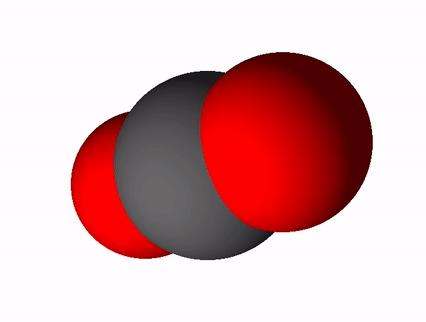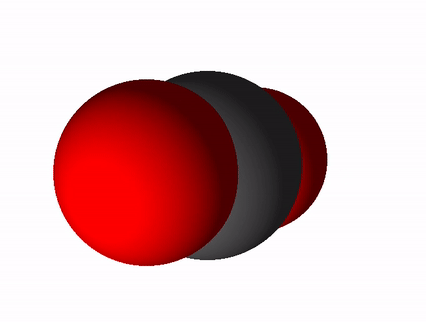
 Aineid saab nende koostisest lähtuvalt liigitada ka puhasteks aineteks ja segudeks. Puhas aine koosneb ainult ühe aine osakestest (kas aatomitest, molekulidest või ioonidest) ja tal on kindel koostis ning kindlad omadused. Puhtad ained on näiteks destilleeritud vesi, kuld, hapnik, glükoos.
Aineid saab nende koostisest lähtuvalt liigitada ka puhasteks aineteks ja segudeks. Puhas aine koosneb ainult ühe aine osakestest (kas aatomitest, molekulidest või ioonidest) ja tal on kindel koostis ning kindlad omadused. Puhtad ained on näiteks destilleeritud vesi, kuld, hapnik, glükoos.
 Segu koosneb aga mitme eri aine osakestest ja tal pole kindlat koostist ega ka kindlaid omadusi. Segud on näiteks õhk, looduslik vesi, pronks, puit.
Segu koosneb aga mitme eri aine osakestest ja tal pole kindlat koostist ega ka kindlaid omadusi. Segud on näiteks õhk, looduslik vesi, pronks, puit.
Molekulaarne aine koosneb molekulidest. Molekulaarsetes ainetes esineb molekuli moodustavate aatomite vahel kovalentne side ja molekulide endi vahel molekulidevahelised jõud. Molekulaarsete ainete hulka kuuluvad näiteks O2, N2, CO2, H2O, C2H5OH.
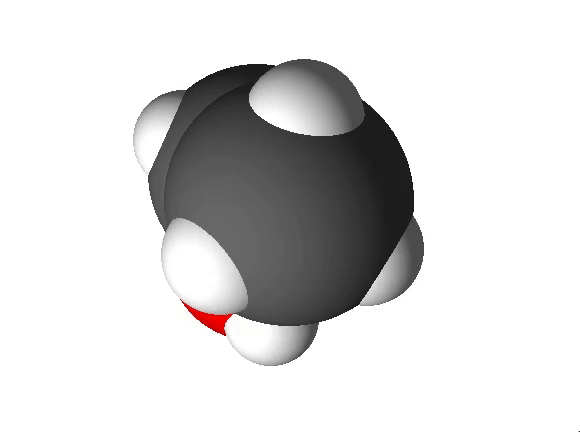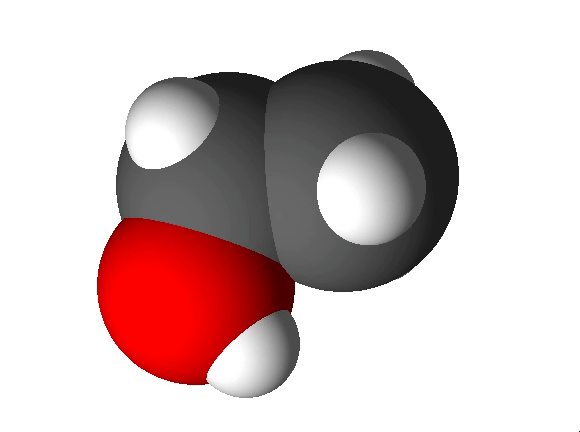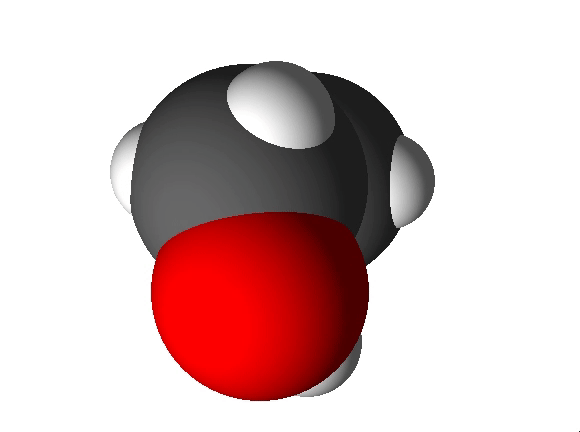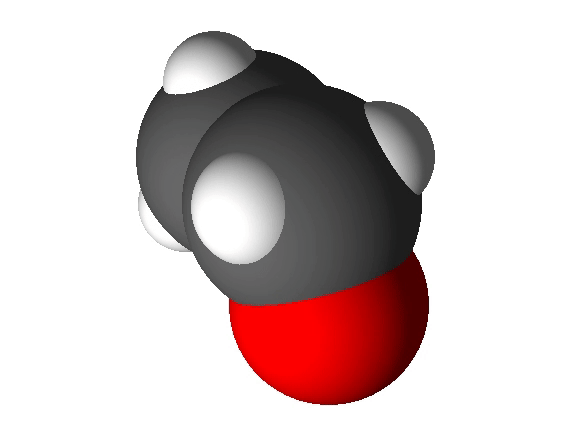
Mittemolekulaarne aine koosneb aatomitest või ioonidest. Mittemolekulaarsetes ainetes seob aineosakesi reeglina iooniline või metalliline side. Mittemolekulaarsete ainete hulka kuuluvad metallid (nt Fe, Al) ning soolad (nt CaCO3, NaCl). Nendest annab ülevaate järgnev video.
Allikas: https://youtu.be/kb8GfYmXnc8
2.3. Keemilised sidemed
Keemiliste sidemete abil moodustuvad aineosakestest erinevad ained. Millised võimalused on keemiliste sidemete tekkeks, tutvustab Sulle järgnev video.
Allikas: https://youtu.be/59Zr7-zeJ8I
Keemiline side on vastastikmõju, mis ühendab aatomid või ioonid molekuliks või kristalliks. Keemilise sideme moodustumisega püüavad osakesed saavutada täielikult täidetud (8 elektroni) välist elektronkihti, sest selline olek on püsivaim. Nendel elementidel, mille elektronkattes on ainult üks elektronkiht, on täielikult täidetud elektronkihil 2 elektroni. Keemilise sideme liigid on kovalentne side, iooniline side ja metalliline side. See, milline side tekib, sõltub sellest, millised keemilised elemendid omavahel sideme moodustavad.
Kovalentne side on ühiste elektronpaaride abil moodustunud keemiline side. Kovalentne side tekib enamasti mittemetalliliste elementide aatomite vahel, kui aatomid moodustavad väliskihi üksikute elektronide abil ühise(d) elektronpaari(d). Maksimaalselt võib moodustuda kahe aatomi vahel kolmekordne side.
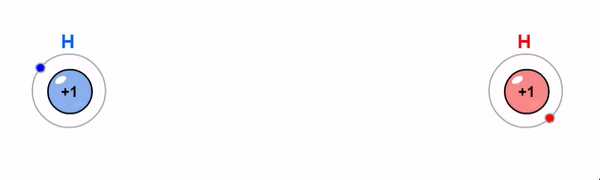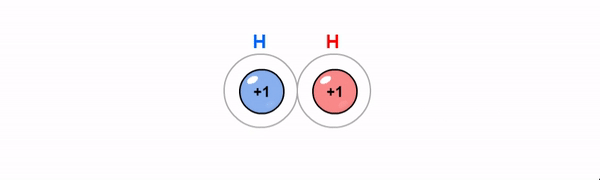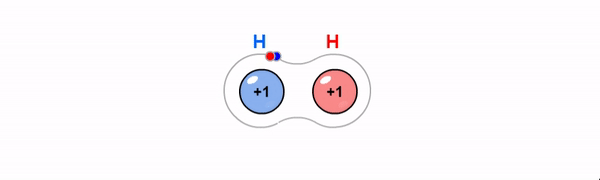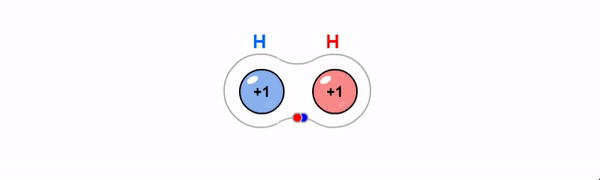
Iooniline side on vastasmärgiliste laengutega ioonide tõmbumine. Iooniline side tekib, kui metalli aatomid loovutavad oma elektronkatte väliskihist elektrone mittemetalli aatomite elektonkatte väliskihti.

Metalliline side esineb metallide lihtainetes. Metalliside moodustub metalli kristallvõres paiknevate positiivsete ioonide ja nende ioonide vahel liikuvate ühiste vabade elektronide omavahelisel tõmbumisel.

Ainete omadused sõltuvad nende ehitusest. Seejuures on väga oluline, kas aine koosneb molekulidest või mitte. Sellest lähtuvalt saabki ained liigitada molekulaarseteks ja mittemolekulaarseteks.
2.4. Oksüdatsiooniaste
Oksüdatsiooniaste (o.a) näitab elemendi laengu suurust ühendis eeldusel, et aine koosneb ioonidest. Erinevalt iooni laengust märgitakse oksüdatsiooniaste rooma numbriga.
Oksüdatsiooniastme määramisel on oluline teada järgnevaid reegleid:
- elemendi o.a lihtainetes on alati 0;
- hapniku (O) o.a ühendites on –II;
- vesiniku (H) o.a ühendites on I;
- IA; IIA ja IIIA rühma elementidel on o.a ühendites võrdne rühma numbriga (näiteks Na o.a ühendis on I, Mg o.a ühendis on II ja Al o.a ühendis on III);
- B-rühmade elementidel on muutuvad o.a-d, aga enamikul neist on üheks võimalikuks o.a-ks II.
Allikas: https://youtu.be/H8ktQvCOcyw
Kuidas o.a-d leida?
- Märgi ühendis iga elemendi kohale, mille o.a-d kindlalt tead, tema o.a.
- Märgi ühendis iga elemendi alla laengud, arvestades indekseid.
- Pane tähele, et laengute kogusumma peab olema alati 0.
- Arvuta o.a elemendile, mida Sa veel ei tea.
Näide:
Leiame ühendis SO2 kõigi elementide o.a-d. Kuna tegemist on liitainega, siis eirame lihtaine reeglit. Vääveldioksiidi koostises on hapnik, mille oksüdatsiooniastet me teame ja selle saame märkida hapniku sümboli kohale:
−II
SO2
Kuna ühendis on 2 hapniku aatomit, siis kumbki panustab ühendisse laenguga -2, seega: -2$\times$ 2 = − 4 ja selle saame märkida vastava elemendi sümboli alla:
−II
SO2
−4
Selle jaoks, et molekul koos püsiks, peab tema kogulaeng olema 0. Kuna juba on olemas −4 laengut, siis 0 saamiseks tuleb talle kõrvale saada +4 laengut, järelikult:
−II
SO2
+4 −4
Kui laengute kogusumma on 0, saame leida otsitava elemendi o.a, võttes arvesse, mitu aatomit on ühendis. Antud juhul on ainult 1 väävli aatom, seega tuleb väävli o.a-ks
IV −II
SO2
+4 −4