1. Millega tegeleb keemia?
Selles peatükis tegeled enam kasutatavate katsevahendite ja olulisemate reeglitega, millega peab katsetades arvestama, et mitte ennast ja teisi ohustada. Üle saavad korratud füüsikalised ja keemilised nähtused ning reaktsioonide kulgemise tunnused ja tingimused. Samuti saad selgeks levinumate gaaside omadused, nende saamise ja kogumise.
1.1. Laborivahendid ja ohutustehnika
Keemia on eksperimentaalteadus ning sellest tulenevalt on oluline teada, milliste vahenditega ja kuidas katseid ohutult ja mõistlikult läbi viia.
Enim kasutatavad katsevahendid koos oluliste töövõtetega on toodud videos.
Allikas: https://youtu.be/nY4gRfL3xNA
Laboris kasutatakse kindla otstarbega aineid ja segusid, mida nimetatakse kemikaalideks. Sageli kasutatakse ka terminit "reaktiiv". Kemikaal ei ole midagi ebatavalist: oma igapäevaelus kohtad Sa neid päris mitmeid, näiteks erinevad lahustid värvide jaoks, koduses majapidamises leiduvad puhastusvahendid, äädikas, lilleväetised, aga ka paljud teised ained. Kuna mõningad kemikaalid võivad olla ohtlikud nii kasutajale kui ka keskkonnale, kasutatakse selle rõhutamiseks ohumärke. Ohumärkidest saab kasutaja infot, kuidas reaktiiviga ohutult ringi käia. Enam levinud ohumärgid on järgmised: söövitav, plahvatusohtlik, tuleohtlik, mürgine, keskkonnaohtlik, nahka ärritav ja tervisele ohtlik.

Kemikaalidega ohutult töötamise võtmeks on rahulik ja läbimõeldud tegutsemine. Laboris töötades hoia oma töölaud korras ja katsete läbiviimisel lähtu juhendist või õpetaja selgitustest. Katseid tee ainult laua kohal ja ettenähtud kemikaalikoguste ning katsevahenditega. Vedelikke vala peene joana ning väldi kemikaali sattumist pudeli sildile, selleks hoia silti suunaga ülespoole. Reaktiivipudeli kork aseta lauale tagurpidi ning sulge pudel kohe pärast sealt aine võtmist. Kuumutamisel ole eriti hoolikas: kasuta põletit või piirituslampi ainult selleks vajalikul ajal, lahtine leek on väga suur ohuallikas. Kui mõni reaktiiv peaks sattuma nahale või riietele, pese seda kohta kohe suure hulga veega ning jälgi õpetaja edasisi juhiseid.
Keemialaboris on rangelt keelatud söömine, joomine ja ainete maitsmine ning laboris liikumise eesmärgil ei tohi vahekäikudes olla takistusi, näiteks koolikotte.
Vaatame nüüd üle põhilised laborivahendid ja selgitame, millistes olukordades ja kuidas neid kasutada.
-
 Katseklaasi kasutatakse katsete tegemisel väikeste ainekogustega ning selles võib ka aineid kuumutada. (Foto)
Katseklaasi kasutatakse katsete tegemisel väikeste ainekogustega ning selles võib ka aineid kuumutada. (Foto)
- Keeduklaasi kasutatakse nii katsete tegemisel kui ka lahuste valmistamisel ning kuumutada võib keeduklaase ainult läbi vastava võrgu. (Foto)
- Kolbe on väga erineva kujuga, nii ümarkolbe kui ka koonilisi kolbe ja neid kasutatakse lahuste valmistamiseks ning säilitamiseks. Neis saab lahuseid ka lahuste kuumutada, kuid seda vaid läbi võrgu. (Foto)
- Statiivi kasutatakse katsevahendite kinnitamiseks. Statiiv koosneb statiivialusest, statiivivardast, muhvist ja muhvi vahele kinnitatavast käpast või rõngast. Rõnga peale saab asetada kuumutusvõrgu, mille läbi saab näiteks ümarseisukolvis olevat lahust soojendada. Käpa vahele saab kinnitada erinevaid katsevahendeid, näiteks kolbe või katseklaase. (Foto)
- Mõõtesilindrit kasutatakse vedelikukoguste mõõtmisel. Mõõtesilindril oleva skaala lugemiseks tuleb silmad viia vedelikunivooga samale tasandile ning lugeda skaalal näit vedelikukaare ehk meniski põhjast. (Foto)
- Pipetti kasutatakse vedelikukoguste mõõtmiseks ja lisamiseks. On olemas nii tilgapipette, mis on skaalata ja väikeste ainekoguste lisamiseks, kui ka klaas- või plastikpipette, mis on skaalaga ning mida kasutatakse vedelike ruumala täpsemaks mõõtmiseks. (Foto)
- Lehtrit kasutatakse vedelike valamisel ühest anumast teise ning filtrimisel. Filtrimisel asetatakse lehtri sisse eelnevalt volditud filterpaber ning seejärel filtreeritakse näiteks porilombi veest välja tahked suuremamõõtmelised osakesed. (Foto)
- Põletit ja piirituslampi kasutatakse ainete kuumutamiseks. Koolilaboris puutud Sa kokku rohkem piirituslambiga. Sellega töötamiseks tuleb kõigepealt piirituslambilt eemaldada kate ja süüdata seejärel taht tikuga. Kustutamisel tuleb asetada kate leegile. Elava tulega tuleb olla ettevaatlik: pikad juuksed ja lehvivad varrukad võivad kergesti süttida. Põletit kasutatakse eelkõige katseklaasis olevate ainete kuumutamisel. Kuna klaas on küllaltki hea soojusjuht, tuleb katseklaasi hoida katseklaasihoidja vahel, kusjuures katseklaas peaks olema kuni maksimaalselt kolmandiku ulatuses täidetud. Katseklaasi tuleb põleti leegis kuumutamise ajal liigutada, hoides katseklaasi kaldu ning selle suue peab olema suunatud endast ja kaaslastest eemale, sest kuumutatav vedelik võib katseklaasist välja paiskuda. (Foto)
- Uhmer ja nui on meeskond. Neid kasutatakse tahkete ainete peenestamisel. Selleks, et peenestada ainet, tuleb nuiaga teha ringjaid survestatud liigutusi mööda uhmri pinda. (Foto)
- Portselankaussi kasutatakse vedelike kuumutamiseks ja aurustamiseks. Portselankauss talub küll suuremat kuumust võrreldes klaasesemetega, kuid siiski pole soovitatav seda otse lahtises leegis kasutada. (Foto)
Lisaks neile on olemas veel väga palju erinevaid ja kindlaks otstarbeks mõeldud katsevahendid.
1.2. Füüsikalised ja keemilised omadused
Kõigil puhastel ainetel on oma kindlad omadused, millest tulenevalt saame aineid üksteisest eristada. Aine omadused määravad ära ka selle, mille jaoks me mõnda ainet kasutame. Ainete omadused saame liigitada keemilisteks ja füüsikalisteks.
Allikas: https://youtu.be/SWnH_5gK46Q
Keemilised omadused iseloomustavad aine reageerimisvõimet teiste ainetega. Siinkohal on üheks lihtsaks näiteks põlemine, olgu selleks siis küünla põlemine, kus parafiini reageerimisel õhus oleva hapnikuga moodustuvad süsihappegaas ja vesi, või puidu põlemine, kus tselluloos ja muu orgaaniline materjal põleb samuti süsihappegaasiks ja veeks.
 Füüsikalised omadused on sellised omadused, mis ei ole seotud aine muundumisega teiseks aineks. Füüsikalistest omadustest mitmeid on võimalik tuvastada meeleorganitega, kuid paljude iseloomustamiseks tuleb kasutada ka erinevaid uurimismeetodeid.
Füüsikalised omadused on sellised omadused, mis ei ole seotud aine muundumisega teiseks aineks. Füüsikalistest omadustest mitmeid on võimalik tuvastada meeleorganitega, kuid paljude iseloomustamiseks tuleb kasutada ka erinevaid uurimismeetodeid.
Ainete värvust ja lõhna saame tunnetada meeleorganitega, nii võimegi näiteks meresinise värvusega soola nägemisel arvata, et tegemist on mõne vaseühendiga, ja teravalt ärritavat lõhna tundes võime kahtlustada ammoniaaki – ainet, mille vesilahust teame nuuskpiiritusena ja millega võid kokku puutuda arstikabinetis.
Aine agregaatolek on samuti selline füüsikaline omadus, mida saame vaatluse teel tuvastada. Enamik aineid esineb kolmes olekus: tahkes, vedelas ja gaasilises. Tahkes aines on aine osakesed lähestikku ning nendevahelised sidemed on tugevad. Aineosakeste omavaheline liikumine on raskendatud. Sellest tulenevalt on tahketel ainetel kindel kuju. Vedelas aines ei ole aine osakesed omavahel enam niivõrd tugevalt seotud ja saavad üksteise suhtes ka liikuda. Seetõttu on vedelikud voolavad. Gaasiliste ainete puhul asuvad aine osakesed hõredalt ega ole omavahel üldse seotud. See annab gaasilisele ainele võimaluse levida ruumis.

Tahke, vedel ja gaasiline aine
Tingimuste muutumisel saavad ained üle minna ühest olekust teise. Näiteks sulamine on tahke aine üleminek vedelasse olekusse. Füüsikaline suurus, mis seda üleminekut kirjeldab, on sulamistemperatuur. Aurustumine on aine üleminek vedelast olekust gaasilisse ning seda üleminekut iseloomustav füüsikaline suurus on keemistemperatuur.
Kindlasti tead Sa vee sulamistemperatuuri (0 oC) ja keemistemperatuuri (100 oC). Aga näiteks kõige kõrgema sulamistemperatuuriga metall on volfram (3400 oC) ja kõige madalam sulamistemperatuur on sellisel metallil nagu elavhõbe (-39 oC).
Tahkeid aineid saab iseloomustada veel selliste füüsikaliste suurustega nagu kõvadus ja tugevus. Kõvadus näitab tahke aine vastupidavust kriimustamise või lõikamise suhtes. Igapäevaelus teame, et näiteks puitu on võimalik noaga lõigata, kuid klaasi lõikamine tavalise kööginoaga on juba praktiliselt võimatu. Seega saamegi öelda, et võrreldes terasega on klaas kõvem materjal, kuid võrreldes puiduga on teras kõvem materjal. Tugevus näitab tahke aine vastupidavust painutamisele, venitamisele või survele. Näiteks on metallid suhteliselt tugevad materjalid, seevastu klaas puruneb painutamisel kergesti ega ole kindlasti tugev.
Kindlasti tead Sa, et mõnedel ainetel on omadus juhtida hästi elektrit ning eelkõige on head elektrijuhid metallid, aga ka erinevate soolade ja paljude teiste ainete vesilahused. Ained, mis on võimelised hästi edasi kandma elektrit, on enamasti ka head soojusjuhid. Näiteks metallid on ka head soojusjuhid ning tänu sellele kasutatakse neid nii pottide-pannide kui ka radiaatorite valmistamiseks. Seevastu puitu kasutame majade ehituses, kuna puit on halb soojusjuht.
Viimaseks, aga väga oluliseks füüsikaliseks omaduseks on tihedus. Tihedus on füüsikaline suurus, mis väljendab ühikulise ruumalaga ainekoguse massi ehk ta iseloomustab aine massi kindla ruumala kohta ning sellest tulenevalt on tema valem: $\rho=\frac{m}{V}$, kus ρ on tihedus, m on mass ja V on ruumala.
Võiksid teada puhta vee tiheduse väärtust, milleks on $1\frac{g}{cm^{3}}=1\frac{kg}{dm^{3}}=1000\frac{kg}{m^{3}}$.
Järgnev video tutvustab Sulle tihedusega seotud arvutusülesandeid.
Allikas: https://youtu.be/NLFpowHVRDI
Keha või aine tiheduse määramiseks kasutatakse sukeldamismeetodit. Selle jaoks, et määrata keha tihedust, tuleb kõigepealt kaaluda see keha (m = 45 g) ning seejärel sukeldada ta skaalaga ja veega täidetud anumasse. Vedelikunivoo muutusest saame selle keha ruumala (50 ml - 45 ml = 5 ml) ning jagades keha massi ruumalaga ongi teada meile uuritava keha tihedus ($\rho=\frac{45\ g}{5\ ml}$ = 9 g/ml).

Sukeldamismeetod
Ülesanne 4
Milline on selle aine kõige olulisem omadus, kui
1.3. Reaktsiooni tunnused ja esilekutsumine
Keemia on teadus, mis uurib ainetega toimuvad muundumisi. Kuidas saame aga olla kindlad, et meil toimub keemiline reaktsioon?
Allikas: https://youtu.be/vkxhQUkqHq0
Nähtusi saab liigitada füüsikalisteks ja keemilisteks.
Füüsikaline nähtus iseloomustab ainega toimuvaid muutusi, mille korral aine ise jääb samaks. Kõige lihtsama näitena vaatleme vett. Me teame, et vesi esineb kolmes erinevas olekus: tahke, vedel ja gaasiline. Kui me sulatame jäätükki, siis muutub küll vee olek, kuid vesi ise jääb oma koostiselt ikkagi samaks, järelikult on selle protsessi juures tegemist füüsikalise nähtusega. Samamoodi on füüsikaline nähtus mõne tahke aine peenestamine või metalli sulatamine.
Keemiline nähtus kirjeldab ainete muundumist uuteks aineteks. Seda protsessi nimetatakse ka keemiliseks reaktsiooniks. Üks lihtsamaid keemilisi reaktsioone on põlemine, kus näiteks puit reageerib õhus oleva hapnikuga ja tekivad uued ained: süsihappegaas ja vesi. Enamasti esinevad keemilised ja füüsikalised nähtused koos, näiteks küünla põlemise korral toimub nii parafiini sulamine, mis on füüsikaline nähtus, kui ka põlemisprotsess, mis on keemiline nähtus.
Ülesanne 1
Selleks, et saaksime olla kindlad, et tegemist on keemilise reaktsiooniga, peab olema esindatud vähemalt üks järgnevatest muutustest:
- sademe teke või kadumine,
- gaasi eraldumine,
- lõhna teke või muutus,
- värvuse muutus,
- soojuse ja/või valguse eraldumine.
Ülesanne 2
Selleks, et keemiline reaktsioon saaks üldse toimuda, peavad aineosakesed omavahel kokku puutuma. On reaktsioone, mille toimumiseks piisabki ainult ainete omavahelisest kokkupuutumisest, kuid enamik reaktsioone toimub alles siis, kui on täidetud mõni reaktsiooni esilekutsuvatest tingimustest:
- kuumutamine,
- süütamine,
- elektrivoolu läbijuhtimine,
- valgustamine.
1.4. Gaaside omadused ja saamine
Meid ümbritsev õhk on gaaside segu. Selle teema raames õpimegi, millistest ainetest õhk koosneb, mis on õhu koostisosade peamised omadused ja kuidas keemialaborites erinevaid gaase kogutakse. Järgnev video tutvustabki kõike seda.
Allikas: https://youtu.be/Sv7qogcigjg
Õhu koostis
Kuiv õhk koosneb peamiselt lämmastikust ja hapnikust ning vähesel määral ka argoonist ja süsihappegaasist.
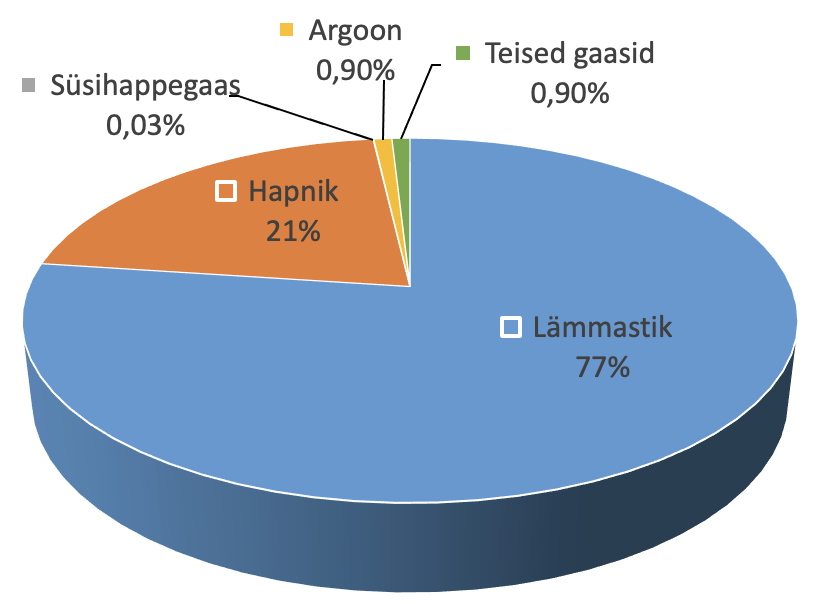
Õhu koostis
Puhas õhk on läbipaistev, värvuseta, maitseta ja lõhnata gaaside segu. Kuna õhul ei ole meeleorganitega tunnetatavaid omadusi, peavad järelikult selliste omadustega olema ka tema peamised koostisosad: lämmastik ja hapnik.
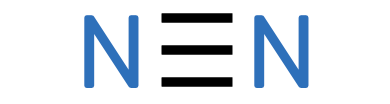 Õhus on kõige rohkem lämmastikku, seda umbes 78 mahuprotsenti. Lämmastik on kaheaatomiline molekul, mis on keemiliselt väga vähe aktiivne, kuna kahe lämmastiku aatomi vahel on kolmekordne kovalentne side.
Õhus on kõige rohkem lämmastikku, seda umbes 78 mahuprotsenti. Lämmastik on kaheaatomiline molekul, mis on keemiliselt väga vähe aktiivne, kuna kahe lämmastiku aatomi vahel on kolmekordne kovalentne side.
Sellest tulenevalt ei reageeri lämmastik tavatingimustel enamiku ainetega. Siiski on lämmastik elusorganismidele vajalik, kuna kuulub valkude koostisesse ning on ka taimedele vajalik toiteelement.
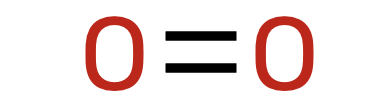 Hapnikku on kuivas õhus umbes 21 mahuprotsenti ehk ligikaudu 1/5. Sarnaselt lämmastikuga on ka hapnik kaheaatomiline molekul, kuid keemiliselt märgatavalt aktiivsem. Hapniku molekulis on aatomite vahel kahekordne keemiline side.
Hapnikku on kuivas õhus umbes 21 mahuprotsenti ehk ligikaudu 1/5. Sarnaselt lämmastikuga on ka hapnik kaheaatomiline molekul, kuid keemiliselt märgatavalt aktiivsem. Hapniku molekulis on aatomite vahel kahekordne keemiline side.
Kindlasti on hapnik eluslooduse jaoks tähtsaim õhu koostisosa, kuna hapnikku vajavad elusorganismid hingamiseks. Samuti on hapnikul oluline roll paljude ainete tootmisel või energia saamisel, kuna põlemisprotsessid vajavad toimumiseks hapnikku. Kaheaatomiline hapnik ei ole aga ainus gaasiline lihtaine, mis koosneks ainult hapniku aatomitest. Atmosfääris on mõningal määral ka kolmest hapniku aatomist koosnevat osooni (O3). Osoon on sinakas, „elektri“ lõhnaga gaas, mis on keemiliselt väga aktiivne. Teda leidub atmosfääri ülemistes kihtides, umbes 20–30 km kõrgusel maapinnast. Seda ala nimetatakse ka osoonikihiks. Osooniaukude tõttu satub maapinnale rohkem ultraviolettkiirgust, mis kahjustab organisme. Eelkõige seostatakse UV-kiirgust nahavähi sagenemisega. Osooni kahjulikku mõju organismidele kasutatakse aga näiteks basseinide desinfitseerimisel kloori asemel, kuna erinevalt kloorist ei tekita osoon ebameeldivat lõhna ega ärrita silmi. Samas peab olema ettevaatlik osooni kogusega, mida kasutatakse, sest liialt suur kogus sissehingatavat osooni võib põhjustada mitmesuguseid haigusi.
Hapniku saamine ja gaaside kogumine
Hapnik on oluline gaas põlemisprotsessides. Kuidas hapnik tekib? Looduses tekib hapnik fotosünteesil ning tavaliselt on põlemise jaoks piisavalt hapnikku. Mõnel juhul, näiteks meditsiinis või allveelaevadel, on vaja aga puhast hapnikku. Sel juhul eraldatakse hapnikku õhust. Keemialaboris saadakse hapnikku aga hapnikurikaste ühendite lagunemisreaktsioonidel. Lagunemisreaktsioon on keemiline reaktsioon, mille käigus aine laguneb kaheks või enamaks aineks. Üheks heaks näiteks on kaaliumpermanganaadi lagunemine kuumutamisel (2KMnO4 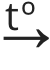 K2MnO4 + MnO2 + O2↑). Samuti saame hapnikku vesinikperoksiidi lagunemisel (2 H2O2 → 2 H2O + O2↑).
K2MnO4 + MnO2 + O2↑). Samuti saame hapnikku vesinikperoksiidi lagunemisel (2 H2O2 → 2 H2O + O2↑).
Kuidas aga koguda hapnikku? Kuna hapniku tihedus on õhu tihedusest suurem, saab teda koguda püstisesse katseklaasi, kust ta tõrjub õhu ehk väiksema tihedusega gaasi välja. Gaaside kogumisel rakendatakse järgnevat loogikat: õhust suurema tihedusega gaase saab koguda katseklaasi suue ülespoole ning õhust väiksema tihedusega gaase saab koguda katseklaasi suue allapoole.
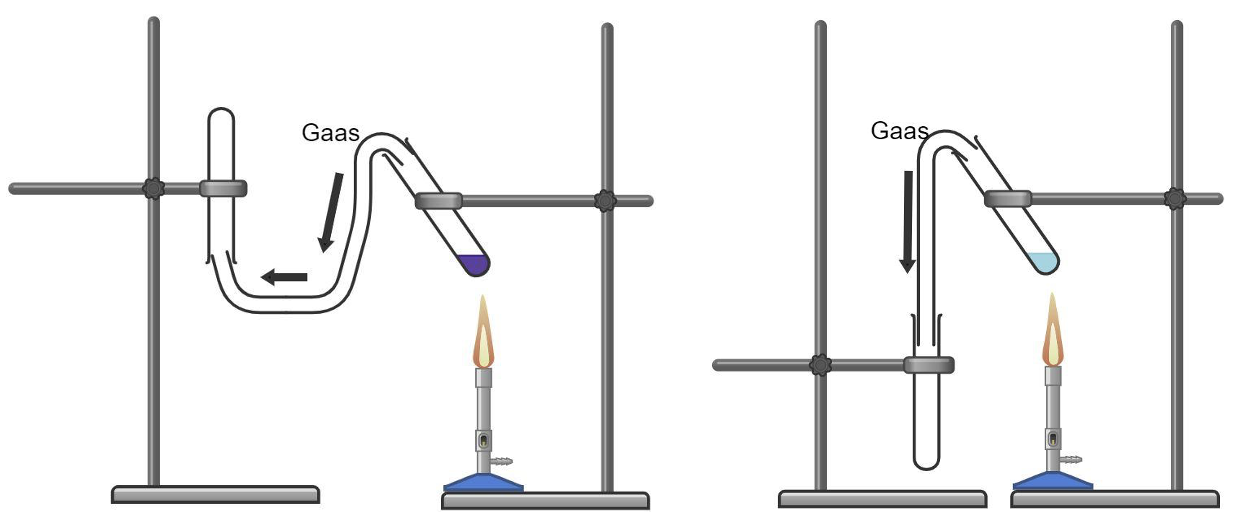
Õhust väiksema tihedusega gaasi kogumine Õhust suurema tihedusega gaasi kogumine
Aga kuidas saada teada, kas gaasi tihedus on õhu tihedusest suurem või väiksem? Selleks tuleb Sulle appi perioodilisustabel ja molekulmass. Molekulmass saadakse aine koostisesse kuuluvate aatomite aatommasside kokkuliitmisel. Õhu keskmiseks molekulmassiks loetakse 29.
Mr(õhk) = 29
Näiteks O2 koosneb kahest hapniku aatomist, järelikult tema molekulmass on 16 korda 2 ehk 32 ja seega on ta õhust tihedam.
Mr(O2) = 16$\times $2 = 32
Vesiniku (H2) molekulmass on aga 2 ehk ta on õhust hõredam ning tema kogumiseks tuleb kasutada katseklaasi, mille suue on suunatud allapoole.
Mr(H2) = 1$\times $2 = 2
Selleks, et koguda puhtamaid gaase (ilma lisanditeta), rakendatakse tihti meetodit, kus kogutav gaas juhitakse läbi vee. Oluline on aru saada, et gaasi saab koguda läbi vee ainult siis, kui see gaas vees ei lahustu. Tuntuimatest gaasidest ei lahustu hästi vees hapnik (O2), vesinik (H2), lämmastik (N2) ja metaan (CH4) ning neid gaase saame koguda läbi vee.
Kuidas me aga teame, et kogutud gaas on hapnik? Hapnik on vajalik gaas põlemiseks ning seega saab teda tõestada hõõguva puupirruga. Kui anumas on puhas hapnik, süttib puupird eredalt põlema.