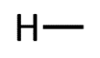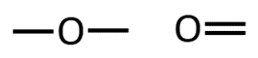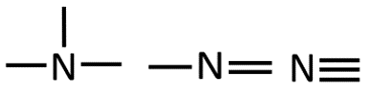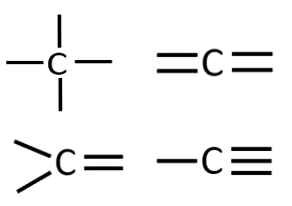7.3. Süsivesinikud
Sa tead juba, et orgaanilise keemia kõige olulisemaks elemendiks on süsinik. Süsinikul võib olla neli ühekordset sidet. Kui need sidemed on vesiniku aatomitega, saame metaani, mis on kõige lihtsam süsivesinik. Sõna süsivesinik vihjab juba väga palju selle aineklassi olemuse kohta. Süsivesinikud on ained, mis koosnevad ainult süsinikust ja vesinikust. Süsivesinike kirevat maailma avab järgnev video.
Allikas: https://youtu.be/V_erkTqjKEg
Struktuurivalemid
Orgaanilisel keemial on täiesti oma keel. Selle jaoks, et seda keelt paremini mõista, vaata läbi järgnev video.
Allikas: https://youtu.be/aAu-nDbRUOM
Struktuurivalemeid saab liigitada järgmiselt: tasapinnaline ehk klassikaline struktuurivalem, lihtsustatud struktuurivalem ja summaarne struktuurivalem. Tasapinnaline ja lihtsustatud struktuurivalem väljendavad molekuli ehitust ehk näitavad ära, millised aatomid on omavahel keemiliste sidemetega seotud ja millises järjekorras. Tasapinnalise struktuurivalemi korral on välja joonistatud kõik keemilised sidemed.
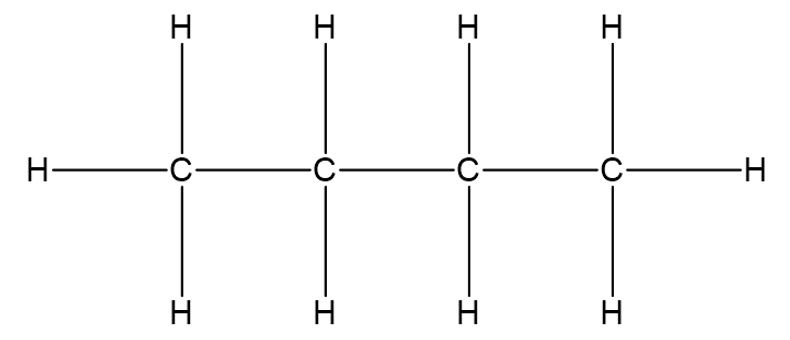
Tasapinnaline struktuurivalem
Lihtsustatud struktuurivalemi korral jäetakse süsiniku ja vesinike vahelised sidemed märkimata ning tuuakse ära vaid süsinike omavahelised keemilised sidemed.
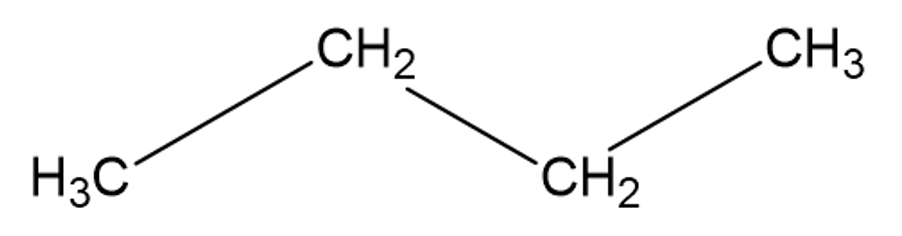
Lihtsustatud struktuurivalem
Summaarne valem ehk molekulvalem iseloomustab elemendilist koostist. Summaarse valemi korral liidetakse kokku kõik sama elemendi aatomid ning näidatakse indeksiga, mitu neid on. Näiteks eespool toodud aine summaarne valem on: C4H10.
Molekuli ehitust saab kirjeldada veel molekulmudelite abil. Molekulmudelid iseloomustavad aatomite ruumilist paiknemist molekulis.
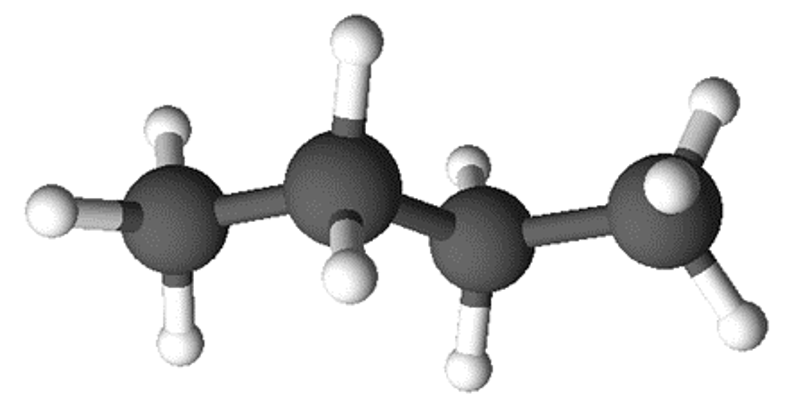
Molekulmudel
Süsinikuühendeid on äärmiselt palju, kuna süsiniku aatomid saavad moodustada väga erineva paigutusega ahelaid. Süsinikahela moodustavad üksteisega kovalentsete sidemete abil seotud süsiniku aatomid. Süsinikahel võib olla hargnemata ehk lineaarne, hargnenud või tsükliline. Lineaarse ahela puhul on süsiniku aatomid üksteisega järjestikku seotud.

Lineaarne ahel
Hargnenud ahela korral moodustub ühest või mõnest süsinikust kõrvalahel ehk hargnevus.
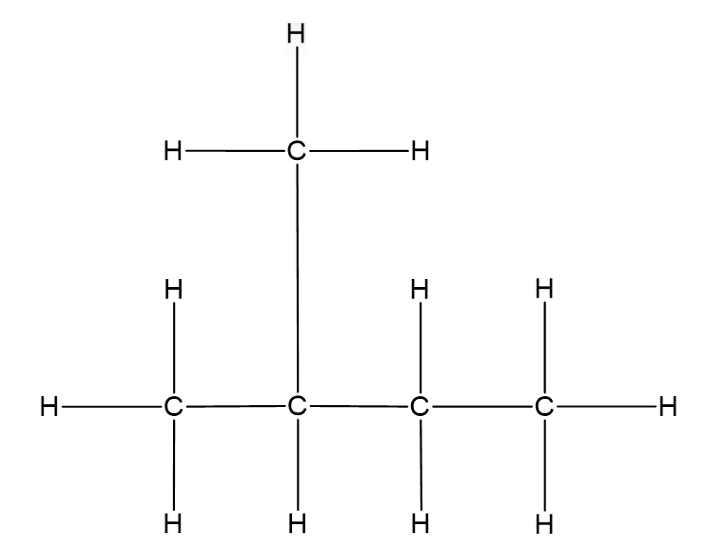
Hargnenud ahel
Tsüklilise ahela korral moodustub süsiniku aatomitest suletud kujund.
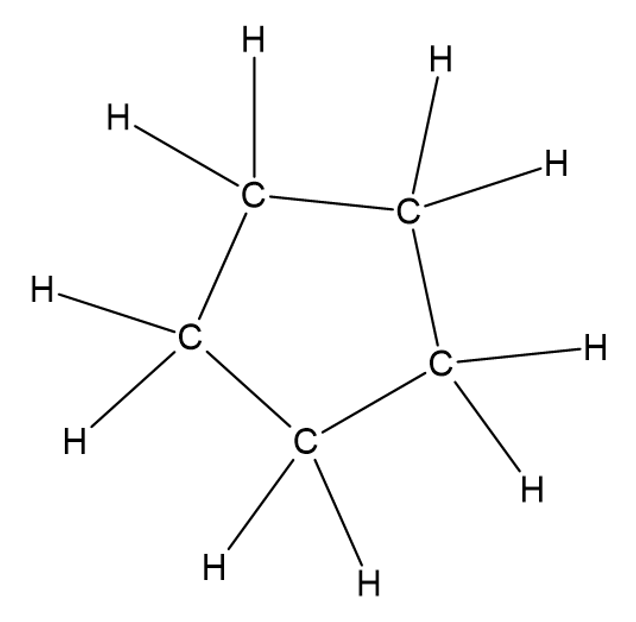
Tsükliline ahel
Orgaanilises keemias puutud Sa kokku peamiselt 4 erineva elemendiga: süsinik, vesinik, hapnik ja lämmastik. Selle jaoks, et osata koostada nimetatud aatomitest koosnevaid struktuurivalemeid, pead silmas pidama vastava elemendi aatomi sidemete arvu ja paigutamise võimalusi orgaaniliste ainete molekulides. Need võimalused on toodud järgnevas tabelis.
|
Elemendi sümbol |
Sidemete arv |
Võimalikud |
|
H |
1 |
|
|
O |
2 |
|
|
N |
3 |
|
|
C |
4 |
|
Süsivesinike omadused ja kasutusalad
Kõige lihtsam ja ka igapäevaelus üks kasutatavamaid süsivesinikke on metaan (CH4). Nagu Sa juba tead, koosneb metaan ühest süsiniku aatomist ja neljast vesiniku aatomist ning on tetraeedrilise ehitusega.
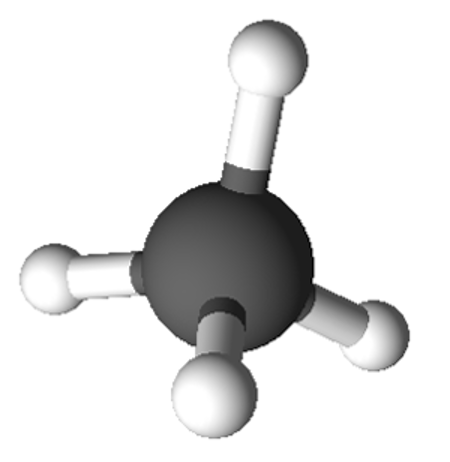
Metaani molekulmudel
Metaan on värvusetu, lõhnatu, õhust väiksema tihedusega gaas. Metaan on maagaasi peamine koostisosa ning teda kasutatakse nii tööstuses kui ka kodumajapidamistes küttegaasina. Looduses tekib metaan orgaaniliste ainete lagunemisel.
Süsivesinikke on palju ning ühiseid omadusi on raske välja tuua, küll aga kehtivad teatavad seaduspärasused. Näiteks mida suurem on süsivesiniku molekul ehk mida pikem on süsinikahel, seda kõrgem on aine sulamis- ja keemistemperatuur. Sellest tulenevalt on väiksema süsinikahelaga (1...4 süsiniku aatomit) süsivesinikud toatemperatuuril gaasilises olekus. Lisaks metaanile kasutatakse propaani ja butaani segu majapidamisgaasina ning ka balloonigaasina, näiteks matkapliitides või välgumihklites sisalduvate gaasidena. Keskmise süsinikahelaga (5...17 süsiniku aatomit) süsivesinikud on toatemperatuuril vedelas olekus. Vedelad süsivesinikud on iseloomuliku lõhnaga ning kergesti süttivad, neid leidub naftas ning naftatoodetes, näiteks bensiinis. Pikema süsinikahelaga süsivesinikud on toatemperatuuril tahkes olekus. Nad on vahajad, enamasti värvuseta või kergelt valkja alatooniga tahked ained. Igapäevaelus kõige lihtsam tahke süsivesinik on küünlavaha koostises olev parafiin.
Süsivesinikud on hüdrofoobsed ained. Hüdrofoobsed ained ei oma vastastiktoimet veega ning nad on vett-tõrjuvad. Hüdrofoobsed ained ei märgu vee toimel, vaid moodustavad vee pinnale sfäärilisi tilkasid, samuti ei lahustu nad vees. Hüdrofoobseteks aineteks on erinevad vahad, rasvad, aga ka süsivesinikud. Hüdrofiilsed ained seevastu omavad tugevat vastastiktoimet veega ning on veesõbralikud. Need ained märguvad vee toimel ning sageli nad ka lahustuvad vees. Hüdrofiilsed on näiteks sool, puit, etanool.
Süsivesinike põlemine
Süsivesinikke kasutatakse enamasti kütustena ning seetõttu on nende üheks kõige olulisemaks omaduseks põlemine. Põlemine on oksüdatsiooniprotsess, millega kaasneb intensiivne soojuse eraldumine. Põlemise jaoks on vaja hapnikku ning vastavalt hapniku juurdepääsule saab põlemist liigitada täielikuks põlemiseks ja mittetäielikuks põlemiseks. Süsivesinike täielikul põlemisel (kui hapnikku on piisavalt) tekivad süsinikdioksiid ehk süsihappegaas ja vesi. Süsivesinike mittetäielikul põlemisel (kui hapnikku ei ole piisavalt) tekivad süsinikoksiid ehk vingugaas ja vesi. Mittetäieliku põlemise korral tekib ka tahma ehk süsinikku.
Põlemisreaktsioonide korral on oluline silmas pidada
- põlemine on reaktsioon hapnikuga (O2);
- reaktsioonivõrrandi lihtsamaks tasakaalustamiseks on mõttekas kasutada süsivesinike summaarseid valemeid;
- kui reaktsiooni kirjelduses pole teisiti öeldud, eelda, et tegemist on täieliku põlemisega ehk tekivad CO2 ja H2O;
- reaktsioonivõrrandi tasakaalustamisel võib olla hapniku ees murdarvuline kordaja.
Näide 1. Kirjutame metaani täieliku põlemise võrrandi.
1) Kirjutame lähteainete ja saaduste valemid.
CH4 + O2 → CO2 + H2O
2) Tasakaalustame võrrandi.
Lähteainetes on üks süsiniku aatom ja saadustes ka üks süsiniku aatom, seega on süsinike aatomite arv tasakaalus. Lähteainetes on neli vesiniku aatomit ning saadustes 2 vesiniku aatomit, järelikult tuleb vee molekuli ette kirjutada kordaja 2, et vesiniku aatomid saaksid tasakaalu:
CH4 + O2 → CO2 + 2H2O
Edasi tuleb tegeleda hapniku aatomitega. Saaduste poolel on 4 hapniku aatomit ning seega tuleb lähteainete poole saada ka neli hapniku aatomit ehk hapniku molekuli ette tuleb kirjutada kordaja 2.
CH4 + 2O2 → CO2 + H2O
Näide 2. Kirjutame butaani täieliku põlemise võrrandi.
1) Kirjutame lähteainete ja saaduste valemid.
C4H10 + O2 → CO2 + H2O
2) Tasakaalustame võrrandi.
Lähteainetes on neli süsiniku aatomit ja saadustes üks süsiniku aatom, seega tuleb süsihappegaasi ette kordaja 4.
C4H10 + O2 → 4CO2 + H2O
Lähteainetes on 10 vesiniku aatomit ning saadustes 2 vesiniku aatomit, järelikult tuleb vee molekuli ette kirjutada kordaja 5, et vesiniku aatomid saaksid tasakaalu.
C4H10 + O2 → 4CO2 + 5H2O
Edasi tuleb tegeleda hapniku aatomitega. Saaduste poolel on 8 + 5 = 13 hapniku aatomit ning seega tuleb lähteainete poole saada ka 13 hapniku aatomit ehk hapniku molekuli ette tuleb kirjutada kordaja 13 : 2 = 6,5.
C4H10 + 6,5O2 → 4CO2 + 5H2O