7.2. Süsiniku oksiidid
Süsinikul on kaks tähtsamat oksiidi: CO ja CO2, mis mõlemad tekivad süsinikuühendite põlemisel ja on laialdaselt kasutatavad tööstuses. Oma koostiselt võivad nad tunduda küll sarnased, kuid omadustelt on vägagi erinevad ained. Süsiniku oksiididest annab ülevaate järgnev video.
Allikas: https://youtu.be/qDae-Iay4Oo
Süsinikoksiid
 Süsinikoksiidi valem on CO ja rahvapäraselt kutsutakse teda vingugaasiks. Süsinikoksiid tekib süsiniku ja süsinikuühendite mittetäielikul põlemisel, see tähendab, et põlemisprotsessis ei jätku piisavalt hapnikku. Mittetäieliku põlemise võrrand on selline:
Süsinikoksiidi valem on CO ja rahvapäraselt kutsutakse teda vingugaasiks. Süsinikoksiid tekib süsiniku ja süsinikuühendite mittetäielikul põlemisel, see tähendab, et põlemisprotsessis ei jätku piisavalt hapnikku. Mittetäieliku põlemise võrrand on selline:
2C+ O2 → 2CO
Oma omadustelt on süsinikoksiid värvitu, lõhnatu, eluohtlikult mürgine gaas. Vingugaasi mürgisus seisneb selles, et sissehingamisel seostub CO veres oleva hemoglobiiniga. Tavapäraselt seostub hemoglobiiniga hapnik, kuid kuna süsinikoksiidi seostumine on eelistatud, ei saa hemoglobiin hapnikku siduda ning sellest tulenevalt ei kanna veri mööda keha laiali mitte hapnikku vaid vingugaasi ja selle tagajärjel organism lõpuks lämbubki.
Süsinikoksiid on vees vähe lahustuv õhuga sarnase tihedusega gaas. Õhu tihedus on umbes 1,23 kg/m3 ning süsinikoksiidi oma 1,14 kg/m3. Gaaside kogumise juures õppisime selgeks nipi, kuidas hinnata, kas gaas on õhust tihedam või hõredam. Õhu molekulmassiks loetaks 29, Mr(CO) = 12 + 16 = 30, seega saamegi öelda, et vingugaas on õhuga sarnase tihedusega.
Kuna süsinikoksiidis on süsiniku oksüdatsiooniaste II, saab ta edasi oksüdeeruda. CO oksüdeerub kahes erinevas protsessis:
-
põlemisel: 2CO + O2 → 2CO2
Selle tõttu, et ta põleb, kasutatakse teda küttegaaside koostises. -
reageerides metallioksiididega: Fe2O3 + 3CO → 2Fe + 3CO2
Antud reaktsioonivõrrand kirjeldab raua tootmist rauamaagist ja ka selles protsessis leiab süsinikoksiid laialdast kasutust.
Süsinikdioksiid
 Süsinikdioksiidi valem on CO2 ja tema rahvapärane nimetus süsihappegaas. Süsinikdioksiid tekib süsiniku ja süsinikuühendite täielikul põlemisel. Täieliku põlemise saame võrrandi abil üles kirjutada nii:
Süsinikdioksiidi valem on CO2 ja tema rahvapärane nimetus süsihappegaas. Süsinikdioksiid tekib süsiniku ja süsinikuühendite täielikul põlemisel. Täieliku põlemise saame võrrandi abil üles kirjutada nii:
C + O2 → CO2
Süsihappegaasi tekib ka kõdunemisprotsessidel ja hingamisel. Maa atmosfääris leidub umbes 0,04% süsinikdioksiidi ning selles koguses ei ole süsinikdioksiid inimorganismile kahjulik, kuid suuremates kogustes (üle 1%) põhjustab süsihappegaas uimasust. Seda võib täheldada ruumides, kus on pikemat aega koos palju inimesi, aga ventilatsioon on puudulik või aknad suletud. Kui süsihappegaasi kogus õhus küündib juba 7–10% lähedale, on see eluohtlik.
Süsihappegaas on värvitu, kergelt hapuka lõhnaga gaas. Tema lahustuvus vees on keskmine ja ta on õhuga võrreldes umbes 1,5 korda suurema tihedusega gaas. Süsihappegaasi tihedus on 1,98 kg/m3 ning molekulmass Mr(CO2) = 12 + 16$\times $2 = 44. Madalamatel temperatuuridel muutub süsihappegaas tahkeks jääsarnaseks nn kuivaks jääks, mida kasutatakse toiduainete jahutamisel.
Süsinikdioksiid on happeline oksiid, mis reageerides veega moodustab nõrga ja ebapüsiva happe – süsihappe:
CO2 + H2O 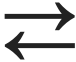 H2CO3
H2CO3
Süsinikdioksiidis on süsiniku oksüdatsiooniaste IV, mis on süsiniku jaoks maksimaalne. Sellest tulenevalt süsinikdioksiid ei põle ega toeta põlemist ning leiab kasutust tulekustutites. Veel kasutatakse süsihappegaasi toiduainetetööstuses (jookide gaseerimisel, happesuse regulaatorina, toiduainete säilitamisel).

