1.4. Gaaside omadused ja saamine
Meid ümbritsev õhk on gaaside segu. Selle teema raames õpimegi, millistest ainetest õhk koosneb, mis on õhu koostisosade peamised omadused ja kuidas keemialaborites erinevaid gaase kogutakse. Järgnev video tutvustabki kõike seda.
Allikas: https://youtu.be/Sv7qogcigjg
Õhu koostis
Kuiv õhk koosneb peamiselt lämmastikust ja hapnikust ning vähesel määral ka argoonist ja süsihappegaasist.
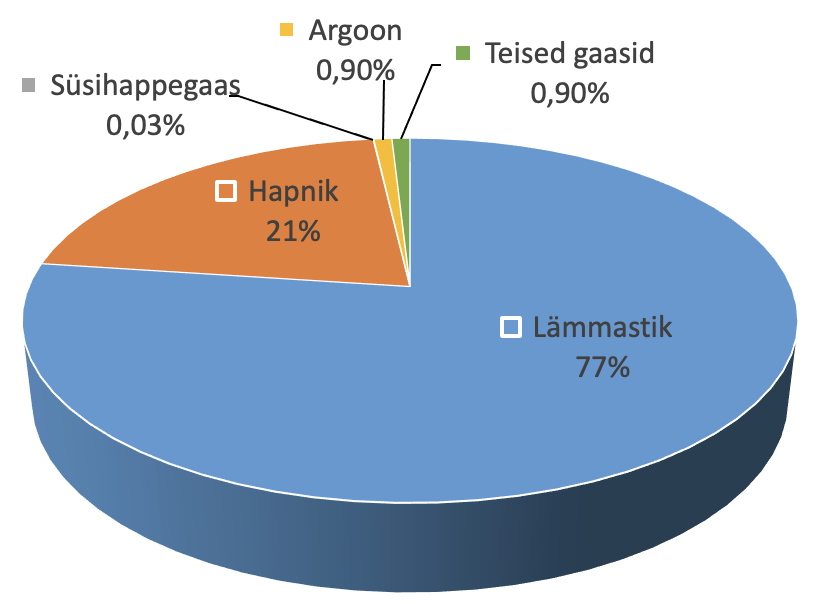
Õhu koostis
Puhas õhk on läbipaistev, värvuseta, maitseta ja lõhnata gaaside segu. Kuna õhul ei ole meeleorganitega tunnetatavaid omadusi, peavad järelikult selliste omadustega olema ka tema peamised koostisosad: lämmastik ja hapnik.
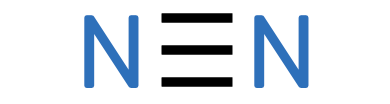 Õhus on kõige rohkem lämmastikku, seda umbes 78 mahuprotsenti. Lämmastik on kaheaatomiline molekul, mis on keemiliselt väga vähe aktiivne, kuna kahe lämmastiku aatomi vahel on kolmekordne kovalentne side.
Õhus on kõige rohkem lämmastikku, seda umbes 78 mahuprotsenti. Lämmastik on kaheaatomiline molekul, mis on keemiliselt väga vähe aktiivne, kuna kahe lämmastiku aatomi vahel on kolmekordne kovalentne side.
Sellest tulenevalt ei reageeri lämmastik tavatingimustel enamiku ainetega. Siiski on lämmastik elusorganismidele vajalik, kuna kuulub valkude koostisesse ning on ka taimedele vajalik toiteelement.
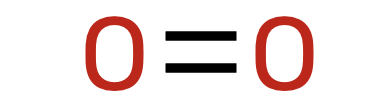 Hapnikku on kuivas õhus umbes 21 mahuprotsenti ehk ligikaudu 1/5. Sarnaselt lämmastikuga on ka hapnik kaheaatomiline molekul, kuid keemiliselt märgatavalt aktiivsem. Hapniku molekulis on aatomite vahel kahekordne keemiline side.
Hapnikku on kuivas õhus umbes 21 mahuprotsenti ehk ligikaudu 1/5. Sarnaselt lämmastikuga on ka hapnik kaheaatomiline molekul, kuid keemiliselt märgatavalt aktiivsem. Hapniku molekulis on aatomite vahel kahekordne keemiline side.
Kindlasti on hapnik eluslooduse jaoks tähtsaim õhu koostisosa, kuna hapnikku vajavad elusorganismid hingamiseks. Samuti on hapnikul oluline roll paljude ainete tootmisel või energia saamisel, kuna põlemisprotsessid vajavad toimumiseks hapnikku. Kaheaatomiline hapnik ei ole aga ainus gaasiline lihtaine, mis koosneks ainult hapniku aatomitest. Atmosfääris on mõningal määral ka kolmest hapniku aatomist koosnevat osooni (O3). Osoon on sinakas, „elektri“ lõhnaga gaas, mis on keemiliselt väga aktiivne. Teda leidub atmosfääri ülemistes kihtides, umbes 20–30 km kõrgusel maapinnast. Seda ala nimetatakse ka osoonikihiks. Osooniaukude tõttu satub maapinnale rohkem ultraviolettkiirgust, mis kahjustab organisme. Eelkõige seostatakse UV-kiirgust nahavähi sagenemisega. Osooni kahjulikku mõju organismidele kasutatakse aga näiteks basseinide desinfitseerimisel kloori asemel, kuna erinevalt kloorist ei tekita osoon ebameeldivat lõhna ega ärrita silmi. Samas peab olema ettevaatlik osooni kogusega, mida kasutatakse, sest liialt suur kogus sissehingatavat osooni võib põhjustada mitmesuguseid haigusi.
Hapniku saamine ja gaaside kogumine
Hapnik on oluline gaas põlemisprotsessides. Kuidas hapnik tekib? Looduses tekib hapnik fotosünteesil ning tavaliselt on põlemise jaoks piisavalt hapnikku. Mõnel juhul, näiteks meditsiinis või allveelaevadel, on vaja aga puhast hapnikku. Sel juhul eraldatakse hapnikku õhust. Keemialaboris saadakse hapnikku aga hapnikurikaste ühendite lagunemisreaktsioonidel. Lagunemisreaktsioon on keemiline reaktsioon, mille käigus aine laguneb kaheks või enamaks aineks. Üheks heaks näiteks on kaaliumpermanganaadi lagunemine kuumutamisel (2KMnO4 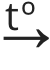 K2MnO4 + MnO2 + O2↑). Samuti saame hapnikku vesinikperoksiidi lagunemisel (2 H2O2→ 2 H2O + O2↑).
K2MnO4 + MnO2 + O2↑). Samuti saame hapnikku vesinikperoksiidi lagunemisel (2 H2O2→ 2 H2O + O2↑).
Kuidas aga koguda hapnikku? Kuna hapniku tihedus on õhu tihedusest suurem, saab teda koguda püstisesse katseklaasi, kust ta tõrjub õhu ehk väiksema tihedusega gaasi välja. Gaaside kogumisel rakendatakse järgnevat loogikat: õhust suurema tihedusega gaase saab koguda katseklaasi suue ülespoole ning õhust väiksema tihedusega gaase saab koguda katseklaasi suue allapoole.
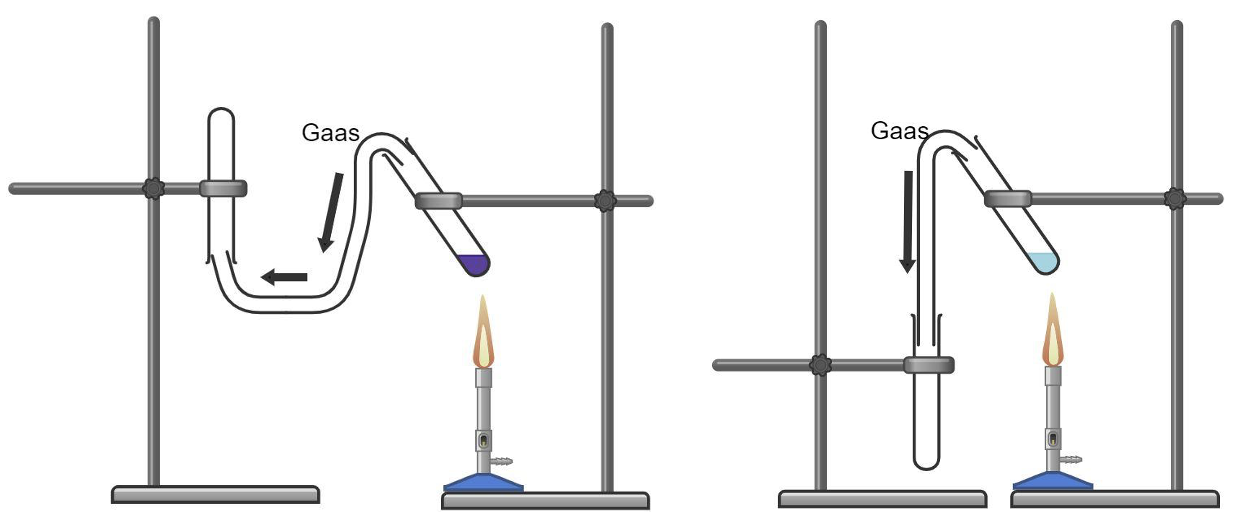
Õhust väiksema tihedusega gaasi kogumine Õhust suurema tihedusega gaasi kogumine
Aga kuidas saada teada, kas gaasi tihedus on õhu tihedusest suurem või väiksem? Selleks tuleb Sulle appi perioodilisustabel ja molekulmass. Molekulmass saadakse aine koostisesse kuuluvate aatomite aatommasside kokkuliitmisel. Õhu keskmiseks molekulmassiks loetakse 29.
Mr(õhk) = 29
Näiteks O2 koosneb kahest hapniku aatomist, järelikult tema molekulmass on 16 korda 2 ehk 32 ja seega on ta õhust tihedam.
Mr(O2) = 16$\times $2 = 32
Vesiniku (H2) molekulmass on aga 2 ehk ta on õhust hõredam ning tema kogumiseks tuleb kasutada katseklaasi, mille suue on suunatud allapoole.
Mr(H2) = 1$\times $2 = 2
Selleks, et koguda puhtamaid gaase (ilma lisanditeta), rakendatakse tihti meetodit, kus kogutav gaas juhitakse läbi vee. Oluline on aru saada, et gaasi saab koguda läbi vee ainult siis, kui see gaas vees ei lahustu. Tuntuimatest gaasidest ei lahustu hästi vees hapnik (O2), vesinik (H2), lämmastik (N2) ja metaan (CH4) ning neid gaase saame koguda läbi vee.
Kuidas me aga teame, et kogutud gaas on hapnik? Hapnik on vajalik gaas põlemiseks ning seega saab teda tõestada hõõguva puupirruga. Kui anumas on puhas hapnik, süttib puupird eredalt põlema.

